基于网络药理学和实验验证探讨荆防颗粒对自身免疫性肝炎小鼠的治疗作用及作用机制
张永康,孙成宏,王西双,姚景春,张贵民*
1.山东中医药大学药学院,山东 济南 250300
2.鲁南制药集团股份有限公司 中药制药共性技术国家重点实验室,山东 临沂 276006
3.鲁南制药集团股份有限公司 临沂市天然药物免疫药理毒理重点实验室,山东 临沂 276006
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种以肝实质损害为特征的炎症性疾病,在亚太地区的发病率约为0.005%~0.025%,且呈逐年上升趋势[1],如果不及时治疗,则会迅速发展为肝硬化和肝衰竭,严重危害人类健康。AIH 的发病原因较为复杂,临床上多以糖皮质类激素如地塞米松磷酸钠注射液等进行治疗,但极易引起机体诸多不良反应[2]。因此,研究安全、有效和经济的治疗药物仍然是治疗AIH 的临床需要。荆防颗粒组方来源于明代张时彻《摄生众妙方》中的荆防败毒散,由荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草11 味中药组成,具有畅达气机,扶助正气,消除风寒、湿热、痰瘀、气滞的作用,广泛用于多种系统疾病的治疗[3-4]。现代药理学研究表明,荆防颗粒具有良好的抗炎作用,可增强机体免疫力,保护肝脏的免疫功能[5-8]。
网络药理学作为药物研究的新模式,通过构建成分-靶点-疾病等相互作用网络,对中药复方物质基础和作用机制研究提供新的方法[9-10]。本课题组前期研究表明,荆防颗粒对刀豆蛋白 A(concanavalin A,Con A)诱导的免疫性肝炎具有显著的保护作用,但其作用机制尚不清楚。因此,本研究旨在从网络药理学的角度预测荆防颗粒治疗AIH 的成分、靶点和信号通路,结合实验验证深入探究荆防颗粒对AIH 的治疗作用及作用机制,为临床上应用荆防颗粒治疗AIH 提供理论依据。
1 材料
1.1 动物
SPF 级雄性ICR 小鼠,体质量(28±2)g,8 周龄,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2021-0006,使用许可证号SYXK(鲁)-20180008。动物饲养于室温(23±2)℃、相对湿度40%~70%的环境中,12 h 光暗循环,自由进食饮水,适应性喂养7 d 后进行实验。动物实验经鲁南制药集团股份有限公司实验动物伦理委员会批准(批准号HN-IACUC-2022-097)。
1.2 药品与试剂
荆防颗粒(国药准字 Z37020357,批号8022009004)由山东新时代药业有限公司提供;地塞米松磷酸钠注射液(批号2202160612)由山东辰欣药业股份有限公司提供;Con A(批号C2010)购自美国Sigma Aldrich 公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号H052-1)购自南京建成生物工程研究所;小鼠白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒(批号ml063132-2)、小鼠IL-6 检测试剂盒(批号ml1002293-2)、小鼠IL-8/CXC 型趋化因子配体8(CXC chemokine ligand 8,CXCL8)检测试剂盒(批号ml58632)购自Mlbio 公司;磷酸化核因子-κB p65(phosphorylated nuclear factorκB p65,p-NF-κB p65)抗体(批号80477)、NF-κB p65抗体(批号8242)、NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)抗体(批号13158)、抗体分泌细胞(antibody-secreting cell,ASC)抗体(批号67824)、剪切型半胱氨酸天冬氨酸蛋白酶-1(cleaved cysteinasparate protease-1,Caspase-1)抗体(批号89332)、IL-1β 抗体(批号27989)、B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号3498)、Bcl-2 相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号5023)、Janus 激酶2(Janus kinase 2,JAK2)抗体(批号3230)、磷酸化JAK2(phosphorylated JAK2,p-JAK2)抗体(批号3771)、信号传导和转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)抗体(批号9139)、磷酸化STAT3(phosphorylated STAT3,p-STAT3)抗体(批号9145);购自美国CST 公司;β-actin 抗体(批号AF0003)购自Beyotime;IL-6 抗体(批号ab233706)、TNF-α 抗体(批号ab183218)、HRP 标记的山羊抗兔二抗(批号ab6721)、HRP 标记的兔抗鼠二抗(批号ab6728)购自英国Abcam 公司。
1.3 仪器
冷冻离心机(美国Sigma 公司);Pannoramic SCAN 图像扫描及分析系统(匈牙利3D HISTECH公司);Tissue-Tec®VIPTM5 Jr 型全封闭组织脱水机、Tissue-Tec®TECTM5 组织包埋机(日本樱花检验仪器株式会社);RM2235 型轮转式病理切片机、HI1210 型组织摊片机、ST5020 型自动染色机(德国Leica 公司);BX53 型生物显微镜(日本Olympus公司);ELX-800 型酶标仪(美国Bio Tek 公司);BS-800 型全自动生化分析仪(深圳市迈瑞生物医学电子有限公司);DYY-7C 型电泳仪、DYCZ-40D 型转移槽(北京六一生物科技有限公司);化学发光成像系统(上海勤翔科学仪器有限公司)。
2 方法
2.1 网络药理学分析
2.1.1 荆防颗粒靶点的收集 从《中国药典》2020年版中查询荆防颗粒11 味中药的性味与归经,借助TCMSP 数据库分别以荆芥、防风、羌活、独活、柴胡、前胡、川芎、枳壳、茯苓、桔梗、甘草为关键词搜索各中药的化学成分。以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18 为筛选标准,获得荆防颗粒的活性成分及其预测靶点。将收集到的所有靶点输入UnitProt数据库进行标准化转换,以获取目标基因名称。同时,将目标基因导入Cytoscape 3.7.0 软件,通过度值确定荆防颗粒的关键活性成分。
2.1.2 AIH 的疾病靶点检索 使用Omim 数据库(https://www.omim.org/)、 Drugbank 数据库(https://go.drugbank.com/)和 GeneCards 数据库(https://www.genecards.org/),输入关键词“autoimmune hepatitis”筛选疾病目标,将3 个数据库中符合疾病的基因结果汇总后去重,筛选得到最终AIH 的相关靶点基因。
2.1.3 荆防颗粒和AIH 交集靶点基因的收集以及蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建 使用Venn 图(http://bioinformatics.psb.ugent.be/webtools/Venn/)将荆防颗粒成分靶点与AIH 相关靶点取交集以获得荆防颗粒治疗AIH的关键靶点。将获得的关键靶点导入STRING 数据库(http://www.string-db.org)获取PPI网络。同时,将PPI网络图导入Cytoscape 软件并可视化,利用CytoHubba 插件进行拓扑分析,默认设置显示前10名的蛋白节点,将度值和最大邻居组件(maximum neighborhood component,MNC)前10 位的靶点作为核心靶点。
2.1.4 基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将获得的荆防颗粒治疗AIH 的关键靶点上传Metascape 数据库(http://metascape.org),进行KEGG 通路和GO 功能富集分析。将校正P值≤0.01 的项目进行筛选,根据富集基因的校正P值来排序,选取排名在前的相关信号通路,然后通过生物信息学云平台(http://www.bioinformatics.com.cn/)可视化上述分析并生成气泡图。最后,通过Cytoscape 软件建立活性成分-靶点网络图。
2.2 实验验证
2.2.1 AIH 小鼠模型的建立 ICR 小鼠随机分为对照组、模型组及荆防颗粒低、中、高剂量(2、4、8 g/kg)组和地塞米松(0.8 mg/kg)组,每组10 只。除对照组外,其余各组iv 10 mg/kg Con A 建立AIH模型。模型建立后1 h,荆防颗粒各剂量组ig 相应药物,地塞米松组ip 地塞米松磷酸钠注射液,对照组和模型组ig 等体积纯净水,记录造模24 h 后各组小鼠死亡率。小鼠ip 1%戊巴比妥溶液麻醉后,随机采集血清和肝组织样本。
2.2.2 肝功能和血液生化分析 将各组小鼠血液于4 ℃、3500 r/min 离心10 min,立即吸取上清液,用全自动生化分析仪检测丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)活性。
2.2.3 肝组织病理学分析 取各组小鼠肝脏组织,甲醛固定后,经梯度乙醇脱水并制作石蜡切片,用自动染色机对组织(5 μm)进行苏木素-伊红(HE)染色,于光学显微镜下观察各组小鼠肝脏病理学的差异。根据肝脏Knodell 评分系统[11]评价炎性细胞浸润和坏死程度:0 分,无炎性细胞渗透和坏死;1分,轻度炎性细胞浸润和坏死;2 分,中度炎性细胞浸润和坏死;3 分,严重炎性细胞浸润和坏死。
2.2.4 肝组织炎性因子水平检测 取各组小鼠肝组织,在PBS 溶液中匀浆后4 ℃、12 000×g离心10 min,取上清液,按ELISA 试剂盒说明书测定IL-6、TNF-α、IL-1β 和CXCL8 的含量。
2.2.5 Western blotting 检测肝组织p-NF-κB p65、NF-κB p65、NLRP3、ASC、cleaved Caspase-1、IL-1β、Bcl-2、Bax、JAK2、p-JAK2、STAT3、p-STAT3、IL-6和TNF-α 蛋白表达 取各组小鼠肝脏组织,加入含有磷酸酶抑制剂和PMSF 的RIPA 裂解液,提取总蛋白,按照BCA 试剂盒测定蛋白浓度。蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,用5%脱脂牛奶室温封闭2 h 后,加入相应抗体,4 ℃孵育过夜;PBST 洗涤3 次,加入二抗,室温孵育2 h;PBST 洗涤3 次,加入ECL 发光试剂显影,采用凝胶成像系统成像,并使用Image J软件分析条带灰度值。
2.2.6 统计学分析 实验数据通过GraphPad Prism 8.0.2 软件进行统计分析,结果以±s表示,多组间数据比较采用单因素方差分析。
3 结果
3.1 荆防颗粒活性成分与靶点的筛选
通过TCMSP 数据库检索荆防颗粒中的11 味药中所有的潜在靶点,以同时满足OB≥30%和DL≥0.18 为筛选条件,再通过UniProt 数据库更正和删除重复项目后,共鉴定出269 个与荆防颗粒相关的非重复性靶点和159 个活性成分。将信息导入Cytoscape 软件分析荆防颗粒“中药-成分-靶点”网络,度值排名前10 位的活性成分见表1。

表1 荆防颗粒活性成分(前10)Table 1 Active ingredients of Jingfang Granules(top 10)
3.2 荆防颗粒治疗AIH 的关键靶点网络构建
通过Genecard、OMIM 和Drugbank 数据库共获得761 个AIH 疾病相关靶点,汇总去重后,共获得343 个非重复性靶点。将269 个荆防颗粒靶基因与343 个潜在AIH 相关靶基因取交集,共获得25个交集靶点(图1-A),为荆防颗粒治疗AIH 的潜在靶点。应用Cytoscape 软件对荆防颗粒治疗AIH的25 个潜在靶点构建成分-疾病靶点网络,见图1-B。将潜在靶点导入STRING 数据库得到PPI网络,进一步分析获得其核心网络,并通过Cytoscape 软件可视化,见图1-C。拓扑分析前10 名的核心网络靶点包括IL-6、TNF-α、IL-1β、STAT3、CXCL8、IL-10、γ 干扰素(interferon-γ,IFN-γ)、IL-4、Caspase-8(CASP8)和C 反应蛋白(C-reaction protein,CRP)。
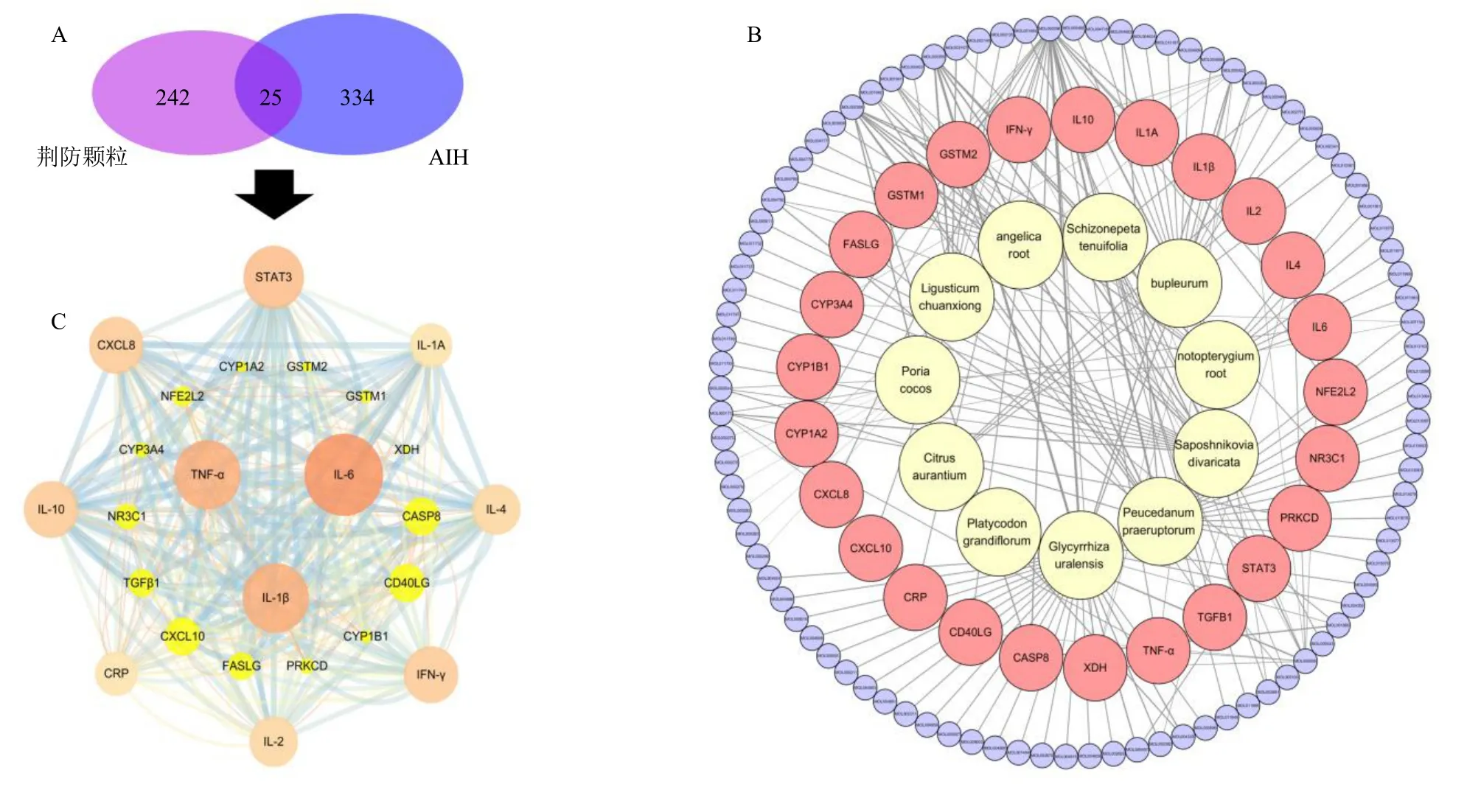
图1 荆防颗粒治疗AIH 的核心靶点和PPI 网络Fig.1 Core target and PPI network of Jingfang Granules in treating AIH
3.3 GO 功能和KEGG 通路富集分析
GO 功能富集分析主要包括生物过程(biological process,BP)、细胞成分(cell component,CC)和分子功能(molecular function,MF)。将25个潜在治疗靶点导入Metascape 数据库后,得到GO条目689 个(P<0.01),生成了BP、MF、CC 和KEGG 富集分析结果。其中BP 条目共646 个,主要涉及细胞因子的产生、炎症反应、凋亡信号通路和免疫过程;MF 条目34 个,主要参与细胞因子受体结合,包括肿瘤坏死因子受体结合;CC 条目9 个,主要涉及质膜和囊泡(图2)。KEGG 通路富集分析筛选得到93 条通路(P<0.01),结果表明,荆防颗粒可能通过调节炎症反应、细胞因子、肝细胞坏死等信号通路治疗AIH(图3)。

图2 荆防颗粒治疗AIH 靶点的GO 功能富集分析Fig.2 GO function enrichment analysis of targets of Jingfang Granules in treating AIH

图3 荆防颗粒治疗AIH 靶点的KEGG 通路富集分析Fig.3 KEGG pathway enrichment analysis of targets of Jingfang Granules in treating AIH
3.4 荆防颗粒对AIH 模型小鼠的保护作用
通过建立Con A 诱导的AIH 小鼠模型,验证网络药理学分析的结果。如图4-A所示,模型组小鼠死亡率远高于对照组,而各给药组小鼠死亡率均低于模型组,且荆防颗粒中、高剂量组小鼠死亡率低于地塞米松组。如图4-B、C所示,与对照组比较,模型组小鼠血清中ALT 和AST 活性均显著升高(P<0.001);与模型组比较,荆防颗粒中、高剂量组和地塞米松组血清中ALT 和AST 活性均显著降低(P<0.05、0.01)。如图4-D所示,模型组小鼠肝组织出现明显的门脉炎症,中央静脉周围出现严重的窦性充血以及点状或斑片状坏死;给予荆防颗粒或地塞米松磷酸钠注射液治疗后,小鼠肝脏中的炎症细胞浸润和细胞坏死受到显著抑制(P<0.05、0.01)。以上结果表明,荆防颗粒可以减轻Con A 诱导的AIH 小鼠的肝损伤,且药效优于地塞米松磷酸钠注射液。

图4 荆防颗粒对AIH 小鼠的保护作用(±s,n = 10)Fig.4 Protective effect of Jingfang Granules on AIH mice(±s,n = 10)
3.5 荆防颗粒对AIH 小鼠肝组织炎症因子水平的影响
网络药理学结果和KEGG 通路富集分析表明,大多数确定的关键靶点在炎症细胞因子的相互作用中富集。通过ELISA 试剂盒检测肝组织中相关炎症因子水平,如图5所示,与对照组比较,模型组小鼠肝组织中TNF-α、IL-1β、IL-6 和CXCL8 水平均显著升高(P<0.05、0.01);与模型组比较,荆防颗粒高剂量组TNF-α 水平显著降低(P<0.05),荆防颗粒中、高剂量组和地塞米松组IL-1β 水平显著降低(P<0.05),荆防颗粒高剂量组和地塞米松组IL-6水平显著降低(P<0.05),荆防颗粒中、高剂量组CXCL8 水平显著降低(P<0.05),表明荆防颗粒对Con A 诱导的AIH 小鼠具有显著的抗炎作用。基于上述结果,选择荆防颗粒高剂量(8 g/kg)组作为代表组,探讨荆防颗粒治疗AIH 的作用机制。

图5 荆防颗粒对AIH 小鼠的抗炎作用(±s,n = 6)Fig.5 Anti-inflammatory effect of Jingfang Granules on AIH mice(±s,n = 6)
3.6 荆防颗粒对AIH 小鼠肝组织IL-6/STAT3 信号通路相关蛋白表达的影响
如图6所示,与对照组比较,模型组小鼠肝组织中IL-6、p-JAK2/JAK2、p-STAT3/STAT3 和Bax蛋白表达水平均显著升高(P<0.05、0.01),Bcl-2蛋白表达水平明显降低(P<0.05);与模型组比较,荆防颗粒高剂量组小鼠肝组织中 IL-6、p-JAK2/JAK2、p-STAT3/STAT3 和Bax 蛋白表达水平均显著降低(P<0.05、0.01),Bcl-2 蛋白表达水平明显升高(P<0.05)。

图6 荆防颗粒对AIH 小鼠肝组织IL-6/STAT3 信号通路相关蛋白表达的影响(±s,n = 3)Fig.6 Effect of Jingfang Granules on IL-6/STAT3 signal pathway related protein expressions in liver of AIH mice(±s,n = 3)
3.7 荆防颗粒对AIH 小鼠肝组织NLRP3/IL-1β 信号通路相关蛋白表达的影响
如图7所示,与对照组比较,模型组小鼠肝组织中NLRP3、ASC、cleaved Caspase-1 和下游IL-1β蛋白表达水平均显著升高(P<0.05、0.01),表明模型组小鼠具有明显的炎症反应;与模型组比较,荆防颗粒高剂量组NLRP3、ASC、cleaved Caspase-1和下游IL-1β 蛋白表达水平均显著降低(P<0.05)。
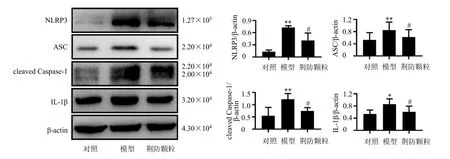
图7 荆防颗粒对AIH 小鼠肝组织NLRP3/IL-1β 信号通路相关蛋白表达的影响(±s,n = 3)Fig.7 Effect of Jingfang Granules on NLRP3/IL-1β signal pathway related protein expressions in liver of AIH mice(±s,n = 3)
3.8 荆防颗粒对AIH 小鼠肝组织TNF-α/NF-κB 信号通路相关蛋白表达的影响
如图8所示,与对照组比较,模型组小鼠肝组织中TNF-α 和p-NF-κB p65/NF-κB p65 蛋白表达水平均显著升高(P<0.01);与模型组比较,荆防颗粒高剂量组TNF-α 和p-NF-κB p65/NF-κB p65 蛋白表达水平均显著降低(P<0.05、0.01),表明荆防颗粒能够抑制TNF-α/NF-κB 信号通路相关蛋白的磷酸化水平。

图8 荆防颗粒对AIH 小鼠肝组织TNF-α/NF-κB 信号通路相关蛋白表达的影响(±s,n = 3)Fig.8 Effect of Jingfang Granules on TNF-α/NF-κB signal pathway related protein expressions in liver of AIH mice(±s,n = 3)
4 讨论
AIH 是一种典型的自身免疫性疾病,发生于任何年龄和种族[12-13]。几十年来对治疗AIH 药物的研究表明,单一靶点药物难以解决所有问题[14]。近年来,中医药治疗AIH 因其药理作用明显、不良反应少而受到越来越多的关注[15]。荆防颗粒具有改善能量代谢循环、解表驱汗、抗炎等作用[3-5,8,16]。研究表明,荆防颗粒通过降低促炎因子表达、抗氧化、调节转化生长因子-β(transforming growth factor-β,TGF-β)/Smad4 信号通路对CCl4诱导的小鼠肝纤维化有明显的治疗作用[17]。此外,荆防颗粒还可以通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路发挥解酒保肝作用[18]。
网络药理学综合了中药有效成分、相应靶点和相应疾病3 个方面,并将其作为3 种不同类型的节点,形成“成分-靶点-疾病”网络,揭示了中药治疗相关疾病的有效成分和作用机制[9]。李志杰等[19]通过网络药理学探究了苦黄颗粒治疗AIH 的活性成分和作用机制。郝建亨等[20]通过网络药理学技术探究了丹参酮IIA治疗AIH 的潜在靶点与通路之间的关系。本研究通过网络药理学和实验验证探究荆防颗粒治疗AIH 的作用机制,确定了槲皮素是荆防颗粒最重要的活性成分,其次是木犀草素、β-谷甾醇、山柰酚和汉黄芩素等。通过Venn 图确定荆防颗粒与AIH 疾病相关的25 个中心靶点。成分-靶点网络表明,荆防颗粒在AIH 治疗中作用于多个靶点并产生协同效应。GO 功能和KEGG 通路分析表明,大多数靶点在炎症和凋亡过程中富集。网络药理学分析未提供特定的信号通路靶点,但本研究从荆防颗粒治疗AIH 相关的交叉靶点中发现了炎症和凋亡通路。PPI网络显示IL-6、TNF-α、IL-1β、STAT3 和CXCL8 是5 个度值最大的靶点,这些靶点都表明了荆防颗粒对AIH 的抗炎和抗凋亡特性,实际可能存在涉及更有效成分和作用机制的暗示。
Con A 诱导的AIH 模型是一种具有代表性的、易于构建的AIH 模拟模型,也是一种急性肝损伤模型,可导致高死亡率[21]。此外,Con A 诱导的AIH模型的典型特征为炎症细胞因子的分泌,ALT 和AST 活性升高,肝细胞凋亡和坏死异常[22]。本研究结果表明,荆防颗粒能显著降低Con A 诱导的AIH模型小鼠的死亡率、肝组织炎症和细胞凋亡,并能抑制AIH 小鼠血清ALT 和AST 的活性。
异常的IL-6/STAT3 信号通路在AIH 的发生和发展中起着关键作用,抑制IL-6/SATA3 信号通路可以减轻Con A 诱导的肝损伤[23]。在自身免疫炎症性疾病模型中,分泌的IL-6 通过gp130 与受体结合,激活JAK2 并触发STAT3 通路,调节肝细胞凋亡[24]。Bcl-2 表达提高有利于增强细胞的抗凋亡功能,而Bax 的增加则促进细胞凋亡。Bax/Bcl-2 值通常用来表示细胞凋亡水平[25-26]。李翔子等[27]研究结果证实,荆防颗粒可以通过抑制JAK2/STAT3 通路调节T 淋巴细胞亚群的平衡,在荨麻疹动物模型中发挥抗炎作用,从而保护小鼠免受自身免疫性疾病。曹天佑等[28]研究证实,荆防颗粒可显著抑制由炎症导致的细胞凋亡。IL-1β 在多种自身炎症性疾病中发挥重要的作用,IL-1β 能够通过支持T 细胞存活、上调淋巴细胞上的IL-2 受体、促进B 细胞增殖和Th17 细胞分化来介导炎症反应[29]。NLRP3 是先天免疫的重要组成部分,由NLRP3、ASC 和Caspase-1组成,用于诱导IL-1β 的释放,在AIH 肝脏炎症中起关键作用[30]。此外,IL-1β 能与IL-6 和TNF-α 产生协同作用,参与炎症细胞的释放和炎症通路的激活。TNF-α 是一种炎症细胞因子,可以激活固有免疫途径并触发炎症反应[31]。TNF-α 通过介导NF-κB的激活来刺激细胞因子的产生,并增强AIH 的炎症反应[32]。NF-κB 是一种主要转录因子,介导Con A诱导的免疫炎症反应,并参与TNF-α 诱导的不同类型细胞中炎症蛋白的表达[33]。El-Agamy 等[34]阐明了NF-κB 在Con A 诱导的AIH 发病机制中的作用,Con A 刺激NF-κB 的磷酸化并启动和调节炎症过程,促进炎症细胞因子如TNF-α、IL-6、IL-1β 和IFN-γ 的产生。本研究结果表明,荆防颗粒显著抑制了AIH模型小鼠肝组织中STAT3、NLRP3 和NF-κB 信号通路相关蛋白的表达。荆防颗粒可能通过抑制STAT3、NLRP3 和NF-κB 信号通路的激活,在细胞凋亡和炎症水平上对AIH 产生抑制作用。因此,STAT3、NLRP3 和NF-κB 信号通路是荆防颗粒治疗AIH 的关键靶点。
AIH 早期发病原因主要为CD4+细胞活化和释放IL-1β、IL-6、CXCL8、TNF-α 等多种细胞因子[35-37]。这些细胞因子在AIH 中被诱导,并导致相关的有害免疫反应[38]。而Con A 诱导的AIH 炎症反应主要由TNF-α、IL-1β、IL-6 和CXCL8 的增加介导[36-37,39-40]。ELISA 和Western blotting 结果表明,荆防颗粒显著抑制STAT3、NLRP3 和NF-κB 信号通路相关蛋白(IL-6、p-JAK2、p-STAT3、NLRP3、ASC、Caspase-1、
IL-1β、TNF-α、p-NF-κB p65)的表达,以上蛋白被激活后反过来刺激并调节炎症细胞因子如TNF-α、IL-1β、IL-6 和CXCL8 的分泌。
本研究基于网络药理学和AIH 小鼠模型,探究了荆防颗粒抗炎作用机制。荆防颗粒通过多成分、多靶点、多通路的协同作用发挥抗炎、抗凋亡作用治疗AIH,证实了网络药理学预测的结果,为荆防颗粒治疗AIH 提供依据。
利益冲突所有作者均声明不存在利益冲突

