高聚合度异麦芽寡糖的制备及体外益生功能评价
许 滢,王 蕾,魏贝贝,宿玲恰,陈 晟,吴 敬*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122)
异麦芽寡糖(isomaltooligosaccharides,IMO)是葡萄糖以α-1,6 糖苷键为主连接而成的低聚糖混合物,主要成分为异麦芽糖、潘糖、异麦芽三糖及四糖以上的低聚糖。IMO 甜度柔和,耐热耐酸,升糖指数低,是一种良好的低热量甜味剂,同时具有降低血清胆固醇含量、改善肠道微生物环境等益生效益[1]。由于其优良的理化性质及生理功能,IMO 被广泛应用于功能性食品及医药保健品行业中,拥有巨大的市场需求量。
天然IMO 主要存在于味噌、黄酒等发酵食品中,并以游离状态微量存在于红薯、木薯等淀粉作物中。由于天然提取成本高且工艺复杂,目前市售IMO主要依靠酶法生产,聚合度(degree of polymerization,DP)大概在2~6。主流的工业制备IMO 方法是以淀粉质原料为底物,依靠α-淀粉酶及β-淀粉酶等将淀粉液化、糖化,生成以麦芽糖为主的低聚合度寡糖混合物,再结合α-葡萄糖苷酶的转苷作用生成具有α-1,6 糖苷键的复杂寡糖混合物[2],该方法制备IMO 得率(IMO 产物质量与底物质量的比)一般在50%~55%,即为市售的IMO50,其主要成分为异麦芽糖、异麦芽三糖和潘糖。然而,研究表明,IMO 的益生功能主要归功于三糖及以上的高聚合度组分[3-4]。另一种生产方式是以蔗糖为底物原料,使用葡聚糖蔗糖酶(dextransucrase,DS)合成右旋糖酐,再通过右旋糖酐酶(dextranase,DN)作用水解生产IMO[5],这种生产方法可通过调控底物浓度及DS、DN 使用比例来调整产物聚合度,但由于生产原料蔗糖成本较高,且该方法只能利用蔗糖中的葡萄糖单元,理论得率不超过50%,不适用于工业化生产。易子玲等通过将4,6-α-葡萄糖基转移酶和普鲁兰酶、异普鲁兰酶、异麦芽三糖右旋糖酐酶复配,以淀粉为底物可制备高纯度异麦芽三糖,产物得率为65.3%[6],为以淀粉为底物制备高聚合度IMO提供了新思路,但是该法存在使用复配酶种类多、工艺复杂等问题。因此,如何在低原料成本的基础上,开发简易新工艺,提升产品得率及聚合度是高效制备IMO 主要攻克的难题。
α-葡萄糖苷酶依靠转移单个葡萄糖基生成IMO,其反应机理决定了产物主要集中为二糖、三糖等低DP 组分。在催化转苷反应的同时,α-葡萄糖苷酶还会进行水解反应,形成大量葡萄糖,不利于高DP 组分的生成及稳定[7-8]。环糊精葡萄糖基转移酶(CGTase)属于糖基水解酶13 家族及α-淀粉酶家族,可发生3 种转苷反应(歧化反应、环化反应、偶联反应)及一种水解反应,其中歧化反应为分子间转苷反应。不同于α-葡萄糖苷酶,CGTase 能以直链麦芽低聚糖为供体[9],将葡萄糖、麦芽糖等小分子糖作为受体[10],催化分子间转苷反应,具有提高受体稳定性、改善理化性质等作用[11]。当其以直链多糖为供体和葡萄糖、麦芽糖等为受体时,可以生产得到线性寡糖混合物,进而提高淀粉制糖体系底物利用率[12]。针对工业生产IMO 的问题,在以往制备IMO主要用酶(α-葡萄糖苷酶)的基础上,复配使用了CGTase,提出一种以麦芽糊精为底物,通过使用黑曲霉(Aspergillus niger)来源的α-葡萄糖苷酶复配嗜热脂肪芽孢杆菌(Bacillus stearothermophilus NO2)来源的CGTase 制备IMO 的新方法,将这种双酶复配法制备的聚合度提高的IMO 命名为IMOH。通过单因素实验结合双酶复配对酶转化条件进行了优化,包括pH、温度、反应时间、加酶量、底物种类、复配酶加酶量及复配酶反应时间等,在最优条件下制备得到反应液后,将产品经活性干酵母消化并冷冻干燥处理,对产物结构如相对分子质量、链长分布、键型比例进行测定分析,同时通过体外肠道微生物的发酵对产品的益生效果进行评价。与市售IMO50 比较,双酶复配制备的IMOH中α-1,6 糖苷键键型占比更高,平均相对分子质量更大,益生效果更好。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒 毕赤酵母(Pichia pastoris)KM71、长双歧杆菌(Bifidobacterium longum)、青春双歧杆菌(Bifidobacterium adolescentis)、大肠杆菌(Escherichia coli)、具有A.niger 来源的α-葡萄糖苷酶基因的质粒pPIC9K[13]、具有B.stearothermophilus NO2 来源的环糊精葡萄糖基转移酶(CGTase)基因的质粒pET-24a(+)[14]均保藏于作者所在实验室。
1.1.2 材料与试剂 麦芽糊精:菏泽天邦生物制品有限公司产品;商业化异麦芽寡糖IMO50:山东百龙生物有限公司产品;高温α-淀粉酶、淀粉葡萄糖苷酶、普鲁兰酶:山东隆大生物工程有限公司产品;酵母粉、胰蛋白胨:英国Oxoid 公司产品;牛肉浸粉:美国Neogen 公司产品;异麦芽糖、潘糖、异麦芽三糖标准品:日本Glycarbo 公司产品;其他试剂(均为国产分析纯):上海国药集团产品。
1.1.3 仪器与设备 Agilent 1260 Infinity II 液相色谱系统、Hi-Plex Ca(7.7 mm×300 mm)色谱柱:安捷伦科技有限公司产品;高效凝胶排阻色谱仪:美国怀雅特技术公司产品;HYPERSIL APS2(250 mm×4.6 mm,5 μm)色谱柱、离子色谱仪:美国赛默飞公司产品;全数字化核磁共振波谱仪:德国布鲁克公司产品;厌氧工作站:英国依莱泰科公司产品。
1.1.4 培养基 肠道微生物基础培养基(g/L):蛋白胨2.0,酵母粉2.0,NaCl 0.1,K2HPO40.04,KH2PO40.04,CaCl2·2H2O 0.01,MgSO4·7H2O 0.01,NaHCO30.5,半胱氨酸盐酸盐0.5,胆盐0.5,吐温80 2.0。MRS 培养基(g/L):蛋白胨10.0,酵母粉50,牛肉浸粉10.0,葡萄糖20.0,柠檬酸氢二铵2.0,乙酸钠5.0,K2HPO42.0,MgSO4·7H2O 0.2,MnSO4·H2O 0.05,吐温80 1.0。其余培养基为培养大肠杆菌及毕赤酵母常用培养基:LB、TB、YPD、BMGY、BMMY 等培养基。
1.2 实验方法
1.2.1 α-葡萄糖苷酶及CGTase 酶液的制备 以P.pastoris KM71 为宿主,对α-葡萄糖苷酶基因进行表达;以E.coli BL21(DE3)为宿主,对CGTase 基因进行表达。使用大肠杆菌[14]及毕赤酵母[13]常用培养方法培养对应重组菌株,发酵结束后于8 000 r/min 下离心20 min 收集上清液,即得到对应粗酶液。
1.2.2 酶活力测定 α-葡萄糖苷酶转苷酶活力在pH 5.5 的50 mmol/L 乙酸-乙酸钠缓冲液中测定,缓冲液中溶有50 g/L 的麦芽糖溶液。在45 ℃下,以900 μL 麦芽糖溶液为底物,加入100 μL 稀释一定倍数的酶液,精确反应5 min 后煮沸灭酶。体系中转苷生成的异麦芽糖、异麦芽三糖、潘糖含量由HPLC测定。酶活力定义:在上述条件下,将每分钟催化转苷1 μmol 葡萄糖基所需的酶量定义为一个酶活力单位。CGTase 的歧化酶活力测定方法参考文献[15]中的EPS 法。酶活力定义:该测定条件每分钟转化1 μmol EPS 所需的酶量定义为一个酶活力单位。
1.2.3 高聚合度异麦芽寡糖的制备 以溶于50 mmol/L 乙酸-乙酸钠缓冲液的300 g/L 麦芽糊精为底物,加入一定量的α-葡萄糖苷酶酶液及CGTase酶液,在一定温度下于转速为150 r/min 水浴摇床中反应一定时间,反应完成后煮沸灭酶。将反应体系pH 调整为5.0,加入100 U/g(以底物质量计)高温α-淀粉酶、20 U/g 淀粉葡萄糖苷酶(以底物质量计)及1 U/g(以底物质量计)普鲁兰酶消化处理未反应完全的麦芽糊精,于60 ℃、150 r/min 水浴摇床中反应2 h 后煮沸灭酶,离心得到产物IMOH。
1.2.4 高聚合度异麦芽寡糖的制备工艺优化
1)时间优化 反应条件为pH 5.5、45 ℃,底物为DE 值在15~20 的300 g/L 麦芽糊精,α-葡萄糖苷酶加酶量控制为2 U/g(以底物质量计),每隔6 h取样,至24 h 反应结束。
2)温度优化 控制其他条件不变,将反应温度分别设置为40、45、50、55、60 ℃,反应时间为12 h。
3)pH优化 控制其他条件不变,将反应pH 分别设置为4.0、4.5、5.0、5.5、6.0,反应时间为12 h。
4)底物种类优化 控制其他条件不变,将底物种类分别设置为DE 值为2、DE 值为8~10、DE 值为15~20 的麦芽糊精,反应时间为12 h。
5)加酶量优化 控制其他条件不变,将α-葡萄糖苷酶加酶量分别设置为2、5、10、15、20 U/g(以底物质量计),反应时间为12 h。
6)复配酶加酶量优化 控制其他条件不变,α-葡萄糖苷酶加酶量为5 U/g(以底物质量计),将复配酶(CGTase)加酶量分别设置为10、15、20、25 U/g(以底物质量计),每隔6 h 取样至24 h 反应结束。
1.2.5 酶转化产物的检测 将酶转化产物进行一定比例的稀释后使用0.22 μm 滤膜过滤,制备得到液相检测样品,使用HPLC 检测相关产物的含量,计算得率,其中IMOH包含DP≥3 的高聚合度组分和异麦芽糖。测定高聚合度成分使用的HPLC 程序及参数:Agilent 1260 Infinity II 液相色谱系统,RID 示差检测器,Hi-Plex Ca(7.7 mm×300 mm)色谱柱,柱温80 ℃,检测器温度为40 ℃,以纯水作为流动相,流量为0.5 mL/min,通过面积归一法对产物定量。测定异麦芽糖使用的HPLC 程序及参数:Agilent 1260 Infinity II 液相色谱系统,RID 示差检测器,HYPERSIL APS2(250 mm×4.6 mm,5 μm)色谱柱,柱温及检测器温度为35 ℃,以体积分数为75%的乙腈为流动相,流量为0.8 mL/min,通过外标法对产物定量。
1.2.6 酶转化产物理化性质测定方法
1)酶转化产物的分离 将得到的酶转化产物离心后,加入0.33 g/g(以底物质量计)的活性干酵母消化[16]去除葡萄糖,于30 ℃、200 r/min 摇床下反应8 h 后煮沸灭菌,离心分离后得到上清液。将上清液冷冻干燥,得到产品,即为IMOH粉末。
2)相对分子质量测定 使用高效凝胶排阻色谱法(HPSEC)测定IMOH产物的平均相对分子质量,HPSEC 利用产物在流动相中的体积大小、流动速度对其进行大小测定。HPSEC 设置程序及参数:采用ULtrahydrogelTMLinear(300 mm×7.8 mm)凝胶柱,柱温为45 ℃,以0.1 mol/L NaNO3为流动相,流量为0.9 mL/min。
3)链长分布 使用高效阴离子交换色谱(HPACEPAD)对产物成分进行分析。HPACE-PAD 利用微孔聚合阴离子交换树脂对DP≤12 的糖组分进行交换层析,随后进入检测器进行分析。采用DIONEX ICS-5000+SP-5 离子色谱仪进行检测,使用CarboPac PA1 色谱柱(4 mm× 250 mm),以0.6 mol/L乙酸钠为流动相,流量为1.0 mL/min,使用麦芽糊精作为标准品。
4)核磁光谱分析(1H-NMR)称取20 mg 冷冻干燥后的产物,溶于500 μL 重水中,其中重水中含有用于校准化学位移的内标物0.3 g/L 三甲基硅烷磷酸酯(TMSP)。使用全数字化核磁共振波谱仪AVANCE III 在环境温度下以400 MHz 对产品进行氢谱分析。通过在δ 为5.00 和5.39 处的信号峰峰面积的积分来计算产品的键型比例。
1.2.7 肠道微生物的培养 将菌株于37 ℃恒温恒湿厌氧培养箱中静置培养24~48 h 进行活化。在活化扩大培养后,取一定量的菌液分别转接至含有10 g/L IMOH、市售IMO50、未添加其他碳源(空白)的基础培养基中,使得初始OD600为0.05,于37 ℃恒温恒湿厌氧培养箱中静置培养。分别在6、12、24、36、48 h 取样,测定菌液在600 nm 处吸光度及发酵液pH 变化,分别绘制对应曲线,比较不同碳源下不同肠道微生物的生长状态[17-18]。
2 结果与分析
2.1 高聚合度异麦芽寡糖产物制备
2.1.1 酶转化单因素优化 为了提高IMO 产量,对酶转化涉及参数进行了优化。首先采用单因素实验分析了反应时间、pH、温度、底物种类、加酶量对IMOH制备的影响(见图1)。初步分析得到了IMOH制备最优条件为反应时间12 h,反应温度50 ℃,反应pH 为5.5,底物选择葡萄糖含量较高的DE 值为15~20 的麦芽糊精,α-葡萄糖苷酶加酶量为5 U/g(以底物质量计),在此最优条件下IMO 得率最高可达41.34%。
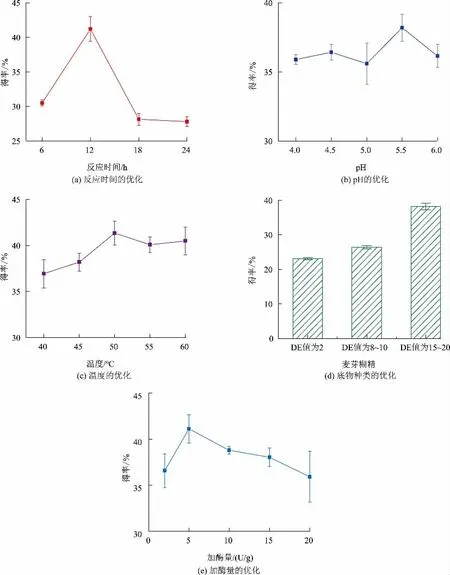
图1 α-葡萄糖苷酶制备IMO 优化结果Fig.1 Optimization of IMO synthesis by α-glucosidase
2.1.2 双酶复配优化 基于单因素研究结果,复配使用CGTase,探究了复配酶加酶量及反应时间对得率的影响。产物得率在不同复配酶加酶量下随时间的变化结果如图2 所示。在复配酶加酶量为15 U/g(以底物质量计),反应时间为18 h 时,得率达到较为稳定的水平,IMOH得率最高可达64.27%,其中三糖及以上高聚合度组分占比可达71.57%。此后再延长反应时间,得率不能得到进一步提升,同时可能因为酶的水解作用,对生成产物进行水解,从而降低制备效率。
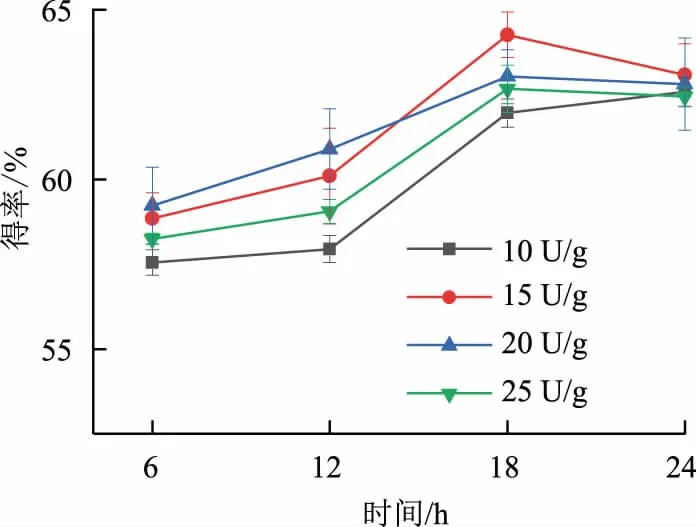
图2 双酶复配优化结果Fig.2 Results of optimization by the dual-enzyme combination
对转化产物消化前葡萄糖含量和消化后高聚合度组分含量进行分析,如表1 所示,实验结果表明,在复配CGTase 后,产物的葡萄糖组分明显减少,IMOH得率得到大幅度提升,证明双酶复配法在一定程度上利用了葡萄糖并生成了更长链的糖分子。

表1 IMOH 组分Table 1 Content of IMOH
根据α-葡萄糖苷酶和CGTase 作用机制,作者绘制如图3 的双酶复配原理示意图。α-葡萄糖苷酶主要以底物中麦芽糖、麦芽三糖为主的寡糖为供体底物,通过第一步反应生成葡萄糖-α-葡萄糖苷酶复合物,第二步以水分子或葡萄糖、麦芽糖等做受体,发生水解或转苷反应[19-20],最终分别生成葡萄糖或异麦芽糖、潘糖等IMO 成分。α-葡萄糖苷酶的水解活性较高,因此体系中会存在大量葡萄糖,在转苷反应中该葡萄糖同时也会与生成的异麦芽糖、潘糖等竞争,不利于三糖及以上聚合度寡糖生成。在复配使用CGTase 后,CGTase 可直接利用反应液中的麦芽多糖作供体,以葡萄糖、麦芽糖等小分子糖为受体发生转苷反应[10],利用体系产生的葡萄糖;同时,也会将麦芽多糖转化成聚合度降低的麦芽寡糖,为α-葡萄糖苷酶提供转苷反应底物。这些可能是复配CGTase 能够提高产物聚合度和得率的原因。

图3 双酶复配原理示意图Fig.3 Schematic diagram of the principle of dual-enzyme combination
2.2 产物结构分析
IMO 的结构与性质取决于聚合度、糖苷键键型比例、葡萄糖单元连接方式等,其中聚合度越高,α-1,6 糖苷键比例越高,产物结构越复杂,IMO 越不易在消化道中被消化,益生效果更好[21]。为确定产物结构与性质,对IMOH平均相对分子质量、链长分布及键型比例进行测定。如图4(a)所示,对产物相对分子质量进行测定,其中相对分子质量与出峰时间之间的关系由不同相对分子质量的葡聚糖标准品进行校正,IMOH平均相对分子质量MW为706,这说明产物的平均聚合度为4.36,相较于市售IMO50 的平均聚合度(3.12)更高。同时,为了确定实际产物组分,使用高效阴离子交换色谱对链长分布进行了分析,结果如图4(b)所示,相较于市售IMO50,IMOH高聚合度组分占比更高。为进一步鉴定产物键型,使用1H-NMR 分析,结果如图4(c)所示,在δ=5.00和δ=5.39 处出现了分别对应于α-1,4 糖苷键和α-1,6 糖苷键的特征峰,按照峰面积比例计算,产物α-1,6 糖苷键达到70.67%,相较于市售IMO50 的键型占比(53.27%),IMOH更占优势。根据测定结果,可以推测出IMOH具有更优良的产品性质。
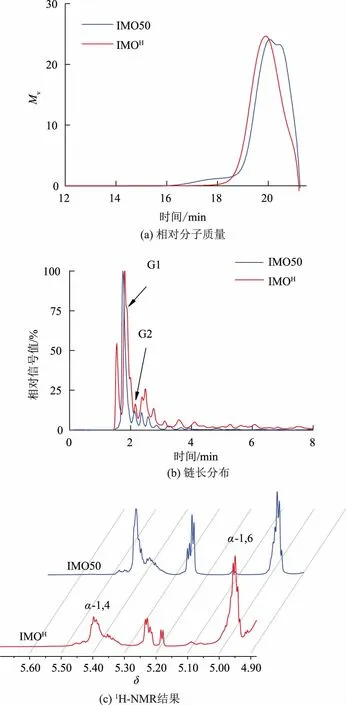
图4 产物性质测定结果Fig.4 Properties detection of the production
2.3 体外益生效果评价
2.3.1 生长曲线变化 目前,许多研究利用肠道微生物对产品进行体外发酵实验确定其实际益生效果。肠道益生菌如双歧杆菌可选择性利用含有α-1,6 糖苷键的益生元进行增殖,在大量增殖后可产生局部厌氧环境,抑制好氧有害菌的生长[17-18]。因此,通过肠道微生物的体外生长状况可推测产品的益生功能。作者将IMOH及市售IMO50 作为碳源添加到基础培养基中,以基础培养基(空白)为对照,选取成人肠道益生菌双歧杆菌中占比最高的两种菌种——青春双歧杆菌及长双歧杆菌[22]和肠道条件致病菌大肠杆菌作为研究对象,考察了IMOH对益生菌、条件致病菌生长状况的影响。图5(a)及图5(b)分别为青春双歧杆菌及长双歧杆菌的生长曲线,IMOH对益生菌青春双歧杆菌更具有增殖作用,对长双歧杆菌作用效果与IMO50 相近;图5(c)为肠道条件致病菌大肠杆菌的生长曲线,IMOH对肠道条件致病菌大肠杆菌具有抑制作用,具有一定的体外益生功能[22-23]。

图5 肠道微生物体外培养生长情况Fig.5 Growth of intestinal microorganisms cultivated in vitro
2.3.2 pH 变化 肠道益生菌在生长过程中会代谢如乙酸、丁酸等短链脂肪酸,这些化合物会降低肠道环境pH,抑制肠道有害菌的生长,同时减少有害代谢物质的生成[24]。通过pH 变化情况,可推断肠道微生物生长环境的变化及有益代谢物质的生成。如图6(a)及图6(b)所示,与空白组相比,青春双歧杆菌及长双歧杆菌在含IMOH基础培养基中培养时产生酸性物质降低环境pH,其pH 变化与IMO50 中的接近;图6(c)为肠道条件致病菌大肠杆菌的生长曲线,大肠杆菌在含IMOH基础培养基中培养时pH变化相较于IMO50 中的更小。

图6 肠道微生物体外培养pH 变化情况Fig.6 pH of intestinal microorganisms cultivated in vitro
3 结语
作者基于α-葡萄糖苷酶生产IMO 的生产工艺,复配使用了CGTase,研究了IMOH的制备工艺、产物结构及体外益生功能。结果显示,在经过酶转化条件优化后,产品IMOH得率达到64.27%,其中三糖及以上高聚合度组分占比达到71.57%。经过消化、冷冻干燥后的产物平均相对分子质量为706,α-1,6 糖苷键键型占比达到70.67%,对益生菌青春双歧杆菌具有增殖效果,且对于肠道条件致病菌大肠杆菌具有抑制效果。IMOH相较于市售IMO50 具有更良好的产品性质及体外益生功能。研究结果为IMO 的工业制备提供了新思路。在后续研究中,可对α-葡萄糖苷酶进行结构分析并改造,提高其转苷活性,或寻找其他来源的转苷活性更强的α-葡萄糖苷酶进行研究,进一步提高IMO 得率。

