变色栓菌来源漆酶的酶学性质及对染料脱色性能的研究
邢 宇,王添誉,陈晓艺,李 苗,王淑婧,李 佥,李宪臻
(大连工业大学 生物工程学院,辽宁 大连 116034)
漆酶是降解多酚类物质的关键酶之一,其能够催化多种酚类、芳香族有机物形成自由基,形成的自由基能够发生聚合或解聚等非酶促次级反应,并且以氧原子为最终受体,产物为水,无其他有害产物。自1883 年日本学者首次从日本紫胶漆树中发现漆酶以来[1],漆酶在食品、造纸、纺织、环保等领域逐渐引起了越来越多的关注[2-3]。目前,已发现的漆酶种类众多,按照来源可以分为植物漆酶、真菌漆酶和细菌漆酶[4]。其中,对真菌来源漆酶的研究数量最多,真菌漆酶主要由担子菌和子囊菌产生,常用的菌株是白腐菌和变色栓菌。
变色栓菌是典型的担子菌门真菌,分布在全国21 个省份,分泌漆酶的能力较强,且生长速度快,易于培养,并且在降解木质素和染料脱色方面表现出优异的性能,有着极大的工业应用价值[5]。李灵灵等筛选分离了一种高效降解木质素的菌株BYL-7,并发现了在初始pH 6.7、温度25 ℃、接种量8%(体积分数)的条件下可明显提高其木质素降解率[6]。Asgher 等发现一种当地白腐真菌IBL-04,通过优化温度和pH 等工艺参数,这种真菌处理纺织工业废水的脱色率在3 d 内显著提高到了84%[7]。法尼醇是一种低水溶性的非环状半萜醇,被广泛用作化妆品和抗癌药物的原料,是目前发现的真菌中研究最多的群体感应因子[8-11]。胡建华在5 L 发酵罐中加入法尼醇改变了变色栓菌的菌丝形态,提高了漆酶的产量,在法尼醇添加浓度为60 μmol/L 时,漆酶产量比对照组提高了93%[12]。在以往的研究中,尚未有关于以法尼醇作为信号分子诱导的变色栓菌发酵体系所产生的漆酶的酶学性质研究,并且对该体系中产生的漆酶在染料脱色方面的探索较少。
作者以土豆培养基为基质,利用变色栓菌进行漆酶的发酵生产,发酵过程中采用法尼醇作为诱导剂[13],测定了漆酶酶活力和蛋白质质量浓度,进一步研究了漆酶的酶学性质和酶促反应动力学。研究其对伊文思蓝、铬黑T、刚果红3 种染料的脱色效果,为揭示漆酶的催化机制提供了基础数据,同时也为进一步深入探索漆酶的催化机制和对漆酶分子在蛋白质水平上进行改造以获得具有工业应用价值的漆酶提供了数据支持。
1 材料与方法
1.1 实验菌株
变色栓菌(Trametes versicolor,编号CICC14001):中国工业微生物菌种保藏管理中心提供。
1.2 实验试剂
邻苯二酚:上海阿拉丁试剂有限公司产品;酒石酸、酒石酸钠:国药集团化学试剂有限公司产品;法尼醇:合肥博美生物科技有限责任公司产品;磷酸二氢 钾、CaCl2·2H2O、MgSO4·7H2O、NH4H2PO4、FeSO4·7H2O、葡萄糖、CuSO4·5H2O:天津市科密欧化学试剂有限公司产品;CaCl2·2H2O、MgSO4·7H2O、NH4Cl:天津市大茂化学试剂厂产品;考马斯亮蓝G250:鼠来宝(武汉)生物科技有限公司产品;刚果红、铬黑T、伊文思蓝:上海源叶生物科技有限公司产品;以上试剂均为分析纯(AR)。
1.3 主要设备
电子天平:上海舜宇恒平科学仪器有限公司产品;立式高压蒸汽灭菌锅:浙江力辰仪器科技有限公司产品;SpectraMax Plus384 酶标仪:上海仪电科学仪器股份有限公司产品;紫外-可见分光光度计:铂金埃尔默仪器有限公司产品;微生物培养箱:杭州坤天科技有限公司产品;BILON 超声波清洗机:上海比朗仪器制造有限公司产品;PHSJ-3F 型pH计:上海雷磁仪器有限公司产品;TDZ5-WS 台式低速离心机:上海三崴医疗设备有限公司产品;热风循环烘箱:吴江华飞电热设备有限公司产品;XYSYG-11 恒温水浴锅:上海昕仪恒温水浴锅公司产品;全温型多振幅高速轨道摇床:上海智城分析仪器厂产品。
1.4 菌种培养方法
1.4.1 斜面活化 配制土豆培养基,称取去皮土豆200 g,加入适量去离子水,煮沸30 min,纱布过滤后定容至1 L,然后加入葡萄糖20 g、琼脂粉15 g,加热融化后分装至试管中,经121 ℃、20 min 高温灭菌后制成斜面,将菌接种在斜面上26 ℃培养7 d。
1.4.2 种子扩培 配制土豆培养基,称取去皮土豆200 g,加入适量去离子水,煮沸30 min,纱布过滤后定容至1 L,再加入葡萄糖20 g,搅拌至溶解,分装至250 mL 三角瓶中(100 mL/瓶)。将斜面菌丝体接种到种子培养基中,26 ℃、150 r/min 培养7 d,即形成一级种子培养液;再将一级种子培养液接种到新鲜的种子培养基中,接种量为10%(体积分数),26 ℃培养5 d,即形成二级种子培养液。
1.4.3 摇瓶发酵 发酵培养设置两组,分别为常规发酵体系(即不添加法尼醇的对照组)与以法尼醇为诱导剂的变色栓菌发酵体系。常规发酵体系的发酵培养基配方为:1 L 培养基中含KH2PO40.2 g、CaCl2·2H2O 0.1 g、MgSO4·7H2O 0.05 g、NH4H2PO40.5 g、FeSO4·7H2O 0.035 g、葡萄糖2 g、NH4Cl 0.27 g、CuSO4·5H2O 0.02 g,充分溶解后,分装至250 mL 三角瓶中(50 mL/瓶),随后将二级种子培养液(菌球状培养物)接种于发酵培养基中,26 ℃、150 r/min 培养7 d,接种量为10%(体积分数),发酵前期pH 控制在4.0 左右。法尼醇为诱导剂的变色栓菌发酵体系则是在接种前将法尼醇经0.22 μm无菌滤膜过滤添加到常规发酵培养基中,浓度为4 mmol/L[13],26 ℃、150 r/min 培养7 d,诱导漆酶发酵过程。
1.5 酶活力测定
向10 mL 离心管中加入3 mL 0.1 g/dL 邻苯二酚溶液和适量漆酶发酵液,在25 ℃下反应5 min,随后利用紫外-可见分光光度计测定450 nm 处的吸光度,已知摩尔吸光系数为2 211 L/(mol·cm),漆酶酶活力的计算公式如下式(1):
式中:E 为酶活力,U/L;V酶为漆酶溶液体积,mL;V总为该反应体系总体积,mL;A测为酶液反应后吸光度;A0为酶液未反应前吸光度;Δt 为反应时间,min;ε 为摩尔吸光系数,L/(mol·cm)。
酶活力定义为:1 min 氧化1 μmol 邻苯二酚所需漆酶的量为一个酶活力单位(U)。实验结果为3个平行实验的平均值。
1.6 蛋白质质量浓度测定
1.6.1 制作BSA 标准曲线 根据Bradford 的原理,配制1.0 mg/mL 牛血清白蛋白溶液,并稀释为10、20、30、50、80、100 μg/mL 的标准蛋白 质溶 液。将800 μL 考马斯亮蓝G250 溶液加入200 μL 标准蛋白质溶液中,混合均匀,在室温下反应5 min,确定595 nm 处的吸光度,并绘制吸光度-蛋白质质量浓度标准曲线。
1.6.2 发酵液中蛋白质质量浓度测定 将发酵液在4 ℃、4 000 r/min 条件下离心10 min,取上清液,加入800 μL 考马斯亮蓝G250 溶液,振荡混合均匀,室温下放置5 min,测定595 nm 处吸光度,根据标准曲线计算蛋白质质量浓度。
1.7 漆酶酶学性质研究
1.7.1 最适反应温度与pH 向各试管中加入3 mL pH 4.0 的0.1 g/dL 邻苯二酚溶液和适量漆酶发酵液,分别在20、30、40、50、60 ℃下反应5 min,测定450 nm 处吸光度,每组设置3 组平行实验,实验结果为3 组平行实验的平均值。
向小烧杯中加入3 mL 的0.1 g/dL 邻苯二酚溶液和适量的漆酶发酵液,用pH 计调节pH 到3.0、4.0、5.0、6.0、7.0,分别在25 ℃下反应5 min,然后于450 nm 处测定吸光度,每组设置3 个平行实验,以每组数据中的最大酶活力为100%,测定漆酶发酵液在各条件下的相对酶活力。
1.7.2 漆酶的热稳定性 将培养好的漆酶发酵液在25、35、45、55、65、75 ℃下保藏1 h,而后加入底物,在25 ℃下反应5 min,在450 nm 处测定吸光度,每组设置3 个平行实验。
1.7.3 酶促反应动力学 分光光度法由于其反应灵敏且步骤简单,因此被广泛应用于生物化学的分析,朗伯-比尔定律是分光光度法的理论基础,该定律描述了当一束平行单色光垂直穿过装有均匀非散射体系溶液的器皿时,在液层厚度保持不变的情况下,溶液吸光度与浓度成正比[14-15]。将漆酶与邻苯二酚混合后在25 ℃的条件下反应,分别在反应时间为2、5、8、10、15、20、25、30、35 min 时,取样并测定吸光度,利用以下公式对酶促反应动力学进行拟合。
朗伯-比尔定律的数学表达式为:
式中:A 为溶液吸光度;T 为溶液透射比,即为出射光强度与入射光强度之比;ε 为摩尔吸光系数,L/(mol·cm);b 为液层厚度,cm;c 为吸光物质浓度,mol/L。
根据朗伯-比尔定律,可以分析吸光度与产物浓度的关系,通过时间与吸光度的关系可以建立产物浓度与反应时间的动力学方程。一阶动力学方程为:
式中:Ca为底物浓度,mol/L;Cb为产物浓度,mol/L;k1为反应速率常数,min-1;t 为反应时间,min。
二阶动力学方程为:
式中:Ca为底物浓度,mol/L;Cb为产物浓度,mol/L;k2为反应 速率常 数,L/(mol·min);t 为反应时间,min。
将不同浓度的邻苯二酚溶液溶解于pH 为4.0的酒石酸缓冲液中,随后加入适量漆酶发酵液,在25 ℃下反应5 min,建立吸光度-邻苯二酚浓度标准曲线。随后将一定浓度邻苯二酚溶液与漆酶发酵液混合,反应过程中定时从反应体系中吸取溶液测定450 nm 处的吸光度。米氏方程的表达式如下式(5)所示,进一步计算酶促反应动力学参数。
式中:V0为产物生成速率,mmol/(L·min);Vmax为漆酶与底物反应达到饱和时的反应速率,mmol/(L·min);[S]为邻苯二酚浓度,mmol/L;Km为米氏常数,mmol/L。
1.8 漆酶对染料脱色性能的研究
为考察漆酶对刚果红、铬黑T、伊文思蓝3 种染料的脱色性能,分别将3 种染料溶解于50 mmol/L pH 为4.0 的柠檬酸-柠檬酸钠缓冲液中,并对伊文思蓝、铬黑T、刚果红3 种染料在400~800 nm 进行了光谱扫描,确定特征吸收波长[16]。随后取10 mL 发酵液上清液,向溶液中加入30 mL 的染料,其中染料质量浓度均为20 mg/L,在反应过程中,保持反应温度为25 ℃,分别在3 种染料的特征吸收波长下,于0、2、5、7、12、24、28 h 用紫外-可见分光光度计测定吸光度,并计算染料脱色率,同时以脱色率为纵坐标,处理时间为横坐标绘制曲线。脱色率计算公式如式(6)所示:
式中:D 为脱色率,%;A0为染料脱色前吸光度;A 为染料脱色后吸光度。
2 结果与分析
2.1 漆酶酶活力与蛋白质质量浓度测定
将邻苯二酚溶液和适量漆酶发酵液混合,测得的漆酶酶活力为(161.37±1.58)U/L。取200 μL 离心后的发酵上清液,向溶液中加入800 μL 考马斯亮蓝G250 溶液,混合后测定595 nm 处吸光度,计算得到加入法尼醇诱导的漆酶发酵体系中的蛋白质质量浓度为(29.19±1.30)mg/L。而在对照组中,常规发酵体系中的酶活力与蛋白质质量浓度仅为(15.73±3.49)U/L 和(2.78±0.37)mg/L,远远低于添加法尼醇为诱导剂的变色栓菌发酵体系中的酶活力与蛋白质质量浓度。在Hu 等的研究中,利用60 μmol/L 的法尼醇诱导变色栓菌生产漆酶,发酵酶活力可达629.3 U/L,与对照组相比,增加了92.3%[17]。Wang 等发现,添加法尼醇诱导的培养体系在培养6 d 后,胞外漆酶产量达到最大值,酶活力达到(2 189.2±54.7)U/L,比对照组的漆酶产量提高了6.8 倍[18]。作者研究结果进一步证明了法尼醇的加入可以显著提高变色栓菌产漆酶的能力。
2.2 反应温度对漆酶酶活力的影响
将pH 为4.0 的0.1 g/dL 邻苯二酚溶液与适量漆酶发酵液混合,在20~60 ℃反应5 min,测得吸光度后通过酶活力计算公式得到酶活力。由图1 所示,漆酶相对酶活力整体呈现出先增大后减小的趋势,在20~40 ℃时,漆酶酶活力随着温度的上升而提高;当反应温度为40 ℃时,漆酶酶活力达到最大值(160.32±5.34)U/L,可能是由于温度增加,使得邻苯二酚分子间热运动速率加快,分子间碰撞机会增加,漆酶的T1 型Cu2+与邻苯二酚碰撞机会也增加,进而强化了催化邻苯二酚的反应过程。值得注意的是,当反应温度达到40~60 ℃时,虽然此时反应温度更高,分子间热运动速率更快,增加了邻苯二酚与漆酶之间的接触机会,但在高温环境下,发酵液中漆酶本身结构的稳定性遭到了破坏。并且,漆酶作为单电子还原酶,其催化机理本质上是单电子的传递和自由基的形成,漆酶分子中的T1 型Cu2+首先通过底物吸收单电子,使底物变成自由基,自由基可以进行歧化、聚合等非酶促反应,而被吸收的单电子通过His-Cys-His 途径从T1 型Cu2+传递到由T2 型Cu2+和T3 型Cu2+组成的三核铜团簇中,随后氧原子作为最终电子受体经过还原形成水[12-13],电子传递的速率影响着自由基的形成,而高温环境可能会阻碍电子的传递,导致自由基形成难度增加,漆酶催化活性减弱。这与其他漆酶产生菌的研究一致,张初署等研究了食用菌SJ-1 漆酶在25~45 ℃时漆酶酶活力的变化,发现在25~35 ℃时,漆酶酶活力与反应温度成正比,当反应温度为35 ℃时,漆酶酶活力达到最大值,达到峰值后漆酶酶活力下降,直至40 ℃后趋于稳定[19]。Asgher 等通过检测变色栓菌来源漆酶酶活力,发现温度为45 ℃时的酶活力最高。以上研究表明,变色栓菌来源漆酶的最适反应温度为35~45 ℃[20],而作者研究在添加法尼醇的情况下,变色栓菌漆酶的最适反应温度未发生明显变化。
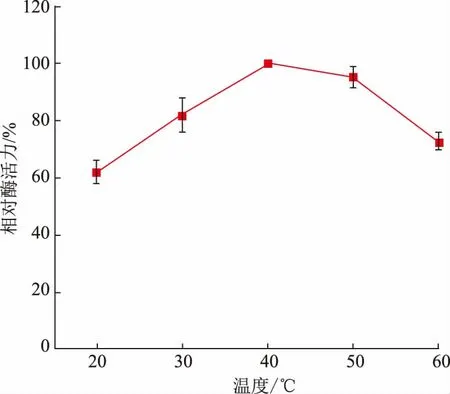
图1 温度对漆酶酶活力的影响Fig.1 Effect of temperature on laccase activity
2.3 热稳定性研究
将漆酶发酵液在不同温度下保持1 h 后,进行酶活力测定,进一步考察变色栓菌来源漆酶的热稳定性。由图2 所示,随着保藏温度的升高,在25~55 ℃的条件下漆酶酶活力缓慢下降,在55 ℃时,相对酶活力为94.32%;之后随着保藏温度逐渐升高至65 ℃时,漆酶酶活力急剧下降,相对酶活力仅为14.29%;当保藏温度进一步升高至75 ℃时,几乎检测不到漆酶酶活力,这一现象说明高温完全破坏了漆酶的结构,使漆酶三级结构的稳定性遭到破坏,发生变性。由实验结果可以看出,变色栓菌来源的漆酶在25~55 ℃时具有较好的热稳定性。Zhang 等的研究发现,变色栓菌来源漆酶在20~60 ℃时的热稳定性良好[21]。Wen 等利用变色栓菌来源漆酶在300~330 K 条件下具有较好的热稳定性[22]。本研究与文献中的实验规律一致,表明法尼醇诱导的变色栓菌来源漆酶也具有良好的热稳定性。
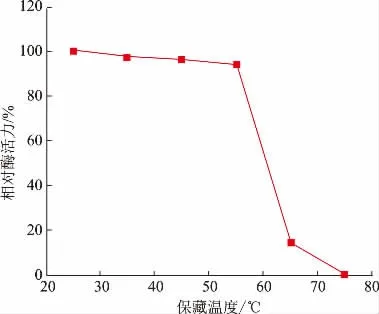
图2 变色栓菌来源漆酶的热稳定性Fig.2 Thermal stability of laccase from Trametes versicolor
2.4 pH 对酶活力影响
漆酶的活性中心是催化众多底物的关键部位,而不同的pH 会通过使漆酶的活性部分或底物处于不同的解离状态,或通过改变漆酶的空间结构从而阻碍漆酶与底物的结合,从而影响漆酶的活性[23]。如图3 所示,在酸性条件下,当pH 由3.0增加至4.0 时,漆酶酶活力上升且达到最大值;当pH 再增加至5.0 时,漆酶酶活力缓慢下降;而当pH为7.0 时,漆酶相对酶活力迅速下降至40.69%。由此可知,在偏酸性条件下,更有利于漆酶活性中心与底物结合,漆酶的活性更高,而在pH 较高的条件下,漆酶与底物的结合受到阻碍,这可能是因为变色栓菌的最适生长pH 通常为弱酸性[24],其产生的漆酶同样对偏酸性的条件有一定的适应性。Aydemir等的研究结果表明,变色栓菌来源漆酶在pH 为4.0时酶活力最高[25]。Wen 等发现变色栓菌来源漆酶在pH 为4.0 的条件下表现出最大活性[22]。这与本研究中添加法尼醇诱导的变色栓菌来源漆酶的最适pH一致。
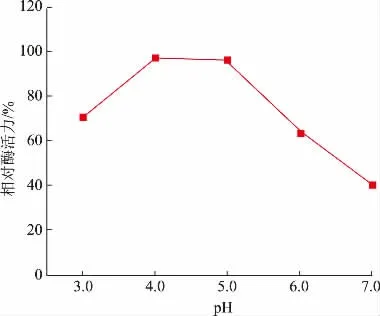
图3 pH 对漆酶酶活力的影响Fig.3 Effect of pH on laccase activity
2.5 酶促反应动力学
由图4 可以看出,随着漆酶与邻苯二酚反应的进行,在0~8 min 时,产物浓度随着反应时间的进行而逐渐增大,几乎成正比关系,在此之后,随着反应时间的进行,产物浓度的增长趋势逐渐减小,直到反应30 min 后,漆酶与底物反应达到饱和,产物浓度趋于稳定。这证实了在初始0~8 min 内测定酶活力,能够更好地反映出变色栓菌漆酶酶活力的大小。
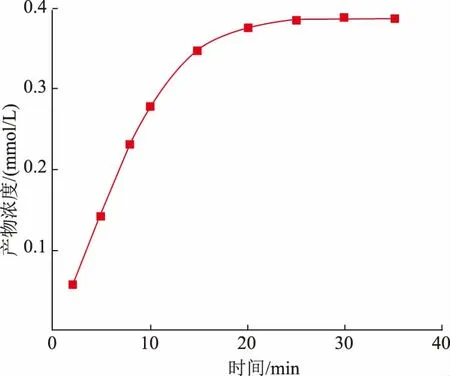
图4 漆酶反应溶液产物浓度与反应时间的变化关系Fig.4 Relationship between product concentration of laccase reaction concentration and reaction time
由图5 可见,经一阶动力学方程与二阶动力学方程拟合后,得到R2分别为0.969 4(见图5(a))和0.970 9(见图5(b)),证明所拟合的曲线能够反映产物浓度与反应时间的关系,同时,Y1(见图5(a))和Y2(见图5(b))与反应时间呈较好的线性关系。
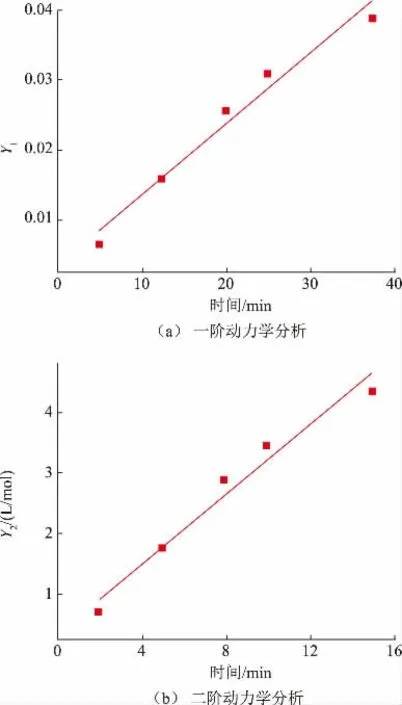
图5 一阶动力学分析和二阶动力学分析Fig.5 First-order kinetic analysis and second -order kinetic analysis
另一方面,Km即米氏常数,是酶促反应的一个重要参数,反映了酶与底物之间亲和力的强度,Km越大,表明漆酶与底物之间亲和力越弱,Km越小,表明漆酶与底物之间亲和力越强。由图6 所示,根据米氏方程(见公式(5)),利用双倒数法,将得到的坐标拟合得到米氏常数Km为4.69 mmol/L,Vmax为0.059 mmol/(L·min),经拟合,漆酶对底物的酶促反应动力学方程为:
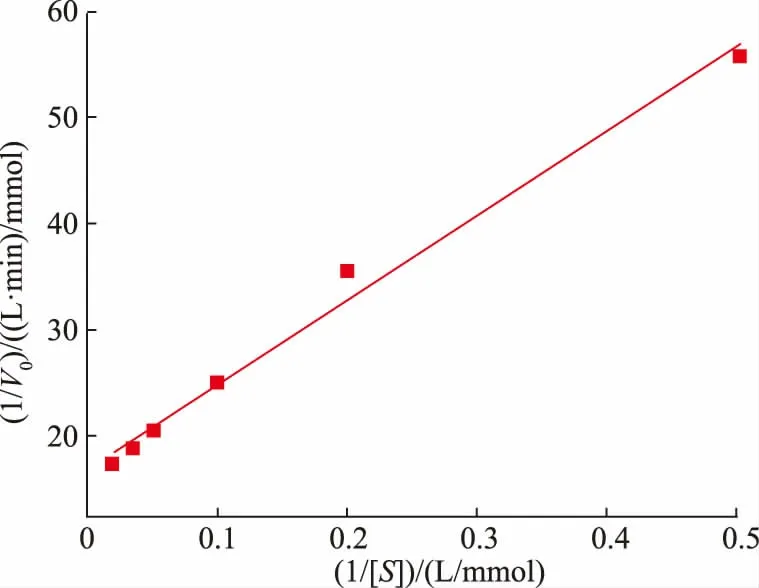
图6 变色栓菌来源漆酶的Km 测定Fig.6 Determination of Km value of laccase from Trametes versicolor
式中:y 为漆酶与底物反应速率的倒数,(L·min)/mmol;x 为邻苯二酚浓度的倒数,L/mmol。
其中R2为0.991 3,表明该方程拟合度较好,能够反映变色栓菌来源漆酶催化过程中速率的变化。
2.6 漆酶对染料脱色性能的研究
作者以偶氮类染料伊文思蓝、铬黑T 以及酸性染料刚果红为研究对象,探究了变色栓菌漆酶对不同染料的脱色性能。漆酶对3 种染料的光谱扫描结果如图7 所示,可以在各染料最大吸收波长附近观察到特征吸收峰,伊文思蓝、刚果红、铬黑T 的特征吸收波长分别为600、555、506 nm。
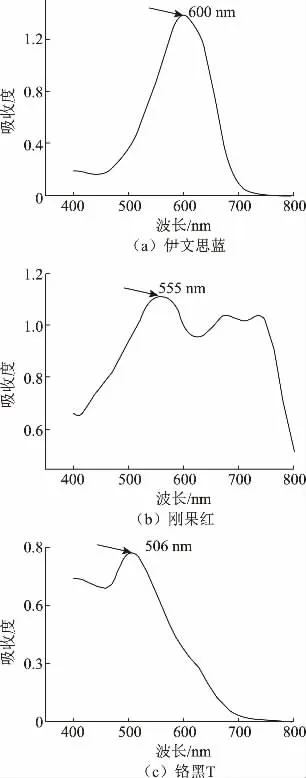
图7 伊文思蓝、刚果红和铬黑T 的可见吸收光谱图Fig.7 Spectrogram of evans blue,congo red and eriochrome black T
如图8 所示,随着处理时间的增长,脱色率逐渐上升。伊文思蓝和铬黑T 在前2 h 脱色率提高较快,2~28 h 脱色率变化较为缓慢,其中伊文思蓝的脱色效果最佳,处理时间2 h 时,脱色率为78.01%,当时间增加到28 h 时,脱色率为86.30%。根据相关文献报道,漆酶能够氧化伊文思蓝中的偶氮基团进而降解伊文思蓝,从而实现染料脱色[26]。Zhang 等利用变色栓菌来源的漆酶进行伊文思蓝脱色实验,发现在pH 为4.6、温度为40 ℃的条件下,反应12 h后,脱色率为82.8%[27]。本研究中采用法尼醇诱导变色栓菌发酵生产的漆酶,对伊文思蓝也表现出了良好的脱色性能,在pH 为4.0、温度为25 ℃的条件下反应12 h,脱色率为83.34%,略高于文献报道的相关数据。实验结果还表明,漆酶对刚果红的脱色效果较差,处理28 h 后,脱色率仅为35.67%。漆酶的氧化还原电位在染料脱色中起着至关重要的作用,由于染料结构的不均一性会在一定程度上影响染料的分子密度从而改变氧化还原电位,因此这可能是导致漆酶对酸性染料(如刚果红)降解速率不理想的原因[28]。因此,变色栓菌来源漆酶对偶氮类染料(如伊文思蓝、铬黑T)降解效率较高,具有潜在的工业应用价值。
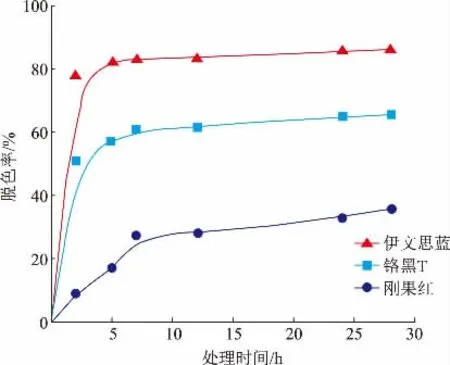
图8 漆酶对伊文思蓝、铬黑T、刚果红3 种染料的脱色率Fig.8 Decolorization rates of evans blue,congo red and eriochrome black T by laccase
在其他相关研究中,有研究者发现将漆酶固定在载体上,可以有效提高漆酶对蒽醌类染料的脱色能力[27,29],这将为下一阶段探索提高漆酶脱色性能的方法和拓宽漆酶在食品、化工和纺织等行业中的应用提供技术准备和数据支持。
3 结语
通过添加法尼醇作为诱导剂提高了变色栓菌发酵生产漆酶的酶活力和蛋白质质量浓度,分别达到(161.37±1.58)U/L 和(29.19±1.30)mg/L。进一步通过单因素实验探究了用法尼醇诱导变色栓菌产漆酶的酶学性质,结果表明,添加法尼醇诱导的变色栓菌发酵生产的漆酶,其酶学性质并未发生改变,在反应温度为40 ℃、pH 为4.0 时,漆酶活性最高,且在25~55 ℃时热稳定性较好。在酶促反应动力学研究的基础上,发现了变色栓菌来源漆酶在染料脱色方面具有良好的工业应用潜力,对伊文思蓝、铬黑T、刚果红3 种染料都表现出了一定的脱色效果,其中对伊文思蓝的脱色效果最好,脱色率2 h内可以达到78.01%。本研究对深入探索法尼醇刺激变色栓菌所产漆酶脱色性能的机制有着重要的研究意义,并为进一步拓宽漆酶在食品、化工和纺织等行业中的应用提供了技术基础和数据支持。

