连续静置培养促进大肠杆菌生长和运动
王 媛, 王芳彬
(合肥工业大学 食品与生物工程学院, 安徽 合肥 230601)
0 引 言
运动性是细菌在环境中移动的一种高效策略,这一过程对于细菌在营养缺乏的条件下生存至关重要[1-2]。文献[3]研究了大肠杆菌K-12(一种肠道共生菌株的模式生物)在连续5 d培养下的生长动力学,该菌株在体外模拟人类肠道内细菌有规律的营养供应。研究表明大肠杆菌K-12在MH培养基中连续培养,每12 h中到达稳定期的时间缩短,生长速度加快,最终导致稳定期和指数期蛋白表达上存在差异,这些蛋白质可能会影响鞭毛运动的能力。迄今为止,大多数将营养与微生物群联系起来的研究都集中在细菌的生长上[4],但是关于营养诱导的细菌生长影响其鞭毛运动的研究却很少。
在大肠杆菌中,鞭毛马达[5-8]是一种跨膜蛋白,可以推动细菌在液体介质中游动。马达旋转由多达11个彼此独立工作的定子驱动,每个定子由4个单位的MotA蛋白和2个MotB蛋白组成,它的运动方式有2种,即在前进和原地打转之间交替。当大肠杆菌上的所有鞭毛马达沿逆时针(counterclock wise,CCW)方向旋转时,细菌就会前进;而当一个或多个马达沿顺时针(clockwise,CW)方向旋转时,细菌会原地打转[9-11]。
本文以E.coliJY26/pKAF131作为模式生物进行研究,对E.coliJY26/pKAF131连续5 d静置[12]培养,通过紫外分光光度计定时检测E.coliJY26/pKAF131的生长状况得到了E.coliJY26/pKAF131连续5 d的生长曲线,并通过乳胶小球粘附在鞭毛马达上,利用倒置显微镜Ti2-E连续5 d观察E.coliJY26/pKAF131稳定期的有效运动的变化,本文在此运动的基础上研究了在连续5 d静置培养下处于稳定期的E.coliJY26/pKAF131的泳动性的变化,并且与另外2种野生型菌株E.coliJY26(ΔfliC)和E.coliJY26(ΔmotB)/pKAF131的泳动性[13]作比较,E.coli的运动性强意味着泳动性比较敏感。同时本文研究了在连续5 d静置培养下对处于稳定期的E.coliJY26/pKAF131形态的影响。这些生物物理学实验对深入了解E.coliJY26/pKAF131马达的运动机制及生物学功能的研究具有一定的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
E.coliJY26/pKAF131、E.coliJY26(ΔfliC)和E.coliJY26/pKAF131(ΔmotB)均由中国科技大学袁军华实验室提供。
1.1.2 实验试剂
Tryptone、Yeast、Sodium chloride、Agar powder(BD公司);磷酸氢二钾、磷酸二氢钾、无水乙醇、盐酸、甘油、过氧化氢(国药集团化学试剂有限公司);天冬氨酸(天津市东丽区天大化学试剂厂);M Grease(APIEZON);蛋氨酸、乳酸、乙二胺四乙酸(EDTA)、氯化钠、多聚赖氨酸、RIPA、三磷酸腺苷标准品、磷酸酶抑制剂(美国Sigma公司);氯霉素(GIBCO)。
1.1.3 实验仪器与设备
SW-CJ-1FD 超净工作台(上海智诚);Biophtometer plus分光光度计、Eppendorf Centrifuge 5430R离心机(Eppendorf); DSX-24L手提式高压蒸汽灭菌器(上海申安); JY 92-Ⅱ超声波破碎仪(新芝生物科技股份有限公司);TS-2摇床(Kylin-Bell);PHS-3C pH计(济南前程分析仪器有限公司);Hitech-Sciencetool Master-Q超纯水净化系统(上海和泰仪器有限公司); BSA1245高精密电子天平(Sartorius公司);HSX-150恒温培养箱(上海海向仪器设备厂);Ti2-E倒置显微镜(Nikon); ImageQuantLAS 400 mini 荧光成像系统(GE Healthcare)。
1.2 生长曲线的测定
准备24个50 mL的离心管,分成3组置于离心管架上。配2 L LB培养基,调节pH值到7.3左右,然后分装到50 mL离心管中,分别加入3个50 mL离心管盛有40 mL LB培养基,6个50 mL离心管分别盛有39、38、37 mL培养基,3个50 mL离心管盛有36 mL培养基。第1天首先将分装好灭过菌的LB培养基置于超净台中,从过夜培养细菌的试管中取出400 μL的菌液,加入到40 mL LB液体培养基中,摇匀以后放在离心管架上,然后放进37 ℃恒温箱里,每隔2 h测OD值,12 h内测6次OD值,最后一次测完立马离心,5 000 r/min、5 min、24 ℃下离心后倒入新的39 mL LB培养基中。过夜培养12 h后,第2天早上立马离心,5 000 r/min、5 min、24 ℃,然后每隔1 h测OD值,第2天大概需要稀释测OD值,取100 μL菌液加900 μL空培养基放进1.5 mL离心管内,震荡均匀后转入比色皿里测OD值,连续12 h中每隔1 h测1次,需要迅速测OD值,12 h后离心倒掉上清,加入38 mL LB液体培养基继续培养。第3天早上,经过培养12 h后再离心,5 000 r/min、5 min、24 ℃,然后加入新鲜38 mL LB培养基,开始每隔10 min测1次,取50 μL菌液加950 μL空培养基放进1.5 mL离心管内,震荡均匀后转入比色皿里去测OD值,等菌液浓度稳定以后每隔2 h测1次即可。12 h后离心倒掉上清,加入37 mL LB空培养基继续培养。第4天早上,经过培养12 h后再离心,5 000 r/min、5 min、24 ℃,然后加入新鲜37 mL LB培养基,开始每隔10 min测1次,取50 μL菌液加950 μl空培养基放进1.5 mL离心管内,震荡均匀后转入比色皿里去测OD值,等菌液浓度稳定以后每隔2 h测1次。12 h后离心倒掉上清,加入36 mL LB空培养基继续培养。第5天早上,经过培养12 h后再离心,5 000 r/min、5 min、24 ℃,然后加入新鲜36 mL LB培养基,开始每隔10 min测1次,取50 μL菌液加950 μL空培养基放进1.5 mL离心管内,震荡均匀后转入比色皿里测OD值,等菌液浓度稳定后每隔2 h测1次。
1.3 运动性实验
在连续5 d静置培养E.coliJY26/pKAF131的生长过程中,每天离心后,将新鲜的LB培养基倒入,并在8 h后进入稳定期。然后取出1 mL细菌溶液,并将该细菌溶液稀释其OD值为0.45~0.50。取1 mL MM溶液洗涤细菌,5 000g离心1 min,将上清液除去,加入1 mL MM溶液,然后重悬。用移液管取出1 mL 细菌溶液,用23号针头将其吸进注射器。然后用聚苯乙烯软管连接注射器,将这2个注射器来回挤压100次。使用小口径的针头切去长的细菌鞭毛,从而缩短鞭毛,并使乳胶球更容易粘在鞭毛上。接下来,需要将鞭毛细菌溶液离心至5 000g,离心1 min,除去上清液。最后吸取300 μL MM溶液移到1.5 mL离心管中,并将其与剩余细菌混合,以使细菌均匀地悬浮在300 μL MM溶液中。
用移液枪取出40 μL Sigma的聚赖氨酸溶液,将其缓慢且均匀地放在干燥的盖玻片上,持续3 min。将双面胶带切成2段等长,然后粘贴到载玻片上。双面胶带的2个部分之间的距离短于盖玻片的长度。用镊子夹住盖玻片的一个角,然后用纯净水清洗盖玻片。从盖玻片上除去多余的聚赖氨酸,自然干燥,然后将盖玻片粘到处理过的一侧。在此实验中,使用移液器将40 μL细菌悬液吸入切片通道,然后将准备好的切片倒置3 min。这样可以使盖玻片位于下方,而载玻片位于上方。让细菌与聚赖氨酸溶液充分接触,以便细菌可以粘在盖玻片上观察E.coliJY26/pKAF131的运动。3 min后,用移液管吸取100 μL MM溶液,并通过切片通道缓慢洗涤,以去除未粘在盖玻片上的E.coliJY26/pKAF131。缓慢加入40 μL乳胶颗粒,倒置3 min。然后用移液器吸取100 μL MM溶液,并通过切片通道缓慢洗涤,以洗去未粘附在E.coliJY26/pKAF131鞭毛上的乳胶小球。最后用APIEZON的M型油脂(润滑脂)密封型材通道的两端,以备实验。
使用CMOS相机(DCC3260M)40倍物镜并且以500帧/s的速度记录E.coliJY26/pKAF131鞭毛马达的运动。所有实验均在23 ℃下进行。
1.4 游动性实验
首先将配好的Swimming培养基平放在超净台上,然后在连续5 d静置培养大肠杆菌的生长过程中,每天早上离心后倒入新鲜的LB培养基等8 h左右到达稳定期,再取出1 mL菌液,稀释菌液使其OD值为 0.45~0.50。继续取出4 μL菌液滴在培养皿的中心位置,吹风1 h左右,直到菌液在培养基表面晾干为止。最后轻轻地放置在37 ℃恒温箱中孵育24 h,倒置培养,孵育24 h以后将培养皿轻轻地放在凝胶成像仪中拍照。
1.5 形态实验测定
用乙醇清洗 1 片长×宽为 76.2 mm×25.4 mm的载玻片,然后用纯水清洗1 片长×宽为18 mm×18 mm 的盖玻片,最后自然晾干,准备后续实验。使用移液枪吸取 40 μL的 Sigma 公司的多聚赖氨酸(polylysine)溶液,缓慢且均匀地涂布在已经晾干的盖玻片上,静置3 min。然后将双面胶截成2段一样长且等长于盖玻片粘于载玻片上,2段双面胶的间距要小于盖玻片的长度。用镊子夹住盖玻片的一角,再用纯水清洗盖玻片,去掉盖玻片上多余的多聚赖氨酸,自然晾干,经过处理的一面粘住载玻片,这样就形成了一个通道。在连续5 d静置培养大肠杆菌的生长过程中,每日早上离心后倒入新鲜的LB培养基,在8 h以后到达稳定期,然后取出1 mL菌液,测菌液的OD值为 0.45~0.50。将稀释好的菌液用移液枪吸取1 mL,加入1.5 mL离心管中,离心5 000g、1 min,去掉上清。然后取1 mL MM 溶液清洗一遍菌体,离心5 000g、1 min,去掉上清。用移液枪吸取300 μL的MM溶液加入1.5 mL离心管中与剩余菌体混合均匀,使细菌均匀悬浮于 300 μL的MM溶液中。
使用移液枪吸取40 μL 的细菌悬浮液慢慢地打入切片的通道中,接下来将做好的切片倒置处理3 min,即让盖玻片在下面,载玻片在上面。让细菌与多聚赖氨酸(polylysine)溶液充分接触,便于细菌沾到盖玻片上,以便观察大肠杆菌的形态。3 min后再将切片正置放好,吸取100 μL的MM溶液,将其缓慢通过切片通道进行清洗,目的是将没有粘到盖玻片上的细菌清洗掉。最后用 APIEZON 公司生产的 M 型油脂(Grease)将切片通道两端封住,完成了切片的制备。接下来立即将制备好的切片拿到显微镜下进行实验观察。
2 结果与分析
2.1 E.coliJY26/pKAF131的生长动力学分析
研究表明E.coliK12菌株能在连续静置的MH培养基中生长速度加快,为此测试E.coliJY26/pKAF131在LB培养基中的生长状况。本文使用一种名为JY26(ΔfliC)的野生型菌株,该菌株是E.coliK12菌株RP437的衍生物。本文将带有黏性细丝fliCst的质粒pKAF131转入到JY26中。E.coliJY26/pKAF131连续5 d的生长曲线如图1所示。

图1 E.coliJY26/pKAF131连续5 d的生长曲线
由图1可知,E.coliJY26/pKAF131的生长速度加快,到达稳定期的时间缩短。第1天连续培养E.coliJY26/pKAF131,8 h以后到达稳定期;第2天连续培养E.coliJY26/pKAF131,2 h到达稳定期;第3~5天连续培养E.coliJY26/pKAF131,1 h以内到达稳定期。结果表明:E.coliJY26/pKAF131在连续5 d的静置LB培养中,生长速度加快,到达稳定期的时间缩短。
2.2 E.coliJY26/pKAF131的运动性分析
在静置LB培养中,E.coliJY26/pKAF131的生长动态连续5 d发生变化,因为要了解这是否会影响E.coliJY26/pKAF131的运动性,所以本文选择连续5 dE.coliJY26/pKAF131生长的稳定期进行研究。本文首先对2种大肠杆菌(野生型大肠杆菌JY26和大肠杆菌JY26/pKAF131)的鞭毛马达的转速进行分析,E.coliJY26/pKAF131的鉴定结果如图 2 所示。因为野生型E.coliJY26(ΔfliC)无鞭毛基因,所以无鞭毛运动,作为对照组;E.coliJY26/pKAF131 是导入了表达鞭毛基因的质粒pKAF131,因此使细菌获得了运动能力和可以标记乳胶小球的能力。
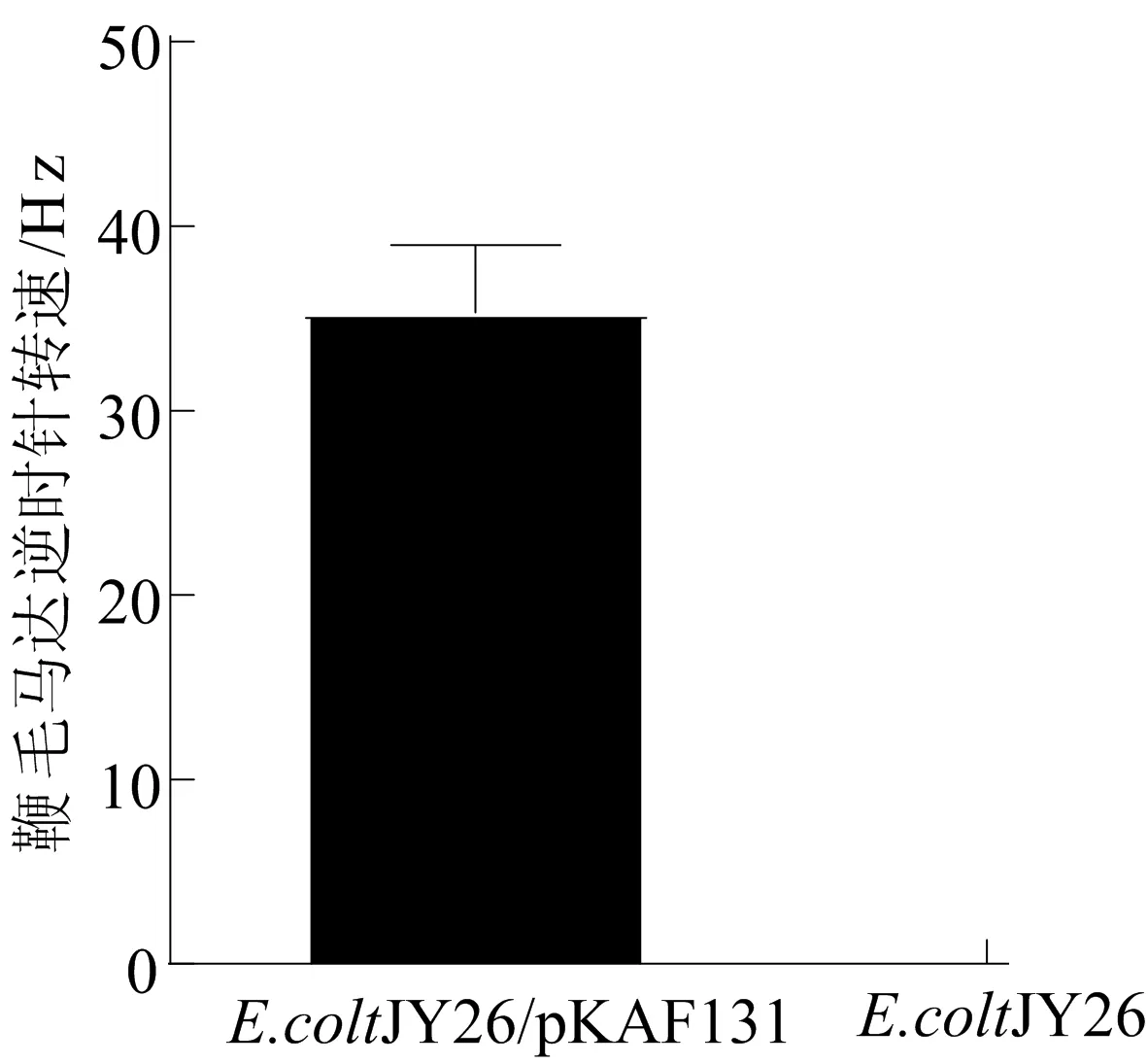
图2 E.coliJY26/pKAF131的鉴定结果
本文鞭毛马达的动力学分析需要利用乳胶小球粘附在E.coliJY26/pKAF131的鞭毛上,通过倒置显微镜Ti2-E观察E.coliJY26/pKAF131运动速度的变化。利用E.coliJY26/pKAF131鞭毛马达的顺时针速度和逆时针速度作运动指标,并用MATLAB分析鞭毛马达的转速。连续5 d培养E.coliJY26/pKAF131鞭毛马达的顺时针转速如图3所示。图3中:*表示P<0.05;***表示P<0.001,下同。从图3可以看出,连续静置培养E.coliJY26/pKAF131的顺时针转速分别为(39.59±4.503)Hz、(51.32±5.076)Hz、(53.05±3.687)Hz、(55.70±4.798)Hz、(69.59 ±4.298)Hz,连续5 d研究的有效细菌数为4、17、21、18、28。E.coliJY26/pKAF131的顺时针转速逐渐提高。
连续5 d培养E.coliJY26/pKAF131鞭毛马达的逆时针转速如图4所示,其中,* *表示P<0.01。从图4可以看出,连续5 d 的E.coliJY26/pKAF131的逆时针转速分别为(35.33±3.663)Hz、(50.44±4.846)Hz、(52.34±4.026)Hz、(54.57±5.236)Hz、(74.33±5.530)Hz,每天研究的有效细菌个数分别为21、19、22、21、30。与第1天相比,第2天的逆时针转速提高了30%;第3、4天与第2天相比没有显著性差异,但是转速有所提高。在第5天时,细菌鞭毛运动的逆时针转速达到约69.59 Hz,与第4天相比增加了约20%。结果表明:E.coliJY26/pKAF131在连续5 d的静置LB培养中,运动性增强,E.coliJY26/pKAF131的逆时针转速连续5 d上升,而顺时针转速表明运动环境的不利因素也在增加,这与E.coliJY26/pKAF131数量的增加是一致的,次生毒性代谢产物也在增加[12]。
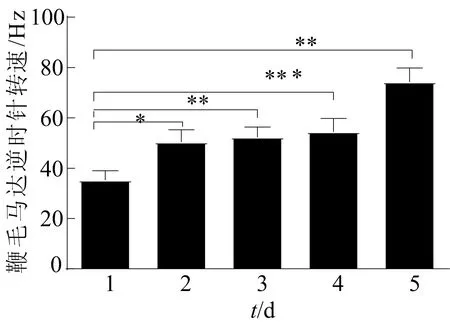
图4 E.coliJY26/pKAF131鞭毛马达的逆时针转速
2.3 MotB和FliC的运动影响分析
为了验证MotB和FliC在E.coliJY26/pKAF131运动中的重要性,本文将E.coliJY26(ΔfliC)、E.coliJY26(ΔmotB)/pKAF131和E.coliJY26/pKAF131进行连续5 d的静置LB培养,然后在泳动培养基上观察细菌游动的直径。3种E.coli菌株连续5 d的群体运动如图5所示。图5中:E.coliJY26为缺少鞭毛FliC基因的菌株;E.coliJY26(ΔmotB)/pKAF131为缺少运动蛋白基因的菌株;E.coliJY26/pKAF131为有运动基因并且有鞭毛的菌株;将培养第1天的菌液稳定期的细菌取出4 μL滴在泳动固体培养基上,37 ℃孵育24 h拍照;第2~5天以此类推。从图5可以看出,E.coliJY26/pKAF131游动的直径在连续培养5 d的静置培养中发生变化,随着培养天数的增加,E.coliJY26/pKAF131游动的直径增大。与对照组相比,当同时存在MotB和FliC时,E.coliJY26/pKAF131的运动性才会随着培养天数的增加而增强。
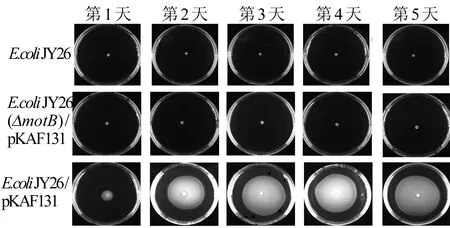
图5 3种E.coli菌株连续5 d的群体运动
2.4 E.coliJY26/pKAF131的形态学分析
有研究表明细菌的长宽比与细菌的迁移率有关。在连续5 d的静置培养中,E.coliJY26/pKAF131的生长速率加快,运动性增强。为了分析E.coliJY26/pKAF131的形态,本文将稳定期的E.coliJY26/pKAF131制成切片利用倒置显微镜随机拍摄,并借助MATLAB分析E.coliJY26/pKAF131的形态和大小。E.coliJY26/pKAF131的测量数据具有统计学意义。连续5 d培养E.coliJY26/pKAF131的菌体长宽比如图6所示。

图6 连续5 d培养E.coliJY26/pKAF131的菌体长宽比
从图6可以看出,E.coliJY26/pKAF131的长宽比保持在约2.5,没有显著性差异,但整体的趋势与细菌的运动性增强趋势相吻合。
3 结 论
已有的研究表明E.coli在连续静置培养中,生长速率加快,并且与E.coli运动相关的一些基因表达量升高。本文分析发现连续 5 d静置培养E.coliJY26/pKAF131,E.coliJY26/pKAF131的生长到达稳定期的时间缩短,生长速度加快。这些结果与先前的报道一致,表明连续静置培养对E.coliJY26/pKAF131的生长起着重要作用。除此以外,连续5 d静置培养E.coliJY26/pKAF131,E.coliJY26/pKAF131的运动性发生变化,并且随着培养天数的增加运动性增强,泳动性与E.coliJY26/pKAF131的运动有关,泳动性增大,说明E.coliJY26/pKAF131确实在连续5 d的静置培养中运动性增强。结果表明连续5 d静置培养可能参与调控E.coliJY26/pKAF131的生长和运动基因的表达,这一发现对更深入地了解肠道有关的细菌在体内的运动以及抗细菌药物的研发具有一定的指导作用。

