葡萄糖初始分布容积评估患儿围手术期容量状态的有效性
汲 玮 白 洁 黄 悦
为了维持良好的组织灌注和内环境稳定,避免细胞代谢紊乱和器官功能损伤,对儿科患者进行围手术期容量评估,并给予恰当的液体治疗至关重要。小儿细胞外液(extracellular fluid,ECF)容量占体重的比例相对高于成人,并随着年龄增长逐渐降低。小儿水转换率较成人高,对禁食、禁饮的耐受性差,体表面积与体重比值大易散失水分,且肾脏重吸收功能未发育完全。因此,小儿对体液丧失更敏感,可在较短时间内发生脱水。心率、血压、中心静脉压(central venous pressure,CVP)等监测指标对液体反应性差,不能准确反映小儿循环状态。动态前负荷指标如搏出量变异度(stroke volume variability,SVV)、动脉脉压变异度(pulse pressure variation,PPV)反映了左心室搏出量随通气产生的周期性变化,适用于成人患者。由于小儿胸壁、肺、动脉血管的顺应性高,降低了通气对血流的周期性影响,故动态前负荷指标评估小儿血管内容量状态缺乏准确性。经食道超声心动图检查评估小儿循环状态非常准确,但需要操作熟练的技术人员[1]。吲哚青绿(indocyanine green,ICG)稀释法是检测血浆容量的可行方法,但不常用于临床。1993年Ishihara等[2]介绍了葡萄糖初始分布容积(initial distribution volume of glucose,IDVG)评估血管内容量的方法。随后的研究[3]证实,IDVG能准确监测成人患者不同病理状态下的ECF量(过量或不足)。ECF量包括血管内容量、高灌注器官的组织液容量,因此即便在失血或者失液的早期,由于自主神经系统代偿及ECF重新分布,心输出量依然稳定的时候,IDVG仍可有效评估体液状态[4]。目前尚缺乏IDVG在儿科患者中的研究,其能否反映小儿ECF量尚不明确。本研究通过分析IDVG与ECF的相关性,旨在探讨IDVG预测择期行先天性心脏病手术的患儿的围手术期容量状态的有效性。
1 对象与方法
1.1 研究对象 收集2020年3—7月间在上海交通大学医学院附属上海儿童医学中心于全身麻醉下行手术纠治的30例先天性心脏病患儿的临床资料,年龄0~3岁,ASA分级Ⅱ或Ⅲ级。排除肝、肾功能不全,凝血功能障碍,以及基础血糖浓度>11.1 mmol/L的患儿。预试验中得到ECF量与近似IDVG(IDVG1)相关系数(r)为0.6,选取α=0.05,统计效力(power)=90%,采用双侧检验,计算得出共需要24例样本,考虑到可能发生样本脱落,纳入30例患儿,其中2例因ECF量测量失败而被排除,最终共有28例患儿纳入本研究。本研究符合2013年修订的《赫尔辛基宣言》。
1.2 麻醉方法 患儿术前均禁饮2 h、禁食6 h,入手术室后常规监测心电图、脉搏血氧饱和度、无创血压。开放外周静脉后,以4 mL/(kg·h)输注醋酸钠林格液。静脉注射咪达唑仑0.05~0.10 mg/kg、依托咪酯0.2~0.3 mg/kg、舒芬太尼2.0~2.5 μg/kg、罗库溴铵0.6~1.0 mg/kg麻醉诱导后行气管内插管。术中予患儿压力控制模式通气,维持呼气末二氧化碳分压为35~45 mmHg(1 mmHg=0.133 kPa)。桡动脉或股动脉穿刺置管连续监测动脉血压。颈内静脉穿刺置入双腔中心静脉导管,用于术中补液及输注葡萄糖。经外周静脉泵注丙泊酚4.0~6.0 mg/(kg·h)、舒芬太尼2.5 μg/(kg·h)和罗库溴铵0.6 mg/(kg·h)。在手术开始前30 min内及研究过程中,所有液体及麻醉药物输注速率保持不变。
1.3 IDVG监测 对于成人,根据50%葡萄糖(5 g)注射前与注射后3 min的血糖浓度差值计算其近似IDVG,计算公式为IDVG(mL/kg)=0.2×(24.4e-0.03x+2.7), 式中,x(mg/100 mL)为注射1 g葡萄糖3 min后增加的血浆葡萄糖浓度。将葡萄糖负荷量调整为1 g,根据上述相同的公式计算儿童的IDVG1。根据注射前、注射后3 min和5 min的血糖浓度计算修订的儿童近似IDVG(IDVG2),计算公式为IDVG2(mL/kg)=IDVG1-2.5×(静脉注射5 min的血浆葡萄糖浓度-静脉注射3 min的血浆葡萄糖浓度)+0.35。患儿血流动力学相对稳定后,取50%葡萄糖2 mL加入0.9%氯化钠溶液2 mL稀释至4 mL,于30 s内注入中心静脉。分别于注射前和注射后3、5 min,经桡动脉快速抽取血液样本,测定血糖浓度。每次采血和静脉注射葡萄糖后,以淡肝素盐水冲洗管道。
1.4 ECF监测 患儿平卧10 min后应用Inbody S10多频生物电阻抗分析仪(型号为Inbody S10,韩国Biospace有限公司)测量患儿的ECF量,并计算ECF量与体重的比值。测量前2 h内患儿未饮用各种液体,测量过程中未行输血及输液。测量频率为1、5、50、250、500、1 000 kHz,采用直接节段多频率生物电阻抗分析(BIA),测量部位包括双手拇指、中指和双足内、外踝后下方共4极8点。
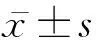
2 结 果
2.1 一般资料 28例患儿中,男19例、女9例;年龄范围1.3~2.3岁,年龄为(1.8±0.5)岁;身高范围85.1~88.7 cm,身高为(86.9±1.8) cm;体重范围9.90~13.60 kg,体重为(11.78±1.84) kg。其中室间隔缺损(VSD)10例,房间隔缺损(ASD)15例,房室间隔缺损(AVSD)3例。
2.2 IDVG与ECF、年龄相关性分析 根据公式计算得出IDVG1值为(143.6±10.5) mL/kg,IDVG2值为(154.6±9.4) mL/kg。ECF量与体重之比为(0.25±0.10) L/kg。Pearson相关性分析结果,IDVG1[相关系数(r1)=0.65,判定系数(R2)=0.42]、IDVG2(r2=0.66,R2=0.44)与ECF量均呈显著正相关性(P值均<0.01),见图1。IDVG1(r1=-0.39,R2=0.15)、IDVG2(r2=-0.43,R2=0.18)与年龄均呈弱负相关性(P值均<0.05),见图2。
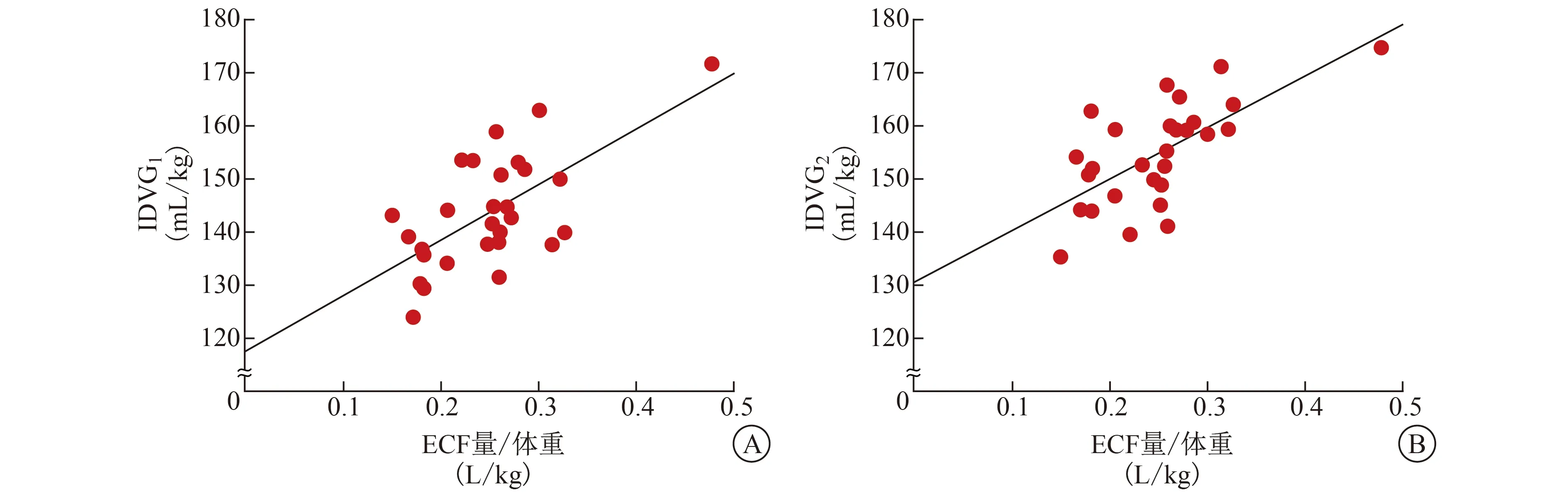
A IDVG1与ECF量的关系 B IDVG2与ECF量的关系图1 IDVG与患儿ECF量的关系
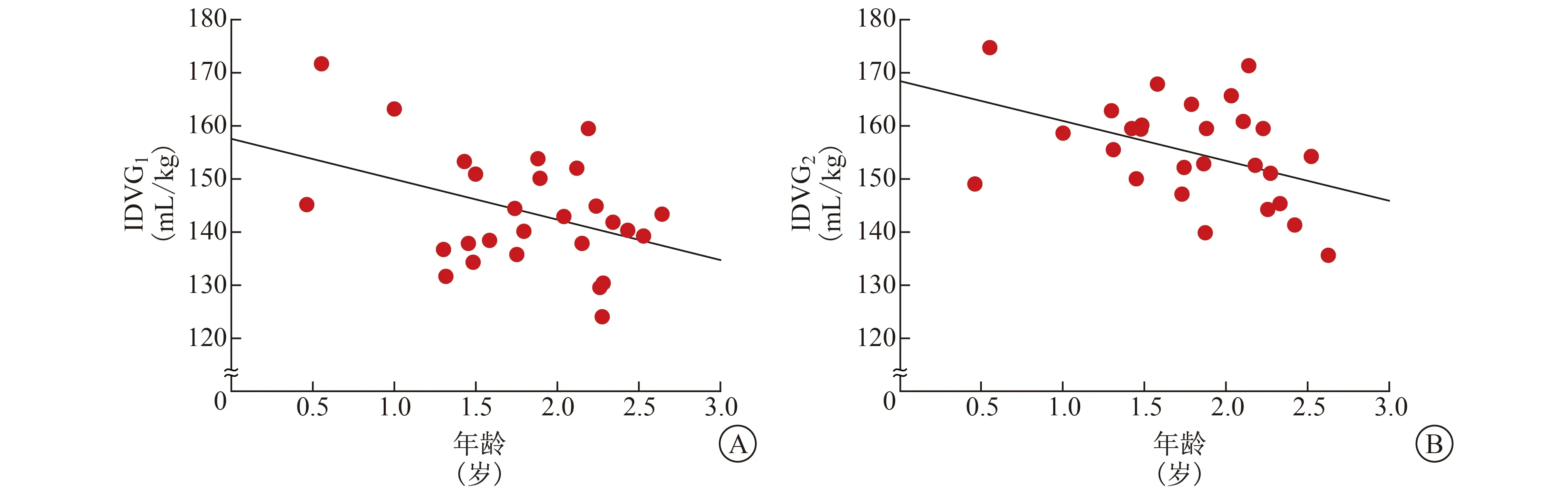
A IDVG1与年龄的关系 B IDVG2与年龄的关系图2 IDVG与患儿年龄的关系
3 讨 论
围手术期补液是小儿麻醉管理中的重要组成部分,正确的围手术期液体管理对维持心血管稳定和充分的组织灌注至关重要。为了减少围手术期并发症发生,麻醉科医师需要准确判断患儿的容量状态,优化术中液体治疗。由于小儿缺乏液体目标导向治疗的相关证据,评估其液体状态尚存在挑战性。
术中心率和血压的基本监测不足以反映心输出量、ECF量和血容量。针对具有容量波动高风险的患儿,推荐监测有创动脉压和CVP,然而准确的血管内容量较难测量,不能准确指导术中液体管理。PPV、SVV是评估成人血管内容量状态敏感且可靠的指标,但用于小儿则准确性欠佳。此外,一些监测方法如经食道超声心动图检查,存在价格昂贵、操作复杂等缺点,也不适用于小儿。
IDVG是指注射药物后,药物迅速分布在中央室,在未发生药物代谢或再分布前的容积。IDVG与机体循环灌注密切相关,机体低灌注状态下注射药物后的药物浓度偏高,机体高灌注状态下注射药物后的药物浓度偏低。IDVG与糖代谢的显著改变无关,故测量IDVG可以预测机体的循环灌注状况,是评估ECF量的一种有效工具[5]。既往研究[6-7]结果表明,与ICG稀释法相比,IDVG监测的血浆容量与心输出量有更显著的相关性。IDVG已成功用于预测成人患者术后低血容量的发生。多项研究[8-9]证实,IDVG可优化围手术期液体治疗,减少术后并发症的发生。BIA是一种评估小儿液体状态,优化围手术期液体管理的无创、简单、准确的方法[10]。在评估患儿脱水方面,BIA相比临床脱水量表,能提供更多的量化信息,是一种更敏感的评估工具[11]。本研究将BIA测得的ECF数据作为判断患者容量状态的标准,判断IDVG能否预测行机械通气患儿的容量状态。
有研究[12]结果显示,小儿与成人间葡萄糖负荷后血浆消失率(Ke-glucose)存在较大差异,故仅使用注射后3 min这1个样本来估算近似IDVG可能并不合适,需要增加1个测量点来提高准确率。本研究用注射葡萄糖5 min与注射葡萄糖3 min后增长的血浆葡萄糖浓度获得2个测量点的IDVG近似值,结果显示IDVG1、IDVG2与ECF量均呈显著的正相关性;上述结果表明,IDVG可作为一种反映小儿ECF容量状态的可靠指标。
婴幼儿体内液体分布的特点是单位体重的ECF量较高。足月新生儿ECF量约占体重的45%,在出生后1年内迅速下降,6~12个月时ECF量约占体重的27.4%,儿童期降低幅度较小,5~10岁时降至22.0%[13]。本研究结果显示,IDVG1、IDVG2与年龄均呈弱负相关性。推测其原因为IDVG反映ECF量的变化趋势,而单位体重的ECF量随年龄增长而降低,故小儿基于体重的IDVG大于成人,与生理变化相吻合。
本研究尚存在一定的局限性,临床上常以IDVG<100 mL/kg作为成人血容量不足的临界值,尚缺乏小儿的数据。在未来的研究中,将根据小儿ECF量的正常范围,估算不同年龄段小儿血容量不足时的IDVG临界值。此外,IDVG被证实可评估血容量的状态并预测低血容量性低血压的发生,但是重复测量IDVG需要至少30 min,指导实时液体治疗时存在不便。
综上所述,IDVG近似值与小儿ECF容量具有显著的相关性,IDVG1、IDVG2均可作为行先天性心脏病手术患儿围手术期容量状态的预测工具。

