患者药物吸入能力评估上海专家共识
上海市医学会呼吸病学专科分会呼吸治疗与肺功能学组
吸入给药已成为COPD[1-2]和支气管哮喘(简称哮喘)[3-4]的基本治疗方式。随着吸入制剂和吸入器的研发进展,吸入给药有着广泛的应用前景,可用于包括呼吸道与肺部感染[5-7]、肺间质性疾病、肺癌等多种呼吸系统疾病[8],以及糖尿病、抑郁症等其他系统疾病的治疗[8-10]。与口服和静脉输注等给药方式相比,吸入给药后药物直接作用于气道和肺部,具有起效快、疗效持续时间长、全身不良反应少的优点[11-12]。相较于雾化吸入,手持定量吸入器(简称吸入器)操作便捷、吸入时间短、药物外溢少,是良好的院外用药选择[7]。
目前,常用的吸入器包括压力定量气雾吸入器(pressurized metered-dose inhaler, pMDI)、粉雾吸入器(dry powder inhaler,DPI)、软雾吸入器(soft mist inhaler,SMI)3种,不同吸入器的作用特点和适用人群各不相同。除药物成分外,患者的吸气能力是选择合适吸入器的重要依据。患者吸气能力低于吸入器的要求可使药物递送和沉积不足,药物无法充分发挥疗效,进而导致疾病急性加重,增加住院、急诊就诊的次数,且与经济负担增高显著相关[13-14]。因此,准确评估患者的吸气能力并选择合适的吸入器尤为重要,但目前我国尚未有相关的规范化流程。上海市医学会呼吸病学专科分会呼吸治疗与肺功能学组组织专家梳理了常用吸入器的特点、患者吸气能力评测方法,以及相关临床证据,在此基础上提出吸气流速的评估流程,并采用德尔菲法形成推荐意见,以规范吸入器的合理使用。
1 吸入器使用中对患者吸入能力的要求和相关参数
1.1 吸入器使用中对吸气流速和吸入动作的要求 为了达到最佳肺内药物分布和沉积,患者在使用吸入器时需遵循一定的标准,包括吸入前、开始吸入和吸入后3个环节。患者在使用pMDI、DPI和SMI时,均需在吸入前缓慢地深呼气,即在开始吸入时尽可能地处于功能残气位以获得最大的吸气容积;在吸入后尽可能地屏气(以10 s左右为佳),再慢慢地呼气,从而使药物能充分地分布和沉积在肺部;但在开始吸入时,由于这3类吸入器输出药物微粒的原理及装置内部阻力不同,所要求的吸气流速和相应的吸入动作有所差异,见表1[11,15-21]。

表1 pMDI、DPI和SMI使用中对吸气流速和吸入动作的要求
装置内部阻力是指患者吸入药物时吸入器施加的额外阻力。DPI依赖装置内部阻力和患者主动吸气产生的湍流使药粉解聚成药物微粒,因此要求患者用力吸气以克服DPI的内部阻力并产生压力差,从而使药物能以微粒形式输出并随气流进入气道。研究[22]结果表明,快速、加速的吸入方式可增加DPI中药粉的解聚, 使药物颗粒的空气动力学直径减小,细颗粒比例增高,这需要患者在2~3 s内尽可能用力地深吸气以达到吸入器的最佳药物微粒输出。DPI装置内部阻力下的理想吸气流速为60 L/min左右。值得注意的是,吸气流速并非越快越好,过快的吸入流速(如>90 L/min)将增加药物在口咽部的沉积[23],从而导致声音嘶哑等不良反应发生。
与DPI不同,pMDI和SMI并不依赖患者主动吸气产生能量解聚药粉以输出药物微粒,因此使用吸入器时所需的吸气流速较低;且pMDI内部阻力很低,对患者吸气流速的影响小,患者轻轻地吸入即可达到所要求的流速,吸气流速过快反而会增加药物在口咽部沉积。因此,使用pMDI和SMI时患者需要缓慢且稳定地深吸气,儿童吸气时间为2~3 s,成人为4~5 s[11]。这样的吸气过程可以将吸气流速控制在使用pMDI的最佳范围,即30 L/min[17]。在开始吸气时,需要驱动pMDI和SMI以输出药物微粒,因此要求吸入动作与驱动动作相配合,即手口协调性;配合储雾罐使用pMDI可以降低对手口协调性的要求。
1.2 评估患者吸入能力的参数 评估吸气流速和吸入动作的参数包括吸入器内部阻力下的吸气峰流速(peak inspiratory flow against simulated resistance, PIFr)[13]、有效吸气时间(effective inspiratory time, EIT)、有效吸气容积(effective inspiratory volume, EIV)和吸气后屏气时间等。
1.2.1 PIFr PIFr是患者在用力吸气的过程中克服吸入器内部阻力所产生的最高流速,单位为L/min,是目前最常用的评估参数。
根据吸入器的内部阻力,可将其分为6个阻力级别,见表2[16]。内部阻力较低时,同样的吸气压力会产生更高的PIFr[15]。这意味着,如果药物解聚所需的压力差相同,高阻力DPI所需的最低PIFr和最佳PIFr低于低阻力DPI。随着DPI内部阻力和药物解聚所需要压力差的不同,使用时所需的最低和最佳PIFr也随之变化,见表3[15]。为了保证吸入器的药物输出率和外周肺沉积率,每种DPI装置都有其对应的最小PIFr和理想PIFr。达到理想PIFr是DPI中药物起到有效治疗作用的重要条件。例如,当PIFr由36 L/min加快至58 L/min时,使用都保○R[吸入糖皮质激素(ICS),理想PIFr为60 L/min]吸入的放射性标记布地奈德的肺沉积率明显增高[24]。使用都保○R[ICS/长效β受体激动剂(LABA)]吸入药物缓解哮喘发作时,PIFr<30 L/min时无法有效缓解支气管痉挛[25]。根据PIFr选择吸入器并进行吸入技巧培训是降低COPD患者急性加重的独立相关因素[26]。
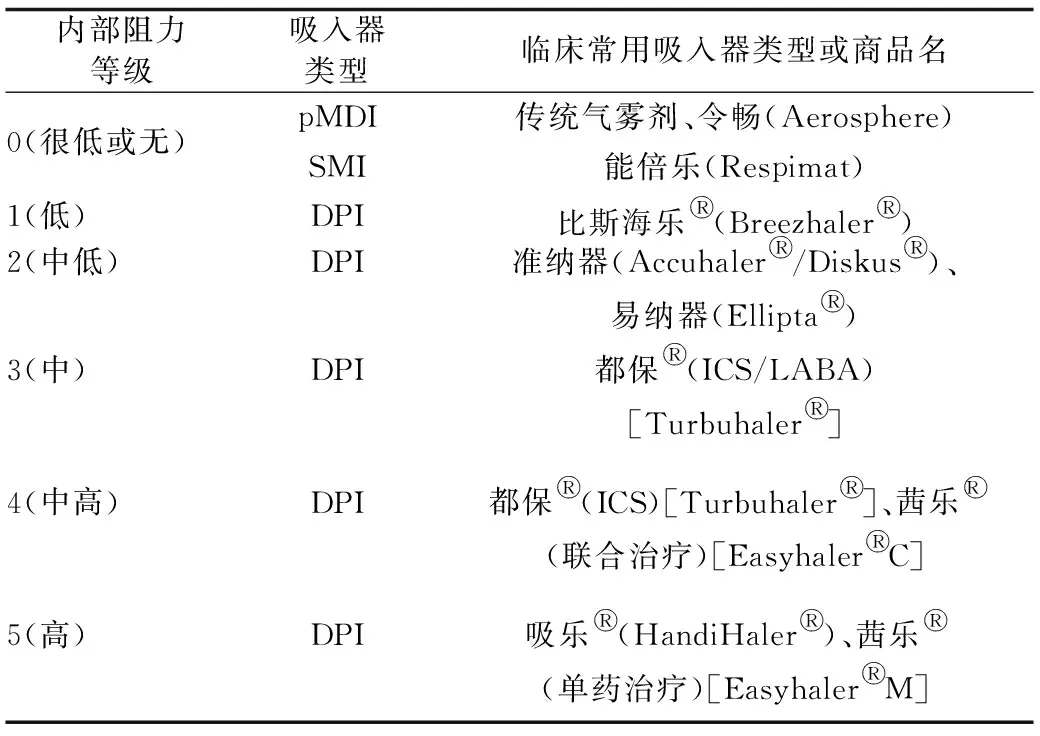
表2 基于吸入器内部阻力分级的吸入器类型及临床常用吸入器

表3 常用DPI所要求的PIFr最低值和最佳值 (L/min)
慢性气道疾病患者病情急性恶化期间(如COPD急性加重期、哮喘急性发作期),药物吸入能力下降,导致其无法有效使用稳定期所使用的DPI装置。多项研究[15,27-28]结果表明,COPD急性加重期可出现PIFr降低,住院患者的PIFr常≤60 L/min,且急性加重期患者接受吸入器使用培训仍无法提高其PIFr[28]。研究[27,29-30]结果亦表明,PIFr不足(≤60 L/min)的患者90 d内因COPD再入院率更高,全因再入院和因COPD再入院间隔时间更短,出院时的PIFr可以预测患者30和90 d内的全因再入院。可能与恢复期患者的吸入能力尚未恢复到稳定期状态,从而不能充分发挥DPI药物疗效有关。
1.2.2 最大吸气压(maximal inspiratory pressure, MIP) 最大吸气流速受限于吸气压力,后者由呼吸肌力量和肌张力所产生[31]。PIFr与患者用力吸气产生的气压差直接相关[32],MIP与PIFr呈正相关[33]。目前,MIP在慢性气道疾病临床用药指导和患者管理中的研究仍较缺乏。
1.2.3 EIT和EIV 患者使用吸入器时,吸气期间的吸气流速呈曲线形,吸气流速在达到PIFr前后有加速和减速的过程。使用DPI时,依赖吸气流速和压力差输出解聚后的药物微粒。因此,当吸气流速未达到吸入器的PIFr最低值时,则无法有效输出药物微粒;随着压力下降和流速降低,药物微粒不能随气流被递送到周围气道和肺部,此时药物微粒在肺部的分布和沉积依赖于扩散运动(即吸气后屏气时间)[31]。另一方面,如果吸气流速过高,则会导致药物颗粒撞击并停留在口咽部,也会使中央气道的药物沉积增多而外周气道的药物沉积减少[23]。EIT、EIV分别指吸气流速处于最低至最高PIFr间的时间和容积,其临床相关性还有待研究证实。
推荐意见1 给予吸入治疗时应根据患者的药物吸入能力选择吸入器,当出现急性加重等病情恶化时应评估患者是否仍有能力使用原吸入器。
2 药物吸入能力的评估
2.1 临床评估
2.1.1 年龄和性别 年龄和性别是PIFr的独立影响因素[34]。对健康人(包括吸烟者和非吸烟者)、COPD、哮喘和其他疾病患者的多项研究证实,年龄和性别与PIFr相关。PIFr随年龄增长而下降[33-38],女性的PIFr低于男性[34-35,37,39]。
2.1.2 呼吸肌力量 吸气压力取决于吸气肌力量[31-32]。呼吸肌受年龄和性别的影响。呼吸肌力量随年龄增长而下降, 男性呼吸肌力量高于女性[40]。
2.1.3 虚弱状态 虚弱状态是指多种疾病或功能障碍共同导致的一种整体状态,表现为多器官系统的生理功能下降和更易受到应激源影响。满足以下5条中的3条即可判断为虚弱状态:体重减轻、疲惫不堪、握力弱、步速慢、体力活动少。老年人、存在合并症、社会经济地位低、营养不良和久坐不动的生活方式者虚弱的发生风险更高[41-42]。虚弱的老年人的呼吸肌力量和MIP均低于虚弱前期和非虚弱的老年人[43-44],PIFr也随之下降。
2.1.4 慢性气道疾病 COPD[45]和哮喘[46-47]患者的PIFr往往低于健康人。由于气道平滑肌痉挛和黏液分泌过多,COPD和哮喘患者容易发生小气道阻塞,导致吸气流速与吸气容积下降。COPD患者由于肺弹性回缩力减低、肺过度充气,导致呼吸肌力量减弱[48],最终吸气流速下降[27,49-50]。国内一项研究[28]显示,门诊就诊的COPD患者中PIFr<30 L/min、30~60 L/min、>60 L/min的占比分别为12.9%、43.5%和43.5%;经过吸入器使用培训后,达到最佳PIFr的比例有所提高,但仍分别有2.4%和39.5%的患者达不到最低和最佳PIFr值。COPD和哮喘患者的PIFr与呼吸困难评分(mMRC)呈负相关,但相关性较弱(r=-0.200)[28]。
COPD或哮喘患者的气流受限严重度与PIFr的相关性较弱,仅能用于药物吸入能力评估的参考。研究[28,33,37,51]显示,COPD患者的PIFr与FEV1、呼气峰流速(peak expiratory flow,PEF)、FVC、FVC%预计值之间呈正相关,但相关性很弱(r为0.199~0.218);与深吸气量(IC)也呈正相关(r=0.284)。也有研究显示,PIFr与FVC、FEV1、FEV1%预计值之间无相关性[15,45],FEV1并不是影响PIFr的独立相关因素[34]。
2.2 检测评估 理想的吸气能力测定设备应便携、操作简单、测定指标全面、测定结果准确度高、可重复性好、价格适中。目前较为常用的评估和训练设备的特点见表4。

表4 常用的评估和训练设备及其特点
2.2.1 使用机械装置测定 In-Check DIALTM(英国Clement Clarke国际公司)是专用于测定不同等级吸入器阻力下的吸气峰流量的手持式吸气流量计,是目前研究和临床评估PIFr的主要测定工具[27,35,37-39,52]。测定范围为15~120 L/min,测定结果准确度为±10%或±10 L/min(以较大者为准)。In-Check DIALTM适用于医院内评估患者PIFr,价格适中,亦可供患者家用的辅助工具,帮助患者院外自主训练以达到吸入器使用要求的PIFr。研究[28]结果表明,In-Check DIALTM有助于开展吸入器训练,改善患者的PIFr。
2.2.2 使用流量传感器测定 该流量传感器型的肺功能仪,可以通过步进电机和不同大小的阻力孔径(与In-Check DIALTM一致)模拟不同等级阻力,结合流量传感器定量检测使用者吸气过程中的PIFr和流量波形。该设备的计算机程序预先设定有不同吸入器的最小吸气流速、最佳吸气流速、最大吸气流速,通过将各时间点吸气流速与预设值比较,除去吸气流速过高或过低的无效部分后获得EIT、EIV。吸气后屏气时间也是该设备的测定指标之一。该设备适用于医院内患者诊断和随访时患者吸气能力的评估。
2.2.3 其他测定仪器 20世纪末,研究者们开始尝试将便携式肺量计与中空或含有安慰剂的DPI相连接,以此测定患者在特定吸入器阻力下的PIFr[36,51,53-54]。这种测定方式需要手动连接多种吸入装置并频繁更换,操作繁琐,临床应用可行性较低。国外还有其他可以用于吸气流速测定的设备,如Vitalograph AIM Aerosol Inhalation Monitor (英国Vitalograph公司)是一种通过电池供电的吸气训练设备,可以模拟DPI或pMDI的阻力来评估患者的吸入速率、吸入时间和屏气时间。每次吸入后,设备将报告测量结果是否达到对应吸入剂的最佳标准。吸入曲线记录仪(inhalation profile recorder, IPR)[52]可以将吸气时的口腔压力对时间的曲线并转化为吸气流速对时间的曲线。
值得注意的是,常规肺功能仪的流动阻力极小,基本等同于患者在无阻力的情况下检测吸气流速,因此不适用于患者使用吸入器时的吸气能力评估。
推荐意见2 装置阻力下的吸气流速受基础疾病、年龄、性别、机体状态等多种因素影响,根据临床和检测结果综合评估有助于准确判断患者使用特定吸入器的能力。
3 PIFr测定的质量控制
PIFr测定的准确性和可靠性受环境、设备、患者等多方面的影响,准确测定有助于指导临床选择合适的吸入器。
评估药物吸入能力的主要目的在于选择合适吸入器或通过测定让患者掌握正确吸入动作,达到所需的理想吸气模式和流速,因此推荐采用吸入药物时要求的动作并按照以下流程检测PIFr:①患者静坐或直立,直视前方并保持头部垂直;②使嘴部紧贴吹嘴;③缓慢且尽可能完全地呼气;④快速(DPI)或缓慢(pMDI和SMI)地深吸气,尽可能保持吸气平稳,直到吸足气;⑤尽可能长时间地屏气后再缓慢地将肺内气体呼出。重复以上动作3次,取最大值判断是否达到吸入器的最低值和最佳值[31]。如第③步未完全呼气或第④步未快速用力深吸气,均可能导致低估PIFr,误导临床对于吸入器的选择。
同时,评估不同阻力的吸入器时,需要患者反复用力深吸气多次。随着吸气次数增多,患者的呼吸肌反复收缩,疲劳程度上升,测得的吸气流速可能会降低。推荐根据拟用的吸入器,从相应阻力级别开始评估,每次检测之间根据患者情况休息数分钟。
如使用肺功能仪进行检测,考虑到气体容积易受到环境温度、压力、湿度等因素的影响,在测量前应将测试环境校准为标准条件:正常体温37 ℃、标准大气压760 mmHg(1 mmHg=0.133 kPa)、饱和水蒸气状态(body temperature, pressure, water vapor saturated, BTPS)[55]。通常每日开机使用检测设备时需要进行BTPS校准,当室温变化较大时应再次校准。忽略测试环境校准会导致检测结果产生误差[56-57]。部分极端环境不仅会影响设备检测,也会对受试者造成影响。例如,高海拔条件会降低患者的吸气肌力量[58],进而影响其吸入能力。临床上应将此类因素纳入综合评估的范围之内,但具体方法还有待进一步探索。
推荐意见3 药物吸入能力的评估应按照标准化流程进行,以便为吸入器选择提供准确信息。
4 展 望
患者药物吸入能力已成为慢性气道疾病,特别是COPD患者综合评估的一部分。PIFr作为药物吸入能力的重要指标,日益受到重视,但国内关于PIFr的临床研究仍较少,相关研究亟待开展,主要包括:①正常人和不同疾病患者PIFr的参考值范围;②PIFr与气流受限、症状、急性加重风险、营养状况之间的相关性,PIFr能否预测患者发生病情急性加重,实验室检查、影像学检查或肺功能结果是否可以预测PIFr下降;③针对PIFr进行干预能否改善患者预后;④不同评估设备测定结果间的横向比较;⑤不同海拔、气压等环境条件下PIFr是否受到影响及其检测方法的校正;⑥药物吸入能力评估和训练用于辅助术后呼吸肌功能康复等的效果和可行性等。同时,EIT、EIV、吸气后屏气时间等需要更多的研究证实其在临床实践中的意义。深入理解药物吸入能力评估将有助于提升吸入治疗的效果,也将为开发更易用、有效的吸入器和药物提供依据。
执笔张静(复旦大学附属中山医院)
共识制订专家组(按姓氏汉语拼音排序)戴然然(上海交通大学医学院附属瑞金医院)、郭健(上海市肺科医院)、韩锋锋(上海交通大学医学院附属新华医院)、金先桥(复旦大学附属华山医院)、宋元林(复旦大学附属中山医院)、唐昊(海军军医大学第二附属医院)、王璍旻(上海交通大学医学院附属胸科医院)、杨冬(复旦大学附属中山医院)、叶晓芬(复旦大学附属中山医院)、余莉(同济大学附属同济医院)、张静(复旦大学附属中山医院)、张旻(上海交通大学医学院附属第一人民医院)、周敏(上海交通大学医学院附属瑞金医院)、周伊南(复旦大学附属华东医院)、朱惠莉(复旦大学附属华东医院)
秘书吴奕星(复旦大学附属中山医院)、李丽(复旦大学附属中山医院)

