糖基化联合磷酸化降低鲢鱼小清蛋白致敏性的机制
陈文美,周厚泽,邵艳红,刘 俊,*,涂宗财,2
(1.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
鱼类含有丰富的蛋白质和不饱和脂肪酸,是人类重要的食品原料,但鱼类会引起过敏反应,严重威胁人类的健康[1]。鱼类过敏是人体对鱼体中抗原物质产生的不良反应,是八大食物过敏原之一[2]。而鲢鱼是我国四大家鱼之一,具有重要的经济和食用价值,但鲢鱼及其鱼糜制品中主要过敏原小清蛋白(parvalbumin,PV)引起的过敏反应威胁着许多人的健康[3],如何消减鲢鱼PV的致敏性是食品安全领域急需解决的科学问题。
PV 是一种水溶性球状蛋白,分子质量约为11~14 kDa,广泛存在于低等脊椎动物的白色肉中,其在人体钙生理学中起到至关重要的作用。很多鱼类中存在2~5 种不同的PV亚型,它们均能与IgE结合,且PV聚合形成的二聚体或四聚体均有较强的IgE结合能力,在热处理或极端pH值条件下仍保持过敏[4]。PV的致敏性取决于它所包含的抗原表位,有AA34-37、AA78-80、AA90-94和AA94-109。破坏抗原表位是目前一种有效降低PV致敏性的脱敏技术,如:热处理、蛋白质修饰(糖基化、磷酸化等)、酶解和发酵法等方法被用来消减蛋白质的致敏性[5-8],其中,蛋白质修饰技术是一种比较有前景的方法,能够改善蛋白质的功能特性,同时也能有效降低其致敏性[9-10]。Zhao Yongjuan等[11]发现糖基化显著降低了PV的IgG结合能力;Li Zheng等[12]发现PV-麦芽糖的IgE结合能力在美拉德反应后被显著抑制;Li Canpeng等[13]利用磷酸化修饰也可以降低PV的致敏性。虽然单独的磷酸化或糖基化可以在一定程度上降低PV的致敏性,但它并不能有效地将致敏性降低到满意的程度。基于各种方法的优缺点,联合2 种或2 种以上方法降低PV过敏性具有较好的应用前景,而糖基化联合磷酸化修饰降低鲢鱼PV致敏性的研究鲜有报道。
因此,本实验以鲢鱼PV为研究对象,选用半乳糖和焦磷酸钠先后对其进行共价修饰,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electro-phoresis,SDS-PAGE)、圆二色谱和光谱等技术分析改性前后鲢鱼PV多级结构的变化;运用高分辨质谱技术对糖基化联合磷酸化修饰的鲢鱼PV进行修饰肽段和位点表征;同时采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)、嗜碱性粒细胞细胞系(KU812)模型评价糖基化联合磷酸化修饰的鲢鱼PV与IgG/IgE的结合能力以及对KU812细胞释放组胺(histamine,HIS)和白介素-6(interleukin-6,IL-6)的能力。
1 材料与方法
1.1 材料与试剂
鲢鱼购自江西省南昌市长胜市场,取背部白色肌肉立即实验或保存于-80 ℃。
焦磷酸钠、半乳糖 北京索莱宝科技有限公司;BeyoBlueTM考马斯亮蓝超快染色液 碧云天生物科技(上海)有限公司;人IL-6 ELISA试剂盒 北京四正柏生物科技有限公司;人HIS ELISA试剂盒 武汉伊莱瑞特生物科技股份有限公司;KU812细胞株 武汉普诺赛生命科技有限公司;淡水鱼过敏患者血清 南昌大学第一附属医院;鼠血清 实验室自制;山羊抗人IgE-辣根过氧化物酶 美国Sigma公司;山羊抗鼠IgG-辣根过氧化物酶 武汉三鹰生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FA1104N电子分析天平 上海丙林电子科技有限公司;HH-6数显恒温水浴锅 国华电器有限公司;Mini-Protean电泳仪 美国Bio-Rad公司;Synergy H1酶标仪 美国BioTek公司;SR160W二氧化碳培养箱 上海舍岩仪器有限公司;MOS 450圆二色谱仪 法国Bio-Logic公司;F-7000荧光光谱仪 日本Hitachi公司;Q-Exactive HF质谱仪、Acclaim PepMap 100纳流预柱(100 μm i.d.,2 cm,C18,5 μm,100 Å)和Acclaim PepMap RSLC纳流分析柱(C18,15 cm×2 μm,50 μm,100 Å) 美国赛默飞世尔科技公司;5430R冷冻离心机 德国艾本德公司。
1.3 方法
1.3.1 样品制备
参考前期报道的方法[3],取新鲜鲢鱼背部白色肌肉经煮沸和分级盐析后,借助高效液相结合尺寸排阻色谱对盐析后的PV进行分离纯化。基于PV的分子质量和色谱的分布情况,收集经尺寸排阻色谱分离后第II~IV峰溶液,并对该溶液进行超滤除盐、冻干,得到鲢鱼PV。将其溶于纯水中,调整其质量浓度为1.0 mg/mL。将20 mg半乳糖溶解在20 mL 1.0 mg/mL鲢鱼PV溶液中,冻干成粉末,然后在60 ℃、65%相对湿度下孵育2 h,冰上放置20 min终止反应。磷酸化反应条件与糖基化反应条件相同。反应结束后使用3 kDa超滤离心管除去未反应的糖和盐,-20 ℃保存备用。鲢鱼PV通过半乳糖修饰,未结合的半乳糖通过超滤去除,收集浓缩液,冻干成粉末,用纯水溶解后加与鲢鱼PV同质量的焦磷酸钠混匀后进行冻干,以冻干粉的形式进行磷酸化反应即为糖基化联合磷酸化反应,该复合反应与上述糖基化和磷酸化反应条件相同。未经处理的鲢鱼PV命名为N-PV。干热处理,不添加试剂,与糖基化联合磷酸化反应条件相同的样品命名为H-PV。通过糖基化、磷酸化和糖基化联合磷酸化修饰的样品分别命名为Gal-PV、SP-PV和Gal-SP-PV。
1.3.2 分子质量测定
参照Liu Jun等[14]方法使用SDS-PAGE分析样品的分子质量变化。样品质量浓度为1 mg/mL,上样量为10 μL,分子质量标记物为10~180 kDa。凝胶电泳结束,用考马斯亮蓝快速染色液进行染色,最后用水脱色,背景清晰透明。
1.3.3 游离氨基含量测定
使用邻苯二甲醛(o-phthalaldehyde,OPA)方法测定样品中的游离氨基含量,参照Wang Zhongjiang等[15]方法并适当修改。取100 μL样品溶液加入到2 mL OPA溶液中混匀,100 μL蒸馏水代替样品作为空白对照,在37 ℃避光反应2 min后,使用酶标仪在波长340 nm条件下测其吸光度。
1.3.4 二级结构的测定
参照Zhang Ming等[16]的方法进行测定。设定参数为:光谱扫描范围190~250 nm,扫描速率60 nm/min,狭缝宽度1 nm。
1.3.5 内源荧光的测定
根据Zhao Chengbin等[17]的方法并适当修改。将待测样品稀释至1 mg/mL,测定条件为:激发波长为290 nm,发射光谱为200~500 nm,狭缝宽度5 nm,扫描速率1200 nm/min。
1.3.6 高效液相色谱结合质谱鉴定修饰肽段和位点
采用Nano-LC-ESI-QOrbitrap-MS/MS对Gal-PV、SP-PV和Gal-SP-PV的修饰位点和肽段进行鉴定,并进行修改[18]。流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-乙腈溶液,采用逐步梯度洗脱的方法进行洗脱[18],流速为220 nL/min。采用正离子模式,一级母离子的质量扫描范围m/z250~1250。根据质谱信号强度选择前20 个肽段进行破碎,破碎模式为高能碰撞解离,能量为27%。母离子图谱用Xcalibur软件分析,对肽段序列分析用PEAKS软件完成。
1.3.7 IgG/IgE结合能力测定
参考Ma Jiaju等[19]方法并略作调整,通过间接ELISA测定的N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的IgE结合能力。一抗为4 名对淡水鱼过敏患者的血清组成,山羊抗人IgE-辣根过氧化物酶为二抗,稀释度均为1∶100。通过Zhang Min等[20]使用间接竞争ELISA测定鲢鱼PV样品的IgG结合能力,并于波长450 nm处测定吸光度,以半抑制浓度(half maximal inhibitory concentration,IC50)为指标。实验所需的一抗为实验室自制的小鼠抗鲢鱼PV血清组成,稀释度为1∶3200,山羊抗鼠IgG-辣根过氧化物酶为二抗,稀释度均为1∶2000。IgG结合力的抑制率按下式计算:
式中:B与B0分别为添加样品后的吸光度、未添加抗原的阳性对照吸光度。
1.3.8 人嗜碱性粒细胞(KU812)脱颗粒实验
KU812细胞采用RPMI-1640培养基,含10%胎牛血清和1×105U/L青霉素/链霉素,于37 ℃、5% CO2培养箱中进行培养。将含有2×106个KU812细胞接种于24 孔板中24 h,用10 μL鱼过敏患者的混合血清被动激活24 h,然后用50 μL/孔1 mg/mL样品刺激4 h。以磷酸盐缓冲液处理的细胞作为阴性对照。采用ELISA分析HIS和IL-6的释放情况,并按照生产商的说明进行分析。
1.4 数据统计分析
2 结果与分析
2.1 分子质量
将收集得到的蛋白上清液(第II~IV峰的溶液)通过SDS-PAGE测定后,发现其分子质量大于10 kDa,这与PV的理论分子质量较为一致,且未见其他明显蛋白条带。结果表明,经煮沸和分级盐析后的溶液经高效液相色谱结合尺寸排阻色谱纯化后,上清液中的蛋白溶液即为PV(N-PV),因此将其进行后续的实验。如图1所示,与N-PV相比,H-PV的蛋白质条带没有发生明显变化,而Gal-PV、SP-PV和Gal-SP-PV的条带发生向上迁移,尤其是Gal-SP-PV条带向上迁移最为明显。该结果表明鲢鱼PV与半乳糖和磷酸基团共价交联形成高分子质量物质,导致蛋白条带向上迁移。

图1 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的电泳图Fig.1 Eelectrophoretograms of N-PV,Gal-PV,SP-PV,Gal-SP-PV and H-PV
2.2 游离氨基含量
糖基化和磷酸化反应可发生在蛋白质特定的位点上,例如赖氨酸、丝氨酸、精氨酸和N-端的游离氨基等[21-22],使蛋白质的游离氨基含量降低,因此通过测定游离氨基的含量能够进一步确定鲢鱼PV是否发生糖基化和磷酸化反应。如图2所示,与N-PV相比,H-PV的游离氨基含量改变不显著,而SP-PV、Gal-PV和Gal-SP-PV的游离氨基含量显著降低(P<0.05)。结果表明,鲢鱼PV发生糖基化和磷酸化。此外,Gal-SP-PV的游离氨基含量最低,其次是Gal-PV和SP-PV,这是由于更多氨基酸被糖基化和磷酸化修饰。

图2 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的游离氨基含量Fig.2 Free amino contents of N-PV,Gal-PV,SP-PV,Gal-SP-PV and H-PV
2.3 二级结构
如表1所示,N-PV的二级结构中,α-螺旋相对含量为57.29%,β-折叠相对含量为7.78%,β-转角相对含量为12.48%,无规卷曲相对含量为22.46%。与N-PV相比,H-PV的α-螺旋和β-转角的相对含量比例较高,分别为60.45%和17.97%,而β-折叠和无规卷曲的比例较低。有研究表明α-螺旋含量的增加主要由β-折叠的降低引起[23]。结果表明,长时间加热会在一定程度上破坏鲢鱼PV的氢键网络,引起蛋白质多肽链的部分扩张。此外,在SP-PV、Gal-PV和Gal-SP-PV中,α-螺旋的比例呈不断下降趋势(P<0.05),而β-折叠和β-转角的相对含量比例呈现相反的趋势。该结果表明,糖基化联合磷酸化修饰的鲢鱼PV二级结构相对含量发生明显改变,主要表现为α-螺旋相对含量的降低和β-折叠相对含量的增加。蛋白质的二级结构靠氨基酸序列和分子内不同区域的相互作用而维持[24],而糖基化联合磷酸化会明显破坏这些相互作用,从而导致PV的二级结构发生变化。相似的结果也被Sun Yuanxia等[25]报道,卵清蛋白经美拉德反应后α-螺旋相对含量减少,β-折叠稍有增加;Rupa等[26]报卵清蛋白α-螺旋相对含量的减少会抑制其过敏反应。此外,有研究报道PV内部含有较多的α-螺旋[27],根据表1数据可发现其占据二级结构的57.29%,PV的过敏表位大概率分布在这些α-螺旋上,因此α-螺旋结构的破坏可能会在一定程度上降低PV与特异性抗体的亲和力,从而降低其致敏性。
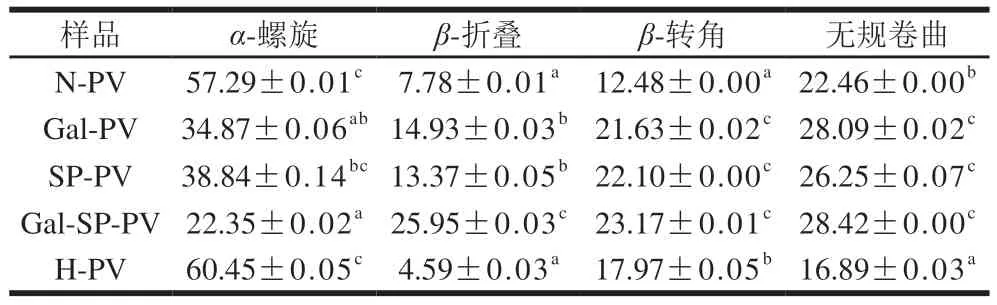
表1 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的二级结构相对含量变化Table 1 Changes in secondary structure contents of N-PV,Gal-PV,SP-PV,Gal-SP-PV and H-PV %
2.4 内源荧光强度
荧光强度的变化可用于分析N-PV、Gal-PV、SPPV、Gal-SP-PV和H-PV的构象变化。如图3所示,与N-PV相比,H-PV的荧光强度降低,而SP-PV、Gal-PV和Gal-SP-PV的荧光强度显著降低,降低程度为SP-PV<Gal-PV<Gal-SP-PV。荧光强度的降低可能是由于蛋白质与还原糖和磷酸基团的接入使PV的色氨酸区域被屏蔽[28],从而导致其产物的荧光强度降低。结果表明,PV经磷酸化、糖基化和糖基化联合磷酸化修饰后空间结构被破坏,破坏的程度为糖基化联合磷酸化>糖基化>磷酸化。当PV发生美拉德反应后,赖氨酸或精氨酸的氨基与还原糖发生反应,其二级结构或三级结构发生改变,从而影响了抗原表位的结合活性[29];刘俊等[30]也报道经糖基化、磷酸化和乙酰化修饰的α-乳白蛋白的三级结构和分子质量的变化与其致敏性有关。因此,PV三级结构的改变也是影响其免疫活性的重要原因。
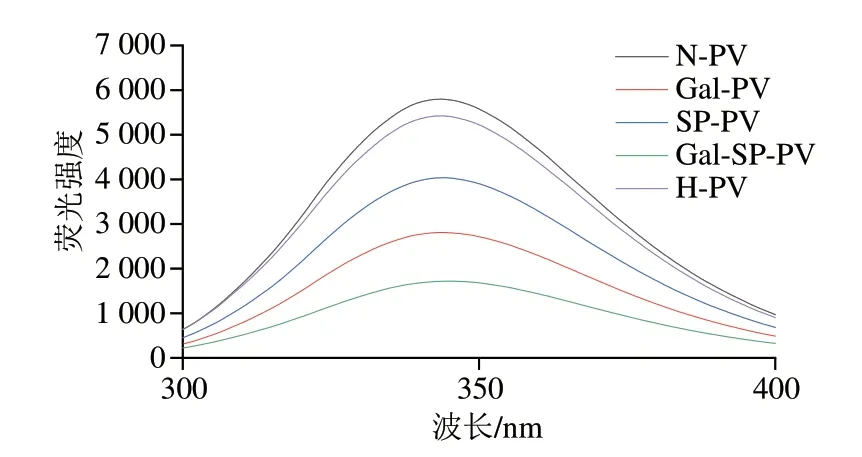
图3 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的荧光强度Fig.3 Fluorescence intensity of N-PV,Gal-PV,SP-PV,Gal-SP-PV and H-PV
2.5 糖基化和磷酸化修饰位点
为了更好地阐明糖基化联合磷酸化修饰对鲢鱼PV一级结构的影响,采用质谱对SP-PV、Gal-PV和Gal-SP-PV的修饰位点的数量和位置进行鉴定,结果如图4和表2所示。图4a、c显示77ALTDAETKAFLK88和29SFFAKVGLSAK39的m/z分别为735.39242+和658.85953+。通过b和y离子值之间差值(图4b、d),可以确定多肽77~88和29~39氨基酸序列中的修饰位点分别为K84和K33(表2)。类似地,通过相同的糖基化方法鉴定了SPPV、Gal-PV和Gal-SP-PV上的修饰位点。如表2可知,Gal-PV含有8 个修饰位点,分别为K33、K46、K55、K65、K84、K88、K97和K108。在SP-PV中发现了2 个磷酸化位点(S56和S92)。其中,Gal-SP-PV具有与Gal-PV相同的8 个糖基化位点外,还含有一个与SP-PV相同的磷酸化位点(S56)。结果表明,糖基化联合磷酸化修饰的鲢鱼PV含有最多的修饰位点。

图4 SP-PV、Gal-PV和Gal-SP-PV的修饰位点质谱测定Fig.4 Mass spectra showing modification sites of SP-PV,Gal-PV and Gal-SP-PV
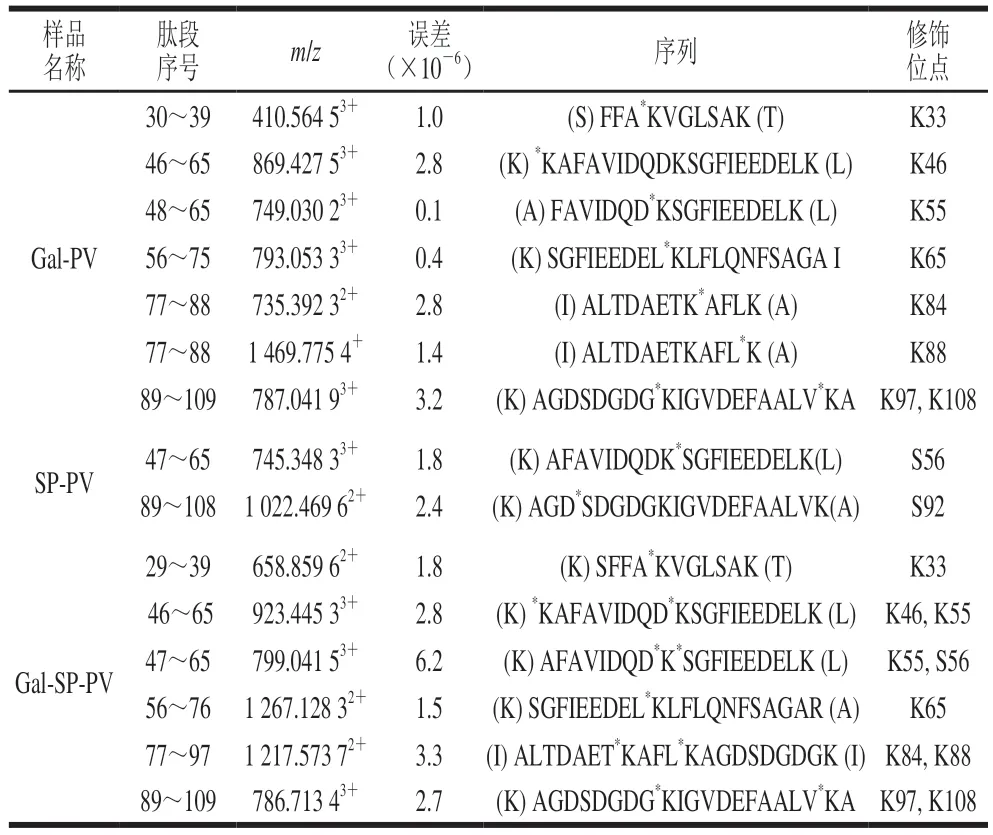
表2 高效液相色谱-质谱鉴定修饰肽段和位点Table 2 Modified peptides and sites identified by high performance liquid chromatography-mass spectrometry
2.6 IgG/IgE结合能力
图5a显示了鲢鱼PV的IgG结合能力。H-PV的IC50值为14.3 µg/mL,远低于N-PV(40.6 µg/mL),而SP-PV、Gal-PV和Gal-SP-PV的IC50值分别为43.8、55.6 µg/mL和76.9 µg/mL。图5b为鲢鱼PV的IgE结合能力,可观察到与IgG结合能力类似的趋势。同一样品与不同患者血清的IgE结合能力存在一定差异,但总体而言,H-PV的吸光度高于N-PV,而SP-PV、Gal-PV和Gal-SP-PV的吸光度低于N-PV。如图5b所示,鲢鱼PV的IgE结合能力在加热后显著增强(P<0.05),而经糖基化、磷酸化和糖基化联合磷酸化修饰后,IgE结合能力下降,下降趋势为SP-PV<Gal-PV<Gal-SP-PV。这些结果表明,糖基化联合磷酸化修饰能够降低鲢鱼PV的IgG/IgE结合能力。

图5 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的IgG(a)、IgE(b)结合能力Fig.5 IgG (a) and IgE (b) binding capacity of N-PV,Gal-PV,SP-PV,Gal-SP-PV and H-PV
2.7 KU812细胞
嗜碱性粒细胞的脱颗粒率是决定过敏原免疫反应性的关键因素。如图6所示,与对照组比,N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV的HIS和IL-6含量增加,说明鲢鱼PV的添加影响过敏症状相关介质的释放。与N-PV相比,Gal-PV、SP-PV、Gal-SP-PV的HIS和IL-6释放量低,其中Gal-SP-PV的释放量显著低于N-PV(P<0.05)。可能的原因是糖基化联合磷酸化修饰的鲢鱼PV诱导嗜碱性粒细胞脱颗粒的程度较弱,减弱了效应细胞分泌HIS等生物活性介质能力,而炎症性介质会在一定程度上引起以毛细血管扩张、平滑肌收缩等为特点的病理变化,从而诱发身体局部或全身过敏反应[31]。这与图5结果一致。结果表明,糖基化联合磷酸化修饰的鲢鱼PV降低KU812细胞HIS和IL-6分泌,降低其过敏反应。

图6 N-PV、Gal-PV、SP-PV、Gal-SP-PV和H-PV对KU812细胞释放HIS(a)和IL-6(b)能力的影响Fig.6 Effects of N-PV,Gal-PV,SP-PV,Gal-SP-PV和H-PV on release of HIS (a) and IL-6(b)from KU812 cells
2.8 糖基化联合磷酸化修饰降低PV致敏性的机制分析
PV是鲢鱼及其鱼糜制品中的主要过敏原,如何降低其致敏性具有重要的意义。通过各种物理和化学方法破坏过敏蛋白的抗原表位降低其致敏性是目前行之有效的脱敏技术[6]。本研究中选用半乳糖和焦磷酸钠先后对鲢鱼PV进行共价修饰,与单独Gal-PV和SP-PV相比,糖基化联合磷酸化修饰能显著降低其致敏性,如IgG和IgE结合能力的降低(图5)、KU812细胞中HIS和IL-6含量的减少(图6)。
蛋白质的抗原表位是引起其过敏反应的结构基础,过敏蛋白致敏性的降低与其抗原表位的破坏有关,而抗原表位分为线性表位和构象性表位,经不同物理和化学方法处理后,会引起线性表位或构象表位的变化。本研究中,与单独糖基化和磷酸化相比,半乳糖和磷酸基团先后与鲢鱼PV共价结合可以增加其分子质量(图1),显著降低游离氨基含量(图2),改变二级结构(表1)和构象结构(图3),这些结构的变化会破坏鲢鱼PV的构象过敏表位,从而降低其致敏性。如图7所示,糖基化联合磷酸化修饰的PV不仅含有与Gal-PV相同的8 个糖基化位点(K33、K46、K55、K65、K84、K88、K97和K108),还包含1 个与SP-PV相同的磷酸化位点S56。Zhao Yongjuan等[11]发现PV的抗原表位为AA34-37,AA78-80和AA88-93和AA94-109,而糖基化位点(K88、K97和K108)和磷酸化位点(S92)位于PV的线性表位区域,这些糖基化位点和磷酸化位点能遮掩PV的线性表位,降低其致敏性。虽然K33、K46、K55、K65和K84不在PV的抗原表位区域,但其与共价结合的糖链会形成一定的空间位阻,降低PV与IgG/IgE的结合能力。因此,PV致敏性的降低取决于糖基化位点联合磷酸化位点遮掩其线性表位和破坏其构象表位。

图7 糖基化和磷酸化修饰的PV带状图Fig.7 Ribbon diagram of glycated and phosphorylated PV
3 结论
综上所述,与单一的糖基化或磷酸化修饰相比,糖基化联合磷酸化修饰能够显著降低鲢鱼PV的致敏性。糖基化联合磷酸化修饰能增加鲢鱼PV的分子质量和糖基化修饰位点,而游离氨基含量和内源荧光吸收强度显著减少,这些结果表明糖基化联合磷酸化修饰能显著改变鲢鱼PV的抗原表位;同时糖基化联合磷酸化修饰降低了鲢鱼PV与IgE/IgG的结合能力以及对KU812细胞脱颗粒(HIS和IL-6)的释放能力。这说明糖基化联合磷酸化修饰通过破坏鲢鱼PV的抗原表位,降低IgG/IgE的结合能力和KU812细胞的过敏反应,但致敏性的评价并不全面,需要更多的实验(如动物和临床实验等)验证其效果。

