铂壳金核纳米酶介导的磁弛豫免疫传感器快速检测食源性沙门氏菌
董永贞,陈 瑞,吴紫荆,陈翊平,2,,*,潘 晖,刘明军
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.岭南现代农业科学与技术广东省实验室,广东 广州 510000;3.荆州市食品药品检验所,湖北 荆州 434000)
世界卫生组织在2003年将食品安全问题列为全球公共卫生十大威胁之一,其中由食源性致病菌引起的食源性疾病占全球食品安全事件总数的45%以上[1-2]。目前食源性致病菌主要包括沙门氏菌(Salmonella)、副溶血性弧菌、单核细胞性李斯特菌、空肠弯曲菌、大肠杆菌O157:H7、金黄色葡萄球菌、志贺氏菌等[3]。其中,沙门氏菌是一种革兰氏阴性杆菌,已发现的血清型多达两千余种,能够在食品基质中存活数月之久,常存在于鸡蛋鸡肉中,也能够在海产品、鲜牛奶、新鲜瓜果蔬菜等食物中存活,并且在进行生长繁殖过程中会分泌出内毒素,即使通过加热也只能杀死细菌并不能破坏细菌分泌出的毒素[4-6]。沙门氏菌引发的食品安全事件一直高居不下。据报道,每年全世界大约有30多万例沙门氏菌感染病例[7]。人体感染少量沙门氏菌即可引发恶心、呕吐、腹泻等症状,尤其对于老人、幼童、孕妇等免疫力低下者极易感染,可引起呼吸急促、发热、脑膜炎甚至死亡,具有传播媒介多、途径广、危害性大的特点[8-9]。因此,沙门氏菌的有效监控是防控食源性疾病的重要环节,对保障人体健康具有重要意义。
目前,沙门氏菌的检测方法主要分为3 类[10-11]:1)分离培养-生化鉴定法[12];2)免疫学分析方法[13],包括酶联免疫吸附法和胶体金免疫层析法等;3)分子生物学方法[14-16]等。但以上方法在一定程度上存在增菌时间长、干扰因素多、样品前处理复杂等问题,均难以满足在食品生产、加工、储运等环节中现场快速准确检测的需求。而生物传感器因其简便性好、分析速度快等优点在沙门氏菌检测中备受关注[17-19]。其中,磁弛豫(magnetic relaxation switching,MRS)免疫传感器是近年来发展迅速的生物传感分析方法之一,在复杂样品中的病原体检测方面发挥着越来越重要的作用[20-24],但传统的MRS免疫传感器是基于磁颗粒状态的改变,易受食品基质影响,引起非特异性聚集。Wang Zhilong等[25]在前期工作中开发了一种基于顺磁离子Mn价态转换的MRS生物传感器。在该传感器中,顺磁离子制备简单,在溶液中稳定性高,有效解决了磁颗粒非特异性聚集这一问题。但该工作中使用的信号放大元件为生物酶-碱性磷酸酶,生物酶的催化活性易受环境条件的影响,难以回收和循环利用,制备和纯化的成本高、稳定性较低(变性和失活)。随着纳米科学技术的发展,纳米酶的出现和研发为解决上述难题提供了有效途径。纳米酶易于制备且自身结构具有较高的稳定性,成本远低于天然酶,对环境变化的耐受性更强,并且易于功能化修饰[26-29],在食品安全检测领域具有良好的应用潜力。在众多纳米酶中,铂壳金核(Au@Pt)纳米酶因其高效的类过氧化物酶活性备受关注[30],可有效替代天然的辣根过氧化物酶(horseradish peroxidase,HRP)。
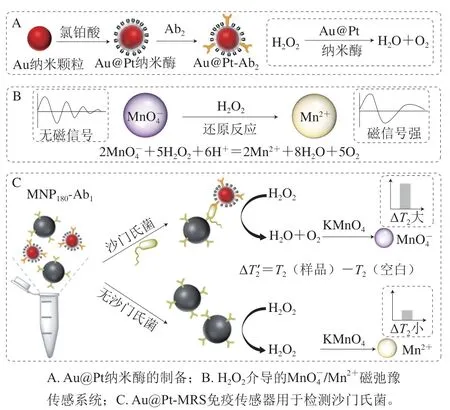
图1 Au@Pt-MRS免疫传感器检测沙门氏菌的原理图Fig.1 Schematic diagram of Au@Pt-MRS immunosensors for the detection of Salmonella
1 材料与方法
1.1 材料与试剂
实验用菌为肠炎沙门氏菌(Salmonella entericaATCC 14028)、单核细胞性李斯特菌(Listeria monocytogenesATCC 19114)、大肠杆菌(Escherichia coliATCC 25922)和金黄色葡萄球菌(Staphylococcus aureus,ATCC 29213)。所有菌株都用25%甘油保存于-80 ℃冰箱。
氯铂酸(H2PtCl6· 6 H2O)、氯金酸(HAuCl4·3H2O) 美国Sigma公司;聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、抗坏血酸、柠檬酸三钠、牛血清白蛋白(bovine serum albumin,BSA)、1-乙基-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 上海阿拉丁生化科技有限公司;羧基修饰的180 nm超顺磁纳米颗粒(MNP180,10 mg/mL) 上海奥润微纳新材料科技有限公司;沙门氏菌抗体(捕获抗体(Ab1)和检测抗体(Ab2)) 美国GeneTex公司;胰蛋白胨大豆肉汤(trypticase(tryptic) soy broth,TSB)、胰蛋白胨大豆琼脂(trypticase(tryptic) soy agar,TSA)青岛海博生物技术公司;四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)显色液(ELISA HRP显色用) 上海碧云天生物技术有限公司;细菌基因组DNA提取试剂盒 北京庄盟国际生物基因科技有限公司;用于实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)的引物序列:正向引物(5’-TCG CAC CGT CAA AGG AAC CGT AAA GC-3’),反向引物(5’-GCA TTA TCG ATC AGT ACC AGC CGT CT-3’),由生工生物工程(上海)股份有限公司合成;real-time PCR预混液 Takara生物技术有限公司。
1.2 仪器与设备
0.47 T低场核磁共振仪 苏州纽迈分析仪器股份有限公司;便携式磁分离架 美国Ocean NanoTech公司;Microfuge 16台式离心机 贝克曼库尔特国际贸易(上海)有限公司;MS104TS/02电子分析天平 梅特勒-托利多国际贸易(上海)有限公司;JEM-2100F透射电子显微镜 日本JEOL公司;MKX-X1G1A型微波炉合成仪 青岛迈可威微波创新科技有限公司。
1.3 方法
1.3.1 菌株活化和培养
将冻存的肠炎沙门氏菌在TSA培养基平板上划线37 ℃培养24 h。挑取单个典型菌落到TSB液体培养基中,37 ℃恒温振荡(180 r/min)培养24 h。取0.1 mL上述细菌的纯培养物梯度稀释液在37 ℃孵育24 h后,通过常规平板计数法确定细菌数,结果以CFU/mL表示。最终用磷酸盐缓冲液(phosphate buffer solution,PBS)进行稀释备用。
1.3.2 Au@Pt纳米酶的制备
将200 μL HAuCl4(48 mmol/L)和9.8 mL超纯水加入微波合成仪的反应釜中,在100 ℃微波加热下,保持沸腾1 min。然后开启磁力搅拌,一次性迅速加入1 mL的柠檬酸钠溶液(质量分数1%),在100 ℃保持4 min,随后冷却至室温,得到红色的Au纳米颗粒悬浮液。取200 μL的Au纳米颗粒与800 μL超纯水混合,加入50 μL的PVP(mw=10 kDa,质量分数20%),37 ℃旋涡振荡5 min。然后将40 μLL-抗坏血酸(100 mg/mL)和40 μL氯铂酸溶液(100 mmol/L),加入混合物,并立即在65 ℃孵育1 h直至溶液的颜色从红色变为棕色/黑色,表明铂沉积成功。将制备的Au@Pt纳米酶离心洗涤3 次,然后重悬于1 mL超纯水中备用。
1.3.3 MNP180-Ab1偶联物的制备
将2 mg MNP180用MEST(10 μmol/L MES,pH 6.0,0.05%吐温20)洗涤两次并重悬,然后加入80 μL EDC(5 mg/mL)和40 μL NHS(5 mg/mL),在37 ℃活化15 min。磁分离并用PBST(PBS加0.05%吐温20)重悬。在活化的MNP180中加入50 μg Ab1,混合均匀后在37 ℃缓慢振荡反应2 h。磁分离除去上清液后,加入500 μL含1% BSA的PBST溶液,封闭30 min。磁分离并清洗4 次后,将制备的MNP180-Ab1偶联物分散于含0.5% BSA的1 mL PBST中,保存于4 ℃备用。
1.3.4 Au@Pt-Ab2偶联物的制备
将Au@Pt纳米酶溶液的pH值用0.01 mol/L NaOH溶液调节至8~9,取1 mL Au@Pt纳米酶溶液加入20 μg Ab2,在4 ℃缓慢振荡反应5 h。然后,加入500 μL含1% BSA的PBST溶液,4 ℃孵育12 h。离心洗涤后,收集Au@Pt-Ab2偶联物,并将其分散于含0.5% BSA的1 mL PBST中,保存于4 ℃备用。
1.3.5 Au@Pt-MRS免疫传感器用于食源性沙门氏菌的快速检测
将100 µL MNP180-Ab1(0.05 mg/mL)与200 μL不同浓度的沙门氏菌液(50~5×107CFU/mL)混合均匀,在37 ℃涡旋反应20 min,磁分离除上清液。用PBST洗涤3 次并重悬,加入100 μL Au@Pt-Ab2,并在37 ℃涡旋20 min。磁分离,用PBST洗涤3 次,加入200 μL H2O2(4 mmol/L)反应10 min。磁分离,取100 μL反应液加入到100 μL KMnO4(2.5 mmol/L)和100 μL H2SO4(1 mmol/L)溶液中,常温反应5 min后,测混合液的横向弛豫时间(T2)值。
1.3.6 Au@Pt-MRS免疫传感器用于鸡蛋中沙门氏菌的定量分析
取10 g经GB 4789.4—2010《食品卫生微生物学检验 沙门氏菌检验》检测为沙门氏菌阴性的鸡蛋液样品,加入到89 mL无菌生理盐水(0.9% NaCl)中混合均匀。加入用生理盐水稀释的沙门氏菌1 mL,使其终浓度分别为102、104、106CFU/mL,最后用Au@Pt-MRS免疫传感器进行加标回收率测定。每个浓度平行测定3 次并求其相对标准偏差。
从市场上随即购买20 份鸡蛋样品,取10 g鸡蛋液加入到90 mL无菌生理盐水(0.9% NaCl)中混合均匀,在37 ℃预增菌4 h后,分别使用Au@Pt-MRS免疫传感器和real-time PCR方法进行分析。
通过细菌基因组DNA提取试剂盒获取目标菌DNA,采用荧光染料法进行real-time PCR实验。real-time PCR系统体系为25 μL,其中包含预混液12.5 μL,目标DNA模板1μL,双蒸水10.5 μL,0.5 μL正向引物(10 μmol/L)和0.5 μL反向引物(10 μmol/L)。扩增程序如下:1)95 ℃预变性5 min;2)35 个循环周期,包括95 ℃变性1 min;62 ℃退火1 min;72 ℃延伸1 min;3)72 ℃延伸8 min。
1.4 数据处理
数据采用Microsoft Excel、Origin软件进行分析处理。
2 结果与分析
2.1 Au@Pt纳米酶的表征
通过透射电子显微镜对所合成的Au纳米颗粒和Au@Pt纳米酶的形态进行观察,如图2A所示,Au纳米颗粒在水中分散均匀,表面光滑,粒径约为15 nm。在包裹上Pt壳之后,所得到的Au@Pt纳米酶依旧具有良好的分散性,粒径约为82 nm(图2B)。颗粒中间的黑色部分为所包裹的Au核,整个颗粒表面变得粗糙多孔,具有类海胆结构。该结构的形成显著增大了纳米颗粒的表面积,有利于纳米酶催化活性和催化效率的提高。本实验进一步测试了所合成的Au@Pt纳米酶对H2O2催化性能(图2C)。将系列不同浓度的Au@Pt纳米酶加入到含有固定含量H2O2的TMB显色液中,在室温下避光孵育5 min后,观察其颜色变化并通过酶标仪测定其在650 nm波长处的光密度(OD650nm)。随着Au@Pt纳米酶浓度的增加,反应液的OD650nm逐渐增大,证明Au@Pt具有高催化活性。同时,评价合成Au@Pt纳米酶的稳定性。将Au@Pt纳米酶(115 pmol/L)和HRP(10 ng/mL)在25 ℃分别贮存不同时间(0、3、6、9 d)。如图2D所示,Au@Pt纳米酶在25 ℃贮存6 d时,其酶活性无显著下降,贮存到9 d时,活性有轻微下降。而HRP在25 ℃贮存3 d后酶活性显著降低,且时间越长,酶活性越低。结果表明所合成的Au@Pt纳米酶具有良好的稳定性和酶催化活性。综上,本研究成功合成了具有核壳结构的Au@Pt纳米酶。
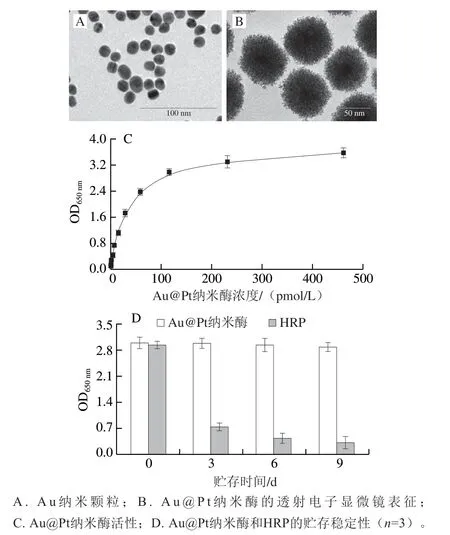
图2 Au@Pt纳米酶的表征Fig.2 Characterization of Au@Pt nanozyme
2.2 Au@Pt纳米酶调控的H2O2-/Mn2+信号转化和读出系统构建
首先验证了H2O2介导的/Mn2+信号读出体系的可行性。Mn2+具有5 个不成对电子,能与周围水分子之间发生空间偶极相互作用,具有较高的横向弛豫效率和较强的磁信号。而中的锰为+7价,无未成对轨道电子,基本无磁信号。因此,通过H2O2还原为Mn2+可引起溶液磁信号的增强。将梯度浓度的H2O2与0.5 mmol/L酸性KMnO4(pH 3)反应5 min,使用低场核磁共振仪对反应液的T2进行测定(n=3)。如图3A所示,随着H2O2浓度的增加,ΔT2(ΔT2=T2(H2O)-T2(样品))逐渐增大,说明随着H2O2浓度的增加,反应体系中有更多的转化为Mn2+,引起磁信号的增强。结果表明H2O2介导的/Mn2+信号读出体系可用于生物传感信号的读出。

图3 Au@Pt纳米酶调控的H2O2-/Mn2+传感系统验证Fig.3 Au@Pt-nanozyme regulated H2O2-mediated /Mn2+biosensing system
本实验进一步将Au@Pt纳米酶引入到H2O2-Mn2+信号读出系统中,将不同浓度的Au@Pt纳米酶加入到固定浓度的H2O2溶液中,离心后通过H2O2-/Mn2+信号读出系统进行测定。如图3B所示,随着Au@Pt纳米酶浓度的增加,ΔT2逐渐减小,说明在高浓度Au@Pt纳米酶条件下有更多的H2O2被分解,剩余H2O2变少,反应体系中有更少的转化为Mn2+,磁信号减弱。因此,Au@Pt纳米酶可与H2O2-/Mn2+信号读出系统结合,用于信号放大和转化。
2.3 Au@Pt-MRS免疫传感器的构建
将上述H2O2-/Mn2+信号转化和读出系统、Au@Pt纳米酶信号放大器和免疫分析技术相结合,开发一种新型的MRS免疫传感器,用于沙门氏菌的快速检测。在本传感器中,MNP180-Ab1能够通过免疫磁分离技术快速富集沙门氏菌,进而与Au@Pt-Ab2结合形成双抗夹心免疫复合物,使得Au@Pt纳米酶含量与沙门氏菌浓度呈正相关。沙门氏菌浓度越高,Au@Pt纳米酶含量越多,催化的H2O2越多,剩余H2O2越少,由转化的Mn2+则越少,由于Mn2+具有很强的磁信号(T2值小),而无磁信号(T2值大),Mn2+越少则引起T2值减小的程度越小,即T2样品越大,因此,ΔT2’越大(ΔT2’=T2(样品)-T2(空白)),最终实现沙门氏菌的定量分析。
首先对Au@Pt纳米酶的酶催化反应时间进行优化。如图4A所示,催化反应时间为10 min时,磁信号最强,而反应时间为5 min或15 min时,磁信号较弱,这是由于Au@Pt纳米酶对H2O2催化不完全或过度所导致。因此,本研究选择10 min作为酶催化反应时间用于后续实验。
基于上述实验结果,进一步对MRS传感器的灵敏度进行评估(n=3),其中以沙门氏菌的最小可检测浓度定义检出限。如图4B所示,在50~1×108CFU/mL范围内,值随沙门氏菌浓度增加而增大,且在1×102~5×107CFU/mL范围内呈现出良好的线性(图4C),线性方程为Y=70.97X-64.8,R2=0.995(X为沙门氏菌浓度(lg(CFU/mL)),Y为ΔT2/ms),检出限为50 CFU/mL。在Au@Pt-MRS免疫传感器中,Au@Pt纳米酶对H2O2的高效催化和H2O2对/Mn2+的瞬时转化体系有利于灵敏度的提高,Au@Pt纳米酶本身的无机材料特性和Mn离子溶液的高信噪比有利于稳定性的提高。
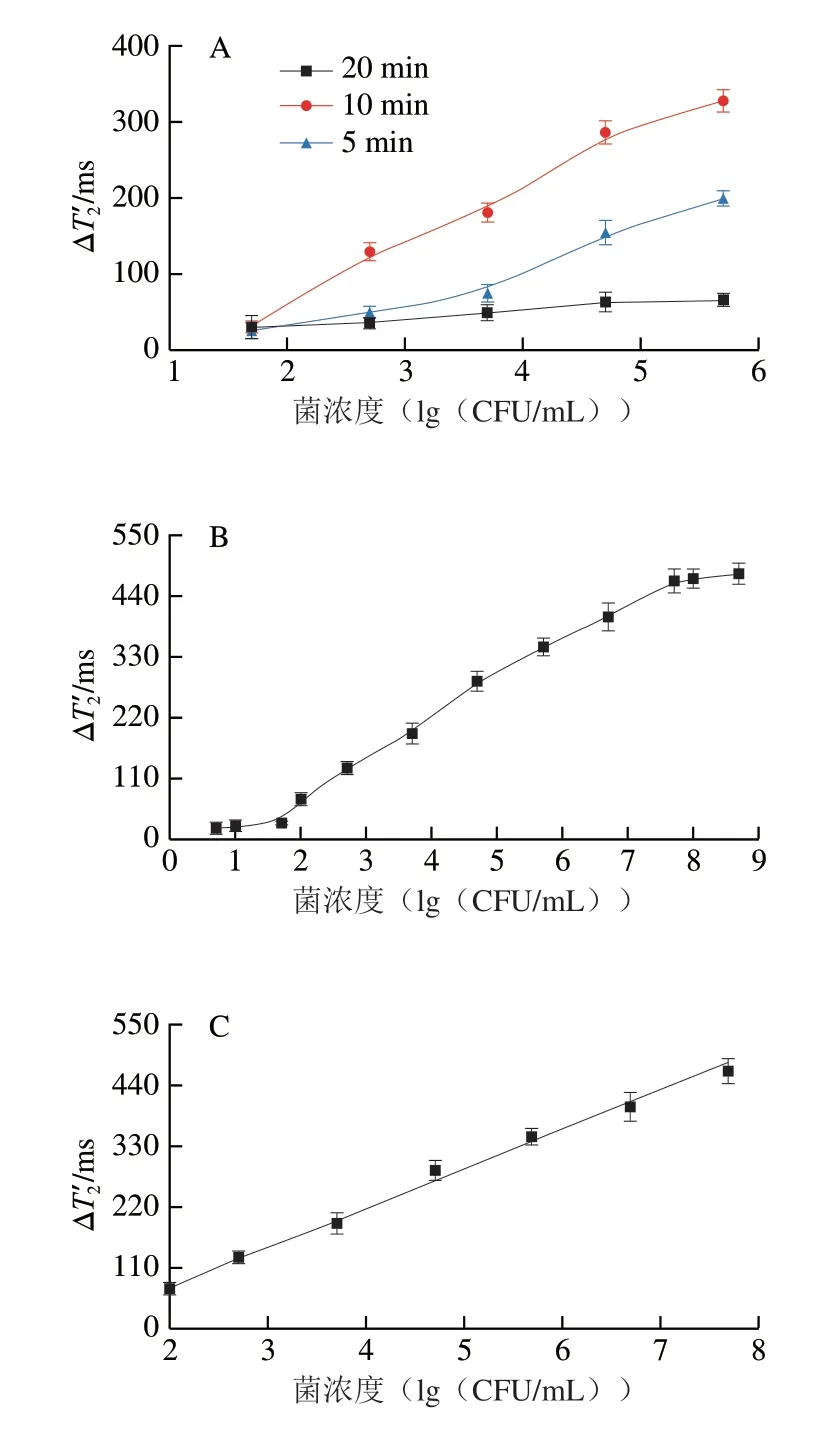
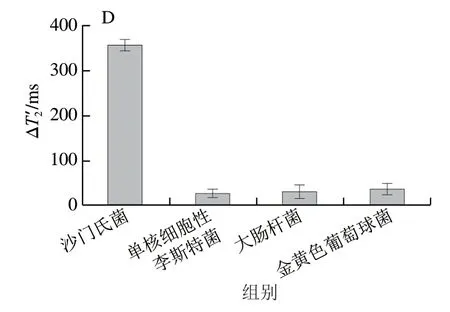
图4 Au@Pt-MRS免疫传感器检测沙门氏菌的催化时间优化(A)、标准曲线(B)、线性范围(C)和特异性(D)Fig.4 Optimization of enzymatic catalysis time (A),and standard curve (B),linear range (C) and specificity (D) of Au@Pt-MRS immunosensor for the detection of S.enterica
2.4 Au@Pt-MRS免疫传感器的特异性和准确性评价
选择单核细胞性李斯特菌、大肠杆菌、金黄色葡萄球菌3 种常见的食源性致病菌作为沙门氏菌的干扰物进行特异性实验。所有致病菌浓度均为5×105CFU/mL,其他反应条件保持一致。如图4D所示,在最优实验条件下,只有沙门氏菌能够引起磁信号的显著变化,其他致病菌对磁信号的影响可忽略不计,证明该传感器具有良好的特异性。
为测定Au@Pt-MRS免疫传感器的准确性,对Au@Pt-MRS免疫传感器检测鸡蛋样品中沙门氏菌的回收率进行研究,如表1所示,Au@Pt-MRS免疫传感器对鸡蛋样品中沙门氏菌的回收率为84.2%~102.0%,变异系数为6.57%~9.73%,证明本方法具有良好的准确性。

表1 Au@Pt-MRS免疫传感器检测鸡蛋样品中沙门氏菌的回收率(n=3)Table 1 Recoveries of Au@Pt-MRS immunosensor for S.enterica in egg samples (n=3)
2.5 Au@Pt-MRS免疫传感器检测鸡蛋样品中的沙门氏菌
基于上述研究结果,考察Au@Pt-MRS免疫传感器在实际样品中的检测能力。分别通过Au@Pt-MRS免疫传感器和real-time PCR方法对随机采购自当地市场的20 份鸡蛋样品进行测定。图5显示,样品3、4、8、11、13、14和18均呈现阳性,其他样品为阴性。两种方法检测结果一致,且相关性良好。与real-time PCR方法相比,本研究所开发的Au@Pt-MRS免疫传感器操作更为简便、检测效率更高、成本更低,在食源性致病菌的快速检测方向具有良好的应用潜力。
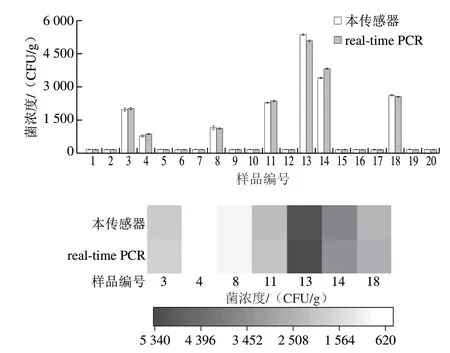
图5 Au@Pt-MRS免疫传感器检测鸡蛋样品中的沙门氏菌Fig.5 Results of Au@Pt-MRS immunosensor for S.enterica in egg samples
3 结论
构建了一种Au@Pt介导的MRS免疫传感器,并用于鸡蛋中沙门氏菌的快速检测。在该传感器中,Au@Pt纳米酶代替生物酶进行信号放大,有利于提高方法的灵敏度和稳定性。而H2O2介导的MnO4-/Mn2+信号读出系统的高效传导和高信噪比有利于方法检测效率和灵敏度的提升。所构建的Au@Pt-MRS免疫传感器具有灵敏度高、稳定性好、检测速度快等优点,在食品安全快速检测领域具有良好的应用前景。在后续工作中,将继续完善纳米酶的大规模制备技术及稳定、高效的抗体-纳米磁颗粒偶联方法,并在此基础上优化工艺流程,提高检测性能,为开发高效灵敏的食源性致病菌检测试剂盒及产业化奠定基础。

