等离子体协同白藜芦醇改性香蕉淀粉及其性质
孙 颖,郑丽丽,郑晓燕,杨 旸,校 导,艾斌凌,张正科,盛占武,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.中国热带农业科学院海口实验站,海南 海口 571101)
抗性淀粉(resistant starch,RS)指在健康个体小肠中120 min内无法消化的淀粉,具有类似于益生元和膳食纤维的生理作用[1]。当RS到达结肠时会被肠道微生物发酵,产生短链脂肪酸(short-chain fatty acid,SCFA),如乙酸、丙酸和丁酸,这些SCFA能够刺激肠道有益菌的生长,如双歧杆菌、乳杆菌[2]。香蕉是重要的热带经济作物,联合国粮食及农业组织将其列为第4大粮食作物,仅次于水稻、小麦和玉米[3]。淀粉是青香蕉的主要成分,而香蕉淀粉中的RS质量分数高达60%[4]。香蕉穗上一般有10%~15%的残次果[5],可以作为提取淀粉的原料,从而避免了次品蕉的浪费,对于开发新型保健食品和提高香蕉产业的经济效益具有重要意义。
然而,天然淀粉存在溶解度低、热稳定性差、抗回生性差等问题,限制了其在食品加工领域的应用[6]。介质阻挡放电(dielectric barrier discharge,DBD)等离子体作为一种环保、非热加工技术,可直接以空气为气源获得高密度的等离子体,对辅助设备的要求低,适合工业应用。DBD等离子体产生的离子、中性粒子、光子、电子等高能粒子,能够与淀粉发生物理或化学反应,如交联、解聚和刻蚀,从而改善淀粉的理化性质和加工性能[7-8],在淀粉改性方面具有很大潜力[6]。
白藜芦醇(反式-3,5,4’-三羟基芪)是一种天然多酚类物质,多存在于红酒、葡萄和西红柿皮中,具有保护神经、抗癌、抗氧化、消炎和抗病毒的作用[9-10]。然而,白藜芦醇的水溶性差、生物利用率低以及光、热稳定性差,使其在食品和医药领域中的应用受到限制[9]。研究表明,酚类物质可以通过非共价相互作用(如氢键、疏水相互作用和范德华力)与淀粉分子结合,并且与淀粉分子竞争α-淀粉酶和α-葡萄糖苷酶的活性位点,从而提高了淀粉的抗消化能力和热稳定性[11]。另外,淀粉由于具有无毒、无害、生物相容性好和生物利用率高的特点,可以作为酚类物质的输送基质,提高多酚在食品生产中和消化道内的稳定性和生物利用率[12]。
目前的研究多集中于单一的等离子体或多酚改性淀粉,对于等离子体协同多酚改性对香蕉淀粉性质的影响尚未阐明。Gao Shanshan等[13]提出DBD等离子体通过降解淀粉链,产生更多的线性片段,提高了淀粉与多酚复合的可能性。本研究通过DBD等离子体协同白藜芦醇改性香蕉淀粉,以期提高淀粉与白藜芦醇的复合率,改善淀粉的理化性质和加工性能,扩大淀粉在食品行业的应用范围。
1 材料与方法
1.1 材料与试剂
青香蕉(南天黄),果皮颜色指数为1(根据成熟度比色卡比色),由中国热带农业科学院试验基地提供。
香蕉成熟度比色卡 英国SH Pratt公司;白藜芦醇上海阿拉丁生化科技股份有限公司;唾液α-淀粉酶(35 U/mg)、胃蛋白酶(2500 U/mg)、胰酶(4000 U/mg)、淀粉葡萄糖苷酶(34 .6 U/ mg)、猪胆盐Sigma-Aldrich化学试剂公司;D-葡萄糖测定试剂盒(K-GLUK,GOPOD) 爱尔兰Megazyme国际公司;其他试剂均为分析纯。
1.2 仪器与设备
DBD-50型DBD等离子体反应系统(电源型号CTP-2000K) 南京苏曼等离子科技有限公司;HJ-6A数显恒温磁力搅拌器 江苏金怡仪器科技有限公司;D-37520高速离心机 美国Thermo公司;UV-1800紫外-可见分光光度计 日本岛津有限公司;AL204电子分析天平、FE28 pH计 梅特勒-托利多仪器有限公司;ST85B3-1冷冻干燥机 美国Milirock公司;扫描电子显微镜(scanning electron microscopy,SEM) 德国卡尔蔡司公司;D8 ADVANCE A25 X射线衍射(X-ray diffraction,XRD)仪、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国布鲁克公司;7000差示扫描量热仪(differential scanning calorimeter,DSC) 日本Hitachi公司;PCE-E3000恒温水浴振荡器 苏州威尔实验用品有限公司。
1.3 方法
1.3.1 香蕉淀粉的提取
参照Yan Siliang等[14]和毕玉[15]的方法。将青香蕉洗净、去皮,切成2 mm厚的薄片,立即放入于护色液(20 g/L柠檬酸+2 g/L抗坏血酸)中浸泡15 min。护色后的香蕉片与去离子水以质量比1∶1进行打浆2 min,过150 μm筛,筛下物以4000 r/min离心10 min,弃去上清液,然后以3 g/L NaOH溶液溶解沉淀30 min以除去不可溶性纤维,再次离心弃去上清液,然后以去离子水洗涤至上清液呈中性。将沉淀冷冻干燥后过150 μm筛,所得香蕉淀粉标记为NS,密封避光保存。
1.3.2 香蕉淀粉基本成分的测定
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》[16];蛋白质含量测定:参照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法[17];脂肪含量测定:参照GB 5009.6—2016《食品中脂肪的测定》[18];灰分含量测定:参照GB 5009.4—2016《食品中灰分的测定》[19]进行;总淀粉含量测定:参照GB5009.9—2016《粮油检验 玉米淀粉含量测定 近红外法》中的酶水解法[20]进行;直链淀粉含量测定:碘结合实验法[21]。
1.3.3 DBD等离子体改性
DBD等离子体装置由反应釜(DBD-100A协同DBD-50使用)、电源(GTP-2000K)和电压调节器组成,如图1所示。电极直径为50 mm,放电距离为8 mm。香蕉淀粉(干基)均匀分散在反应釜中,盖上上板,然后放入反应器中,以相对湿度40%的空气为气源,设置放电电流为2.0 A,放电电压分别为(20±1)、(30±1)、(40±1)、(50±1)V,即输入功率分别为40、60、80 W和100 W。放电处理3 min。得到的样品分别标记为P40S、P60S、P80S、P100S。

图1 DBD等离子体系统示意图Fig.1 Photograph of DBD plasma system
1.3.4 香蕉淀粉-白藜芦醇复合物的制备
参照GaoShanshan 等[13]的方法稍作修改。将1.0 g DBD等离子体改性/未改性香蕉淀粉与质量分数10%的白藜芦醇一起溶解在30%乙醇溶液中,悬浮液于70 ℃、500 r/min避光搅拌1 h,然后5000 r/min离心10 min,沉淀用30 mL 50%的乙醇溶液洗涤3 次,以去除游离白藜芦醇,将沉淀冷冻干燥并过150 μm筛,密封避光贮存备用。得到的复合物分别标记为Res-P40S、Res-P60S、Res-P80S、Res-P100S和Res-NS。
1.3.5 复合率的测定
参照Liu Hang等[22]的方法稍作修改。称取1.0 g 由1.3.4节获得的复合物于50 mL离心管中,加入20 mL去离子水,沸水浴加热 2 min,然后将分散体10000 r/min离心15 min,取300 μL上清液与5 mL去离子水和1 mL碘试剂(I2(0.2%)+KI(2.0%))充分混合,在690 nm波长处测定复合物的吸光度,以青香蕉淀粉与白藜芦醇复合物的吸光度作为参考,每个样品重复测定3 次,根据式(1)计算复合率:
式中:A对照为对照组的吸光度;A样品为待测样品的吸光度。
1.3.6 SEM分析
取少量样品固定于特殊的导电双面胶,用离子溅射仪进行喷金处理,应用SEM观察样品微观形貌,加速电压为15 kV。
1.3.7 XRD分析
将预先平衡水分的10 mg待测淀粉粉末样品平铺于样品池中制好样,放入XRD仪样品台中进行测试。XRD仪在40 kV和30 mA操作条件下运行,扫描速率为4°/min,步长0.02°,扫描角度(2θ)在5°~60°之间。
1.3.8 FTIR分析
将1.0 mg样品与100.0 mg KBr混合后压片,在4000~400 cm-1的扫描范围内,以4 cm-1的分辨率收集光谱。使用OMNIC进行去卷积处理,半峰宽为36 cm-1,增强因子为3.1,获得1047 cm-1和1022 cm-1处的峰高比值。
1.3.9 溶解性和膨胀力
参照Liu Hang等[22]的方法,在50~90 ℃范围内测定。称取0.5 g样品,加入25 mL去离子水,在水浴振荡器中以150 r/min孵育30 min,待悬浮液冷却至室温后,3000 r/min离心15 min,将上清液在105 ℃干燥至质量恒定。溶解度和膨胀力计算公式如下:
式中:W1为干燥上清液后淀粉的质量/g;W0为样品质量/g;W2为膨胀淀粉的质量/g。
1.3.10 持油能力
参照Wang Siyu等[23]的方法测定样品的持油能力。准确称取1.0 g样品放入已称量的离心管中,按1∶20质量比加入食用油,在30 ℃、200 r/min水浴振荡30 min,然后10000 r/min离心15 min,除去上清液称量。持油能力按下式计算:
式中:m1为样品质量/g;m2为离心后沉淀的质量/g。
1.3.11 冻融稳定性
将1.0 g样品和16 mL去离子水在沸水浴中加热30 min,置于50 mL预先称量的离心管中,于-20 ℃贮存24 h后于30 ℃解冻4 h,然后5000 r/min离心15 min,弃去上清液,冻融循环重复3 次。用析出的水量计算析水率。计算公式如下:
式中:W为析出水分的质量/g;M为样品的质量/g。
1.3.12 凝沉特性
参照闫斯亮[24]的方法并稍作修改。将样品配制成质量分数为1%的淀粉悬浊液,置于沸水浴中加热并不断搅拌15 min使其充分糊化。然后将淀粉糊倒入15 mL刻度试管中,加满至刻度线,每隔一定时间记录上清液体积,以析出的上清液体积占淀粉糊总体积的百分比表示样品的凝沉性。
1.3.13 DSC分析
将2~4 mg样品在铝坩埚中称量,加水使样品-水质量比为1∶2,密封在室温下平衡过夜,然后装入DSC池中。以10 ℃/min的速率从20 ℃加热至100 ℃,并用空坩埚作为空白。使用仪器软件计算起始糊化温度(To)、峰值糊化温度(Tp)和终止温度(Tc),糊化焓(ΔH)基于吸热峰的面积计算。
1.3.14 体外消化性
参照国际标准和相关研究[25-26]并稍作修改。采用模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)三步法评估样品的模拟GIT体外消化特性。
口腔相:将50 mg样品加入到预先加热到37 ℃的10 mL含有唾液α-淀粉酶(75 U/mL)的SSF中混匀,将混合物调节pH 6.8,然后在37 ℃水浴培养振荡器中100 r/min振荡2 min。
胃相:将预热至37 ℃的20 m L 含有胃蛋白酶(2000 U/mL)的SGF加入到口腔相得到的样品中,调节pH 3.0。然后,将混合物置于37 ℃水浴培养振荡器中100 r/min振荡2 h。
小肠相:取20 mL由胃相产生的样品并调节pH 7.0,加入10 mL SIF,5.0 mL溶于SIF的胰酶(800 U/mL)和淀粉葡萄糖苷酶(15 U/mL),3.5 mL猪胆盐(53.57 mg/mL),调节pH 7.0。将混合物置于37 ℃的水浴培养振荡器中100 r/min振荡150 min以模拟肠道环境。
在口腔相消化2 min(S2),胃相消化20 min和120 min(G20和G120),以及在小肠中消化10、20、60、90、120、150 min(I10~I150)后,取样0.5 mL,以测定样品的水解度。利用D-葡萄糖测定试剂盒测定样品消化过程中产生的葡萄糖浓度。淀粉水解率计算公式如下:
式中:Gh为水解产生的葡萄糖量/mg;Si为淀粉量/mg;0.9为从葡萄糖转化成葡萄糖酐(淀粉组成单元)摩尔质量比转化因子。
根据Goñi等[27]的研究,模拟小肠消化过程中淀粉水解的动力学计算如下:
式中:Ct为t时间(min)淀粉的水解率/%;C∞为淀粉的最终水解率/%;K为消化速率/min-1,通过转换方程式的斜率对数测定:
样品中快速消化淀粉(rapid digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和RS的百分比计算如下:
式中:G120和G20分别为20 min和120 min内水解的葡萄糖含量/mg;F为游离糖含量/mg;T为淀粉的总质量/mg。
1.4 统计分析
实验数据用Origin 2021软件绘图,用SPSS 23.0软件ANOVA检验法进行显著性分析(P<0.05),结果以表示。
2 结果与分析
2.1 香蕉淀粉的基本成分
如表1所示,总淀粉含量占87.32%,与当地大种高把(85.51%)和西贡蕉(91.96%)中淀粉的纯度相当[15,24]。

表1 香蕉淀粉的基本成分含量(n=3)Table 1 Basic chemical components of banana starch (n=3)
2.2 复合率的测定结果
如表2所示,DBD等离子体改性提高了香蕉淀粉与白藜芦醇的复合率,并且随着处理功率的增加,复合率呈先上升后下降的趋势。这是因为等离子体处理导致香蕉淀粉链解聚,分子质量降低,从而形成了更多短而小的线性片段,提高了与多酚结合的可能性[13];随着处理功率的增加,淀粉链发生聚合或交联,使得中、高分子质量淀粉链的比例增加[28],与多酚的接触面积减小,导致复合率下降。由于不同功率的DBD等离子体处理对复合率的影响显著(P<0.05),因此选用60 W的处理功率。
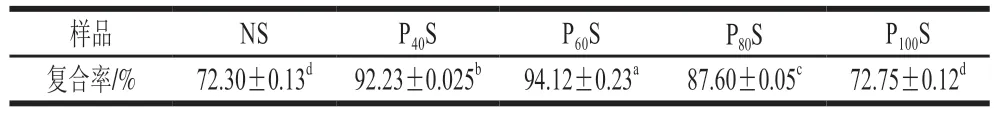
表2 不同功率DBD等离子体改性/未改性香蕉淀粉与白藜芦醇的复合率Table 2 Complexation rates between resveratrol and modified/unmodified banana starch with different plasma powers
2.3 微观形态
白藜芦醇和淀粉样品的颗粒形态如图2所示。NS基本呈椭圆形(图2B),在NS表面观察到了一些凹陷,这些凹陷可能与淀粉在分离纯化过程中护色液和NaOH的腐蚀以及粉碎过程中的机械力作用有关(图2b)[7]。DBD等离子体处理后,颗粒形态基本不变,视野中的淀粉分子增多(图2C),说明DBD等离子体能够使淀粉链发生降解,产生了更多的淀粉碎片[29]。从图2c可以看出,淀粉颗粒表面的凹陷程度加深,并且出现了一些裂纹或孔洞,这些非穿透性的损伤是由DBD等离子体刻蚀造成的。图2D、E显示,与白藜芦醇复合后,淀粉能够保持原有的颗粒形态,但颗粒表面变得粗糙,出现一些褶皱(图2d、e),这是由于水热处理对淀粉表面造成了一定的破坏;有白色物质附着说明白藜芦醇结合在了淀粉表面。

图2 白藜芦醇和不同香蕉淀粉样品的SEM图Fig.2 SEM pictures of resveratrol and different banana starch samples
2.4 XRD图谱
从图3可以看出,淀粉样品均在2θ为15°、17°和23°附近有主衍射峰,表现为CA型XRD图谱,即与A型结构相似的C型图谱[14]。这表明DBD等离子体处理及与白藜芦醇复合并没有改变香蕉淀粉的结晶形态,与之前的报道一致[12-13,30]。此外,在2θ为7°、13°和20°[31]处没有出现衍射峰表明白藜芦醇与香蕉淀粉没有形成“V”型包合物,说明白藜芦醇不占据香蕉淀粉的螺旋空腔。形成“V”型包合物的主要驱动力是疏水相互作用,而酚类物质的疏水性不足或尺寸过大都不能形成“V”型包合物。白藜芦醇的分子质量较低,不存在尺寸过大不能进入螺旋空腔的问题,因此这是白藜芦醇的疏水性不足导致[32]。DBD等离子体处理后结晶度升高,这是因为DBD等离子体产生了自由基和活性氧物质,如氧自由基、羟自由基、O、O3、、N+和,淀粉被这些高能粒子所修饰,从而导致淀粉分子链之间发生交联现象,一些小碎片分子重组成更多的结晶域[30,33];还有可能是淀粉无定形区域在一定温度下通过缩合和醚键形成的脱羟基可能导致淀粉分子以更有序的形式重新排列,更接近结晶区,从而导致相对结晶度的增加[34]。在等离子体处理的青香蕉淀粉、藜麦淀粉、苦荞麦淀粉、高粱淀粉和小麦淀粉中也观察到了类似结果[13,30,34]。白藜芦醇可以与淀粉直链或支链上的α-D-葡萄糖的氢基团结合,即通过2~3 个弱CH-π键将芳香残基堆积在淀粉吡喃糖环上从而与淀粉结合,并且一个多酚分子能同时与多个淀粉分子相互作用,起到“桥梁”作用,使无定形淀粉分子的有序度增加,半结晶区的堆积更加紧密,因此,结晶度升高[12,35]。

图3 白藜芦醇和4 种样品的XRD图谱和相对结晶度Fig.3 XRD patterns and relative crystallinity of resveratrol and normal and modified starch
2.5 FTIR 和傅里叶变换衰减全反射红外光谱(attenuated total internal reflectance-FTIR,ATR-FTIR)分析
淀粉样品在3000~4000、2925 cm-1和1654 cm-1处有3 个红外吸收峰,分别对应于O—H、C—H和—CH2的伸缩振动[31]。从图4a可以看出,所有样品的FTIR光谱(4000~400 cm-1)均有相似的条带,说明等离子体处理及与多酚复合没有改变淀粉分子的化学基团,因此白藜芦醇与香蕉淀粉之间主要通过非共价相互作用结合。之前研究也观察到了相同结果[11,14,36-38]。1200~900 cm-1是淀粉的指纹结构区,1047 cm-1附近的峰反映了淀粉结晶区的结构特征,对应于淀粉的有序结构;1022 cm-1附近的峰反映了淀粉无定形区的结构特征,对应于淀粉的无序线团结构,比值R1047/1022反映了淀粉颗粒表面的短程有序程度[31,39]。对1200~900 cm-1波段的光谱进行去卷积化处理,结果如图4b和表3所示。可以观察到,经等离子体处理后,R1047/1022值有所增加,即香蕉淀粉颗粒表面的短程有序性增加,表明形成了更多的有序结构域;而与白藜芦醇复合后R1047/1022值的增加可能是因为白藜芦醇通过非共价键与淀粉分子结合,起到了交联或增塑的作用,增强了分子的有序性[12],这与XRD的结果一致。
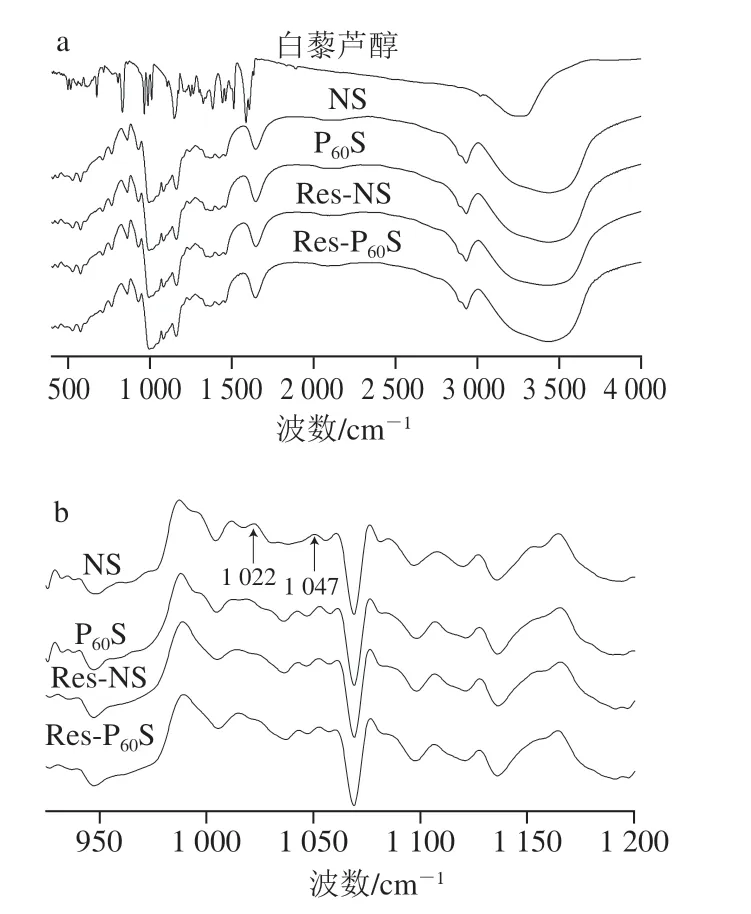
图4 不同香蕉淀粉样品及多酚的FTIR(a)和ATR-FTIR(b)光谱图Fig.4 FTIR (a) and ATR-FTIR (b) spectra of resveratrol and normal and modified banana starch

表3 DBD等离子体和白藜芦醇对香蕉淀粉去卷积化图谱的峰值比值R1047/1022的影响Table 3 Effects of DBD plasma and resveratrol on the ratio of absorbance (R1047/1022) from deconvoluted FTIR spectra at 1047 and 1022 cm-1 of resveratrol and normal and modified banana starch
2.6 溶解度和膨胀力测定结果
溶解度和膨胀力反映了淀粉结构的致密程度及其结晶区与无定形区的结合情况。如图5所示,所有样品的溶解度和膨胀力都随温度的升高而显著增加。DBD等离子体处理使淀粉表面的分子链断裂并伴有裂纹的产生,造成表面结构松散,水分子更容易沿着表面进入颗粒内部,导致内部的淀粉分子更易溶出,提高了淀粉的溶解度[33]。高温可能导致直链淀粉从支链淀粉晶体表面完全迁移,增加了直链淀粉的淋溶,从而具有更高的溶解度[40]。淀粉与白藜芦醇复合后溶解度降低,这是由于白藜芦醇促进了淀粉分子的交联,也可能与淀粉-白藜芦醇复合物形成的致密晶型有关[13]。膨胀度主要与支链淀粉有关。支链淀粉构成淀粉的结晶结构,XRD已证明DBD等离子体与白藜芦醇复合改性提高了香蕉淀粉的结晶度,支链淀粉的排列更加致密有序,复合物的结构更加稳定,从而抑制了淀粉的溶胀。

图5 不同淀粉样品的溶解度和膨胀力Fig.5 Solubility and swelling power of different starch samples
2.7 持油能力测定结果
从图6可以看出,DBD等离子体改性后样品的吸油率有很大提升,这主要是因为等离子体处理引起了淀粉表面损伤,产生了裂缝和小孔,油脂更容易渗入其中。也有可能是等离子体处理导致淀粉中的蛋白质与油脂的接触面积增加,蛋白质的毛细作用将脂肪捕获到淀粉结构中,因此等离子体处理的淀粉具有较高的持油能力[8]。香蕉淀粉-白藜芦醇复合物具有更高的持油能力,这可能是因为香蕉淀粉与白藜芦醇之间的相互作用力增加了淀粉的吸附性。在苦荞淀粉与槲皮素复合后也观察到了这种现象[41]。

图6 不同淀粉样品的持油能力Fig.6 Oil-holding capacity of different starch samples
2.8 冻融稳定性测定结果
冻融稳定性反映了淀粉在冷冻和解冻过程中抵御外界物理变化的能力[42]。通常以析水率作为衡量指标,析水率越大,说明淀粉的冻融稳定性越差。析水率增加主要是由直链淀粉的老化造成[43-44]。不同淀粉样品在冻融循环过程中析水率的变化如图7所示,随着冻融次数的增加,淀粉样品的析水率增加,说明冻融稳定性逐渐变差。DBD等离子体处理后淀粉的析水率增加,这是因为等离子体处理导致直链淀粉分子增多,在老化过程中,相邻淀粉链之间的氢键恢复,重排成更加致密结晶化的分子微晶束,香蕉淀粉分子间的水分被挤出。在冷冻过程中这些水分子结成冰,并在随后的解冻过程中从淀粉凝胶的孔隙中析出,从而导致析水率增大。而淀粉与白藜芦醇复合可以减缓淀粉的老化,因此冻融稳定性较强,这与荞麦黄酮对玉米淀粉以及槲皮素对苦荞淀粉冻融稳定性影响的结果一致[41,45]。

图7 不同淀粉样品在冻融循环过程中析水率的变化Fig.7 Change in syneresis of different starch samples during freeze-thaw cycles
2.9 凝沉特性测定结果
糊化淀粉的凝沉是淀粉分子重排的过程,是淀粉分子从无序混乱状态趋于稳定有序状态的过程[46-48]。在凝沉过程中,直链淀粉分子间的羟基更易形成氢键,链与链之间相互缔合,形成排列紧密有序的大分子微晶胶束,进而发生凝沉;而支链淀粉分子由于其本身“枝桠”结构的影响,分子内部不易相互结合,因此不易发生凝沉。如图8所示,经DBD等离子体处理后,由于淀粉链被降解,形成了更多、更短的直链淀粉碎片,彼此之间更容易发生重排,因此凝沉速率上升[24]。而白藜芦醇可以与淀粉直链和支链上的α-D-葡萄糖的氢基团通过CH-π键结合[49],将芳香残基堆积在淀粉吡喃糖环上[50],并且一个白藜芦醇分子同时能与多个淀粉分子相互作用,形成直链淀粉-白藜芦醇复合物和支链淀粉-白藜芦醇“类直链淀粉”复合物[11],使无定形淀粉分子的有序度增加,从而进一步提高了凝沉速率。

图8 不同淀粉样品的凝沉特性Fig.8 Retrogradation characteristics of different starch samples
2.10 凝胶化热特性分析
通过DSC研究DBD等离子体和白藜芦醇对青香蕉淀粉热特性的影响,热力学参数如表4所示。凝胶化分为3 个阶段。首先,水分被吸收,淀粉颗粒膨胀;其次,更多的水分被吸收,双折射现象迅速消失;最后,淀粉的可溶性部分从体系中浸出[51]。To表示最不稳定微晶的熔化温度,Tc为最稳定微晶的熔化温度[52]。凝胶化温度To、Tp和Tc分别从64.10、71.14 ℃和73.92 ℃提高至70.18、75.79 ℃和82.53 ℃。DBD等离子体处理样品的To、Tp、Tc和ΔH均升高,表明DBD等离子体处理拓宽了香蕉淀粉的凝胶化温度范围,凝胶化所需要的能量升高。这归因于等离子体引起的交联效应、淀粉微晶的异质性增加以及无定形区和结晶区之间的协同熔融程度降低[53]。与白藜芦醇复合后,凝胶化温度和ΔH也升高,这是由于复合物的结构更加致密稳定。此外,难溶性的白藜芦醇附着在淀粉颗粒上,增加了空间位阻,限制了直链淀粉的渗透和支链淀粉的伸展,对淀粉颗粒的溶胀破裂具有阻碍作用[39,54-55]。本研究表明,DBD等离子体和白藜芦醇协同处理提高了香蕉淀粉的凝胶化温度,这与XRD和FTIR的结果一致。
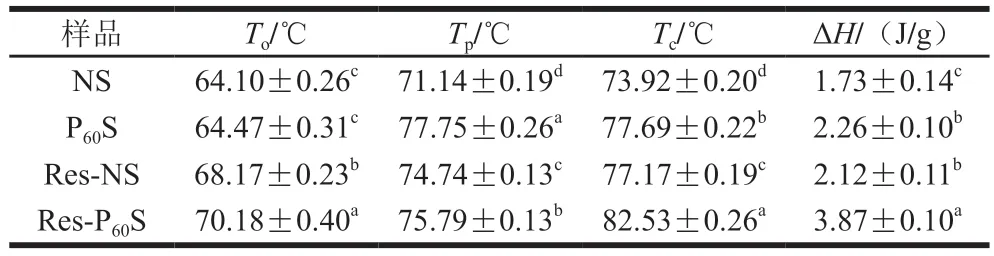
表4 不同香蕉淀粉样品DSC的热力学参数Table 4 DSC thermal parameters of different banana starches
2.11 消化特性测定结果
利用一级消化动力学模型计算淀粉水解的速率常数K、最终水解率C∞以及不同种类淀粉的含量(表5)。K值反映了淀粉的酶解速率,K值越大,说明消化速率越快[56]。图9显示了体外模拟消化过程中不同淀粉样品的水解率。可以看出,等离子体处理后,K值和C∞增加,因此DBD等离子体处理提高了淀粉的水解率和水解速率,这是由RDS含量升高、SDS和RS含量的降低引起。淀粉消化率的提高还与支链淀粉和直链淀粉分子质量的降低以及较大比例的短链有关[57-60]。等离子体处理使淀粉分子发生解聚,产生了很多短链分子和一些单糖或寡糖分子,如麦芽糖、麦芽三糖和麦芽四糖[61],这些游离的小分子更易被淀粉酶消化,因此等离子体改性后淀粉的消化率和消化速率提高。与白藜芦醇复合后,RS和SDS含量升高,RDS含量降低,因此淀粉的水解率降低。此外,白藜芦醇通过非共价相互作用与香蕉淀粉结合,这会竞争性地抑制淀粉酶与淀粉分子的结合,并且白藜芦醇本身对α-淀粉酶和α-葡萄糖苷酶的活性具有抑制作用[62]。因此,香蕉淀粉与多酚复合物具有开发低消化、低血糖保健食品的潜力。

表5 不同淀粉样品模拟 GIT 体外消化的RDS、SDS和RS及水解动力学参数Table 5 Proportions of RDS,SDS and RS and hydrolysis kinetic parameters of different starch samples digested in simulated GIT

图9 模拟体外消化过程中的不同样品的淀粉水解率变化Fig.9 Changes in hydrolysis rate of different starch samples during in vitro digestion
3 结论
通过DBD等离子体和白藜芦醇对香蕉淀粉进行复合改性,研究DBD等离子体改性香蕉淀粉-白藜芦醇复合物的理化特性和消化性。经复合改性后,淀粉的溶解度、持油能力、凝沉性和凝胶化温度显著提高,膨胀力和冻融稳定性降低。香蕉淀粉与白藜芦醇之间通过CH-π键形成结晶度较高的非包合物,结构更加致密有序,热稳定性提高。体外消化实验表明,DBD等离子体处理使淀粉的消化率提高;与白藜芦醇复合后RDS含量降低,SDS和RS含量升高,淀粉的消化率降低。因此,这种新型的复合改性方法不仅改善了香蕉淀粉的加工性能,而且有利于促进等离子体在功能性食品中的应用,所形成的复合物可能兼具多酚和传统RS的益生活性。

