活性氧激活缺氧诱导因子-1α加速宰后成熟初期牛肉能量代谢
郭雨轩,陈 骋,师希雄,郭兆斌,马国源,马纪兵,余群力
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
宰后成熟过程中以糖酵解为主要途径的能量代谢反应对牛肉品质的形成起至关重要的作用[1]。屠宰后缺氧迫使肌肉细胞启动缺氧应答反应,通过糖酵解维持细胞能量供应,该过程引起肌肉pH值变化进而对嫩度、保水性、色泽、风味等关键品质产生重要影响[2]。目前,大量学者基于饲喂管理、屠宰工艺以及宰后成熟等不同角度,对调控糖酵解反应的因素进行了全面研究。例如,采用电刺激处理提升宰后成熟过程中牦牛肉能量代谢水平,加速pH值降低继而促进牦牛肉骨架蛋白质降解,有利于牦牛肉嫩度的改善[3]。饲料中添加直链淀粉以提升宰后能量代谢底物浓度和关键酶活性,间接调节pH值变化速率从而影响肌肉的保水性[4]。但是,宰后成熟过程中牛肉能量代谢受到宰前、屠宰及成熟环节众多因素的影响,现有研究尚不能完全解释宰后能量代谢的调控机理。
缺氧状态下,肌肉细胞能量代谢方式向糖酵解的转变依赖于蛋白质的表达。缺氧诱导因子-1(hypoxiainducible factor-1,HIF-1)作为细胞缺氧条件下能量代谢的重要调控因子,其氧敏感的亚基HIF-1α直接调控大多数糖酵解酶的表达或激活[5-6]。供氧正常时,HIF-1α被脯氨酰羟化酶(prolineamide hydroxylase,PHD)降解,反之HIF-1α则正常表达并上调糖酵解酶表达,促使细胞能量代谢转变为糖酵解[7]。近期研究认为,细胞缺氧应激过程中ROS通过信号传导功能对糖酵解反应的启动表现出重要调控作用。缺氧导致肌肉细胞线粒体的电子传递受阻而产生大量活性氧(reactive oxygen species,ROS),部分ROS扩散至细胞质中作为信号传导分子调控多种细胞生理反应,其中就包括细胞能量代谢[8]。目前,ROS介导HIF-1α调控细胞能量代谢主要有2 种途径:一是ROS通过细胞氧化修饰作用引起PHD活力降低,抑制PHD对HIF-1α的降解作用,促进HIF-1α稳定积累[9];二是ROS能够激活磷酸肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)并促进蛋白激酶B(protein kinase B,AKT)磷酸化,磷酸化AKT(p-AKT)调控HIF-1α稳定表达并与细胞缺氧反应元件(hypoxia response elements,HRE)结合,进而启动糖酵解反应[10]。但是,宰后成熟过程中牛肉细胞糖酵解反应的调控是否依赖于上述机制还有待研究。
因此,本研究选取牛背最长肌,采用ROS激活剂H2O2、清除剂N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)和生理盐水处理后,在温度为4 ℃、相对湿度为85%条件下成熟,依次在第0.5、6、12、24、48小时测定ROS细胞分布及含量、PHD活力、PI3K/AKT信号通路表达水平、HIF-1α细胞聚集和表达水平、糖原含量、R值以及pH值变化水平,进而探究ROS含量对宰后成熟初期牛肉代谢水平的调控机制,以期为进一步明确宰后牛肉品质形成及调控机理提供理论依据。
1 材料与方法
1.1 材料与试剂
平均年龄3 岁、体质量(500±50)kg、饲养条件相同、健康无病的安格斯杂交公牛6 头,选自甘肃康美现代农牧产业集团有限公司。
糖原、次黄苷酸、二磷酸腺苷、三磷酸腺苷含量检测试剂盒、PHD活力检测试剂盒 上海梵态生物科技有限公司;PI3K、p-AKT、HIF-1α、肌动蛋白多克隆抗体(一抗)、辣根过氧化物酶标记山羊抗兔IgG、Cy3标记的山羊抗兔IgG(二抗)、聚偏二氟乙烯膜、NAC上海西格玛奥德里奇贸易有限公司;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)、H2O2北京拜尔迪生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
FV1200激光共聚焦显微镜 日本奥林巴斯公司;GelDoc-It310凝胶成像系统 美国耶拿分析有限公司;Aperio GT450智能数字扫描仪 上海徕卡显微系统贸易有限公司;DYCZ-25D电泳仪 济南来宝医疗器械有限公司;MK-40A离心机 湖南迈克尔实验仪器有限公司;R255自动切片机 湖北泰维科技实业股份有限公司;HS-1145生物组织摊片机 金华华速科技有限公司;UV755B紫外-可见分光光度计 上海荆和分析仪器有限公司。
1.3 方法
1.3.1 样品的采集与处理
肉牛屠宰前24 h禁食、6 h禁水,采用击晕联合三管齐断法屠宰,降低屠宰应激引起的糖原过度消耗。宰后45 min内取背最长肌,切割成厚约3 cm、质量约200 g的肉块。将肉样分成H2O2处理组、NAC处理组及对照组,分别按照肉液比10∶1(g/mL)均匀注射20 mmol/L H2O2溶液、20 mmol/L NAC溶液和0.9%生理盐水。样品置于温度4 ℃、相对湿度85%条件下成熟,分别在0.5、6、12、24、48 h测定pH值并立即采用液氮速冻,然后在-80 ℃条件下保存。
1.3.2 ROS含量测定
参考张玉林[11]的方法制备和封闭切片,滴加ROS荧光探针,37 ℃条件下孵育60 min。然后加入DAPI染色,避光反应3 min显核,用磷酸缓冲液洗去DAPI,甘油封片后立即使用共聚焦显微镜拍照观察ROS的细胞分布情况。ROS荧光强度使用ImageJ进行分析,并以单位面积的荧光强度表示ROS含量。
1.3.3 PHD活力测定
参考Kaluz等[12]的方法,称取1 g肉样剪碎,加入9 mL磷酸盐缓冲液,冰浴匀浆,在6000×g、4 ℃条件下离心10 min,使用PHD活力试剂盒检测上清液PHD活力。PHD活力表示为每克肌肉组织中的酶活力单位数(U)。
1.3.4 PI3K/AKT信号通路表达水平测定
采用蛋白质免疫印迹法测定PI3K/AKT信号通路表达水平。参考Jia Zhen等[13]的方法分离目标蛋白,将蛋白转至聚偏二氟乙烯膜,封闭60 min后加入相应一抗(1∶1000),孵育过夜,再加入相应二抗(1∶500)避光反应60 min。完成后经试剂盒发光,采用凝胶成像系统和化学发光系统进行定量分析,以目的蛋白和标准蛋白灰度的比值表示蛋白表达水平。
1.3.5 HIF-1α细胞聚集与表达水平测定
采用单标免疫荧光法分析HIF-1α细胞聚集与表达水平。参考Federico等[14]的方法制备切片(4 μm),切片采用由高到低不同浓度的乙醇进行洗涤,然后用抗原修复液修复并以5%的BSA封闭。加入相应一抗(1∶500),摇床孵育过夜,再加入相应二抗(1∶100),避光反应60 min。加入染色液反应10 min后滴加淬灭剂孵育5 min,封片处理。立即使用全景切片扫描仪拍照观察。HIF-1α细胞聚集情况以阳性细胞的荧光强度表示。
1.3.6 能量代谢指标测定
样品处理和R值计算参考Wicks等[15]的方法,称取2 g肉样,加入18 mL提取液,高速间歇式匀浆,匀浆液以4 ℃、6000×g离心20 min,收集上清液。分别按照试剂盒说明书测定上清液中糖原、三磷酸腺苷、二磷酸腺苷、次黄苷酸含量。其中,R值按下式计算:
式中:A为二磷酸腺苷含量/(μmol/g);B为次黄苷酸含量/(μmol/g);C为三磷酸腺苷含量/(μmol/g)。
1.3.7 pH值测定
参照邢通[16]的方法,使用便捷式pH计进行测定。
1.4 数据统计
2 结果与分析
2.1 ROS含量变化
肌肉细胞中ROS一方面作为重要的信号分子参与调控多种细胞生理反应,另一方面作为细胞毒性分子,通过加速脂质过氧化反应导致ROS不断积累[17]。从图1可以看出,成熟0.5 h,H2O2处理组的ROS荧光强度(图中绿色标记)略强于对照组与NAC处理组,但随着成熟时间的延长,H2O2处理组的荧光强度显著强于其他2 组。由图2可以看出,3 组样品中ROS含量整体呈显著升高趋势(P<0.05)。其中,外源H2O2处理能够显著提升牛肉初始ROS含量,H2O2处理组成熟0.5 h ROS含量分别是对照组和NAC处理组的1.52、1.77 倍(P<0.05),并在48 h内显著高于其他2 组(P<0.05)。同时,NAC处理组能够在0.5~12 h内显著抑制ROS的积累,但是随成熟时间延长,ROS含量也出现显著升高(P<0.05)。ROS可作为信号分子参与细胞存活和代谢过程的调控,张佳莹[18]发现宰后初期ROS作为上游信号分子通过线粒体细胞凋亡级联反应,加快细胞凋亡进而促进牛肉结构蛋白质降解,间接促进牛肉嫩化进程。刘瑜[19]发现细胞凋亡诱导因子可以显著提升小鼠肌肉细胞中ROS含量,且ROS积累加速HIF-1α聚集进而影响细胞的能量代谢水平,但具体调控机制尚未清楚。由此可见,宰后成熟初期缺氧应激诱导ROS生成,较高的初始浓度能够促进ROS在牛肉中快速积累,并可能对细胞能量代谢发挥调控作用。

图1 宰后成熟过程中牛肉中ROS细胞分布变化(×400)Fig.1 Changes in the cellular distribution of ROS in postmortem bovine muscle (× 400)

图2 宰后成熟过程中牛肉中ROS含量变化Fig.2 Changes in ROS content in bovine muscle during postmortem aging
2.2 PHD活力变化
PHD在供氧正常的细胞中通过降解HIF-1α而抑制其对糖酵解反应的激活作用[20]。为探究宰后缺氧状态下ROS对HIF-1α降解酶PHD的作用,分析宰后成熟过程中不同ROS含量条件下牛肉PHD活力的变化。从图3可以看出,3 组样品PHD活力随宰后成熟时间的延长呈显著下降趋势(P<0.05)。不同的是,H2O2处理组PHD活力在0.5~48 h显著低于其余2 组(P<0.05),并在24 h降低到最低水平(22.15 U/g),分别比对照组和NAC处理组降低30.11%和42.03%(P<0.05)。而NAC处理能够在0.5~12 h内延缓PHD活力的降低,这可能归因于NAC在宰后初期(0.5~12 h)对ROS的抑制作用(图2)。Liu Yang等[21]发现当细胞处于低氧环境时,ROS大量产生并抑制PHD活力,同时检测到HIF-1α表达水平上升,而当恢复供氧后,HIF-1α表达水平迅速下降。供氧正常细胞中,PHD的羟基化作用将HIF-1α修饰标记,后者被希佩尔-林道病蛋白靶向降解[22]。而在缺氧细胞中,不断产生的ROS通过氧化修饰作用破坏PHD的活性位点,导致酶活力降低,从而抑制了HIF-1α的降解,为HIF-1α发挥能量代谢调节作用提供了必要条件[23-24]。本研究结果表明,宰后成熟过程中牛肉产生的ROS对PHD活力具备抑制作用,有利于HIF-1α的稳定积累。

图3 宰后成熟过程中牛肉中PHD活力变化Fig.3 Changes in PHD activity in bovine muscle during postmortem aging
2.3 PI3K/AKT信号通路表达水平变化
PI3K/AKT作为调控HIF-1α稳定表达的关键信号通路,在细胞缺氧的能量代谢中具有重要作用[25]。从图4a、b可以看出,在6~48 h内,不同ROS水平下PI3K的表达水平存在显著差异(P<0.05),H2O2处理组PI3K表达水平在0.5 h分别是对照组和NAC处理组的2.39 倍和2.95 倍,在0.5~12 h内上调42.63%,且显著高于其他2 组(P<0.05)。从图4c、d可以看出,在0.5 h时,H2O2处理组p-AKT表达水平分别是对照组和NAC组的2.62 倍和4.87 倍(P<0.05),并在0~6 h内显著高于其他2 组(P<0.05)。这可能是由于H2O2处理组PI3K在相应时间区间(0.5~12 h)内显著上调,进而迅速靶向调控AKT磷酸化引起,同时也说明成熟初期PI3K/AKT信号通路的激活依赖于ROS的积累。PI3K/AKT是一种特殊的信号通路复合体,PI3K靶向调控AKT磷酸化形成具有活性的p-AKT,后者进一步诱导和活化HIF-1α,以提升HIF-1α的稳定性[26]。近期研究发现,ROS的抑制剂人参皂苷Rk1可以减缓PI3K/AKT信号通路的激活,通过削弱AKT磷酸化水平进而降低能量代谢水平[27]。相反地,红景天苷能够提升PI3K/AKT信号通路活化水平,进而促进HIF-1α稳定表达以加速细胞能量代谢方式的转换[28]。也有研究发现,通过激活嘌呤核苷磷酸化酶能加速ROS的积累,进而提升p-AKT表达,增加HIF-1α转录水平以维持代谢的完整性[29-30]。本研究中较高的初始ROS含量显著加速PI3K/AKT通路的激活,结合ROS对PHD活力的抑制作用(图3),表明宰后成熟初期ROS积累为HIF-1α的稳定表达提供了必要条件。

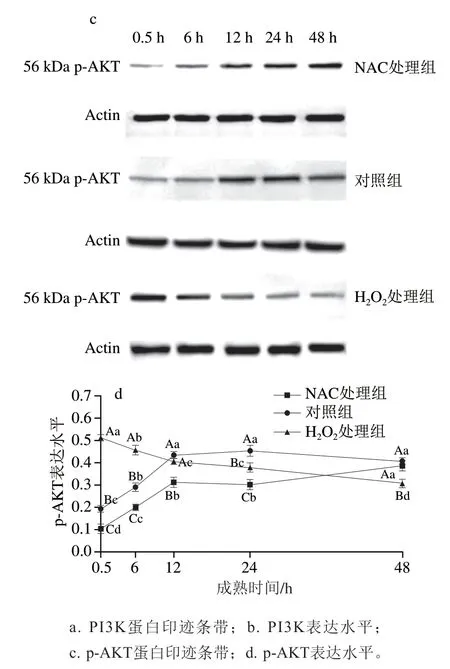
图4 宰后成熟过程中牛肉中PI3K和p-AKT表达水平变化Fig.4 Changes in PI3K and p-AKT expression levels in bovine muscle during postmortem aging
2.4 HIF-1α的细胞聚集与表达水平变化
HIF-1α作为糖酵解反应的上游转录因子在细胞缺氧应答过程中发挥关键作用,在缺氧条件下HIF-1α能够激活90%以上的糖酵解酶和其他关键蛋白质[31]。为了明确ROS对成熟初期牛肉HIF-1α表达水平的影响,进一步分析宰后成熟过程中牛肉HIF-1α聚集情况与表达水平变化。从图5可以看出,3 组样品HIF-1α在0.5 h时聚集程度(图中红色标记)不明显,但随着宰后成熟时间的延长,HIF-1α聚集程度不断升高。H2O2处理组HIF-1α聚集程度明显高于对照组和NAC处理组。如图6所示,宰后成熟0.5~24 h内H2O2处理组和对照组HIF-1α表达水平均显著升高(P<0.05),NAC处理组HIF-1α表达水平在0.5~12 h被抑制,在12~24 h出现显著升高(P<0.05)。此外,H2O2处理组HIF-1α表达水平在24 h时分别是对照组和NAC组的1.34 倍和1.81 倍,并且在6~48 h内保持显著较高水平(P<0.05)。上述结果证实ROS能够促进宰后成熟初期牛肉中HIF-1α稳定表达,这可能是ROS通过抑制PHD活力(图3)和激活PI3K/AKT信号通路(图4)的综合作用机制实现。HIF-1α在缺氧细胞中稳定表达并向细胞核转移,迅速调控HRE中葡萄糖转运蛋白以及多种糖酵解酶的表达,进而上调糖酵解反应通量以维持细胞能量供应[32]。此外,Paik等[33]发现ROS(特别是H2O2)能够诱导细胞中HIF-1α表达,间接激活己糖激酶和磷酸果糖激酶2 种糖酵解限速酶,进而显著提升细胞糖酵解供能效率。因此,宰后成熟初期产生的ROS作为信号分子调控HIF-1α表达并积累,可能对牛肉糖酵解能量代谢表现出调控作用。

图5 宰后成熟过程中牛肉HIF-1α细胞聚集变化情况(×200)Fig.5 Changes in cellular aggregation of HIF-1α in bovine muscle during postmortem aging (× 200)

图6 宰后成熟过程中牛肉HIF-1α表达水平变化Fig.6 Changes in HIF-1α expression level in bovine muscle during postmortem aging
2.5 能量代谢水平变化
为明确ROS介导HIF-1α表达对能量代谢水平的影响,分别对糖酵解底物糖原含量和能量变化水平R值进行测定。图7a中,3 组样品糖原含量均呈现显著下降趋势(P<0.05)。其中,H2O2处理组糖原含量在6~24 h显著低于其他2 组,且在24 h内下降到最低水平(P<0.05),比其他2 组提前了24 h。而NAC组糖原含量下降速率相对较低,在6~48 h内保持显著较高水平(P<0.05)。上述结果表明ROS能够加速宰后初期牛肉糖酵解速率,NAC处理则对糖酵解反应表现出一定的抑制作用。这种影响同时也体现在R值变化特征上,R值是糖酵解过程中三磷酸腺苷供能后分解形成的产物二磷酸腺苷和次黄苷酸与自身含量的比值,R值越高表明能量代谢水平越高[34]。从图7b可以看出,3 组样品R值随宰后成熟时间延长而显著升高(P<0.05)。其中,H2O2处理组R值在6~24 h内显著高于其他2 组(P<0.05),这与图7a中糖原含量变化相对应,表明ROS能够提升宰后成熟初期牛肉糖酵解供能效率。对比3 组样品,H2O2处理组PHD活力、PI3K、p-AKT表达水平在宰后0.5 h就表现出显著差异(图3、4),而HIF-1α表达和能量代谢水平的差异性则出现在6 h(图6、7),进一步证实ROS作为上游信号分子,通过级联反应介导HIF-1α表达,逐步调控和活化糖酵解供能途径。在医学领域,杨威[35]发现当清除肝癌细胞中的ROS后,HIF-1α表达量降低,下游葡萄糖转运蛋白表达水平和糖酵解限速酶活性也随之降低,最终导致糖酵解速率减慢。Feng Xiaomeng等[36]发现缺氧条件下细胞中上游信号分子ROS的增加导致HIF-1α稳定聚集,促进了糖原消耗和R值升高。结合本实验的结果,宰后成熟初期牛肉中ROS的积累促进HIF-1α稳定表达,能够显著提升牛肉的能量代谢水平。

图7 宰后成熟过程中牛肉糖原含量和R值变化Fig.7 Changes in glycogen content and R value in bovine muscle during postmortem aging
2.6 pH值变化
糖酵解反应供能过程中,糖原经酶促反应转化为乳酸,引起pH值下降直接影响肌肉的色泽、嫩度、保水性等重品质,因此pH值常用作评价肉品质的重要指标之一[37]。由图8可以看出,3 组样品在0.5 h时pH值差异不显著,但在成熟过程中均呈现下降趋势(P<0.05)。其中,H2O2处理组pH值在6~12 h内显著低于其他2 组(P<0.05),并且在第12小时达到极限pH值,分别比对照组和NAC处理组提前了12 h和36 h。pH值的变化规律与糖原消耗水平(图7a)保持一致,进一步说明ROS对牛肉能量代谢的调控作用直接影响pH值变化速率。pH值在正常范围内快速降低能够缩短牛肉宰后僵直时间,从而有利于加速肌肉成熟嫩化进程,对改善肉的嫩度、降低水分流失、延缓肉色劣变具有重要意义[38]。此外,肌肉成熟过程中,pH值的降低对糖酵解限速酶活性产生反向抑制作用,加之糖原消耗导致底物供应不足,最终使肌肉能量代谢速率减弱、pH值不再降低[39],这也解释本实验不同处理组在48 h时糖原含量、R值以及pH值达到相近水平,表明ROS对宰后成熟初期能量代谢的调控作用表现在提升能量代谢速率而非程度。然而,上述调控作用对牛肉关键品质影响也有待进一步研究。

图8 宰后成熟过程中牛肉pH值变化Fig.8 Changes in pH in bovine muscle during postmortem aging
3 结论
宰后成熟过程中牛肉会不可避免地产生ROS,其一方面抑制PHD活力,减少了对HIF-1α的降解作用;另一方面能够迅速激活PI3K/AKT信号通路,加速了HIF-1α的稳定积累。HIF-1α作为重要的能量代谢调控转录因子,通过加速糖原消耗显著提升牛肉能量代谢水平,促使牛肉在短时间达到极限pH值。同时,由于成熟过程中糖原的快速消耗和pH值降低对糖酵解反应的反向抑制作用,ROS介导HIF-1α对能量代谢的调控作用局限于加速宰后成熟初期能量代谢。上述结论有助于完善宰后成熟初期牛肉能量代谢的调控机理,为牛肉品质改善技术的研发提供理论依据。

