基于多重连接探针扩增技术的食品中六重过敏原成分检测
王鸣秋,刘 艳,李诗瑶,董婉婷,张 涛,林 津,朱必婷,张 莉,*
(1.湖北省食品质量安全监督检验研究院 动物源性食品中重点化学危害物检测技术国家市场监管重点实验室,湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430075;2.武汉软件工程职业学院,湖北 武汉 430205)
食品过敏被世界卫生组织纳入5 个最重要的公共健康问题之一。据统计,在西方工业化国家高达10%的人群受其影响[1],中国人群横断面调查显示自述/父母报告食物过敏发病率为4.8%~21.13%[2]。过敏症患者摄入过敏原可引发多种免疫反应,包括荨麻疹、瘙痒、水肿、支气管痉挛、鼻炎、呕吐腹泻,甚至呼吸困难、过敏性休克等致命症状[3-5]。一般情况下,过敏原的暴露量为1~100 mg/kg时会引发过敏反应,但有时微量摄入也可致敏。
目前,针对食物过敏尚无有效的治疗手段,唯一可行的办法是避免食入可能导致过敏的食物成分,而消费者预防过敏的途径就是通过食品标签明示信息选择不含过敏原的食物[6]。因此,实施过敏原标签管理是避免食物过敏的重要手段之一。据联合国粮食及农业组织和世界卫生组织统计,90%以上的食物过敏反应由麸质、甲壳类、鱼、鸡蛋、花生、大豆、牛乳和树坚果类八大类过敏原引起[7]。在此基础上,国际法典委员会、欧盟、美国、日韩、澳大利亚等各国根据本地区过敏原流行病学分析制定了各国食品过敏原清单并出台法规条例进行标识管理[8-10]。我国在GB/T 23779—2011《预包装食品中的致敏原成分》和GB 7718—2009《预包装食品标签通则》等标准中对八大类过敏原的种类和标签标识也作出了明确规定[11-12],但在标识风险评估方面仍处于初步研究阶段。因此,开发能够监测和识别食品中常见过敏原的灵敏可靠的分析方法,无论对于过敏原评估、标签管理和风险控制都至关重要。
对于种类复杂且高度加工的食品,一方面其配料本身含有过敏原成分,另一方面存在微量的无意带入,这导致同一食品中可能同时存在多种过敏原成分,且某些过敏原含量甚微[13]。传统检测过敏原的方法多基于免疫学分析,但蛋白质容易受加工条件和复杂基质影响难以满足食品中微量过敏原成分的检测[14]。而DNA分子在工业加工食品中表现出比蛋白质更高的稳定性,且不会被食品基质掩盖,因而在过敏原检测中能够发挥独特分析优势[15-17]。近年来在食品检测领域应用广泛的实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)技术能够通过在一次反应中设置多个靶标实现过敏原的多重检测[18-19]。但多重real-time PCR体系存在一些不可忽视的缺陷,包括靶标扩增的偏好性,不同引物间的自我抑制等[20]。
多重连接探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术是近年来发展起来的一种针对待检DNA序列进行多重定性和半定量分析的新技术,可以通过单一引物进行多达20~50 重靶标的扩增,并通过添加杂交探针灵活扩展检测体系的容量,实现比PCR更高的多重水平,具备高特异性和再现性[21]。目前,MLPA技术已成功应用于人类疾病分子诊断[22]、食品药品真实性鉴定[23]、食源性致病菌检测[24]等领域的研究。
本研究开发一种基于MLPA技术的多重检测体系,成功用于不同食品中常见的6 种过敏原成分(大豆、芝麻、核桃、杏仁、榛子、花生)的同时筛查,具备高效、灵活、特异的优势,旨在为生产企业过敏原污染控制和食品过敏原监管提供技术支撑,保护消费者的食品安全和生命健康。
1 材料与方法
1.1 材料与试剂
6 种过敏原材料(大豆、芝麻、核桃、杏仁、榛子、花生)、特异性验证材料(小麦、大麦、燕麦、青椒、大米、玉米、南瓜、土豆、红豆、芒果、橙、桃、杏、牛、猪、沙虾、黑鱼)、自制模拟样本材料(小麦粉、黄油、糖粉)及商品化食品样品均购于大型商超,特异性验证材料大肠埃希氏菌标准菌株ATCC 25922来自本实验室储藏菌株。
DNeasy®meicon Food Kit 德国Qiagen公司;Premix ExTaq(Probe qPCR) 大连宝生物公司;SALSA MLPA EK5 reagent kit 荷兰MRC-Holland公司;MLPA探针由武汉擎科合成;毛细管电泳缓冲液、POP-7胶、GeneScan 500 LIZ 美国ABI公司。
1.2 仪器与设备
3500毛细管基因分析仪 美国ABI公司;T200 PCR扩增仪、CFX-96荧光定量PCR仪 美国Bio-Rad公司;Tissue LyserII组织研磨仪、QIAxpert核酸浓度测定仪 德国Qiagen公司;5424R高速冷冻离心机 德国Eppendorf公司;A11 basic研磨仪 德国IKA公司;GM 300均质器 德国Retsch GmbH公司。
1.3 方法
1.3.1 模拟参考样本的制备
将6 种过敏原材料用研磨仪磨碎,并过筛(20 目)成细粉末待用。制备面团140 g(70 g小麦粉、56 g黄油、14 g糖粉);称取粉末各10 g与面团混合,均质15 min直至混合均匀。180 ℃烘焙20 min,制成5%的模拟饼干。同时制备不加过敏原的面团相同处理制成0%模拟饼干。将过敏原含量为5%与0%模拟饼干磨碎,以不同质量比混合,均质15 min,分别制成过敏原含量为10000、1000、100、10、5、1、0.1 mg/kg的模拟饼干参考样品。
1.3.2 DNA提取
液体样品取40 mL于离心管中12000 r/min离心15 min,取沉淀作为DNA提取起始样本;固体样品直接称取2 g样本,按照试剂盒说明书进行基因组DNA提取。使用QIAxpert测定DNA含量和评估DNA纯度。提取后的DNA稀释至20 ng/μL存放于-20 ℃备用。
1.3.3 MLPA探针的设计与合成
NCBI获取大豆、芝麻、核桃、杏仁、榛子、花生6 种源性成分的内转录间隔区(internal transcribed spacer,ITS)序列作为探针设计靶标,根据MRCHolland公司提供的探针设计要点,使用Geneious 10.2.2设计对应MLPA探针对,BLAST验证其特异性。探针采用高效液相色谱纯化,右侧探针5’端采用磷酸化处理。PCR扩增引物采用试剂盒自带引物。左探针(left probe oligonucleotide,LPO)和右探针(right probe oligonucleotide,RPO)及引物序列见表1。

表1 MLPA检测探针及引物序列Table 1 Probes and primers used for MLPA
1.3.4 MLPA检测
参照MLPA试剂盒说明书进行MLPA检测:取5 μL DNA模板(20 ng/μL)95 ℃变性5 min,冷却至25 ℃,加入3 μL杂交混合液(1.5 μL探针混合液和1.5 μL SALSA缓冲液),60 ℃杂交16 h。探针混合液中各探针终含量为2 fmol。加入连接酶反应液32 μL(3 μL缓冲液A、3 μL缓冲液B、25 μL H2O、1 μL Ligase-65),54 ℃、15 min,98 ℃、5 min。冷却至25 ℃后加入PCR反应混合液10 μL(7.5 μL H2O,2 μL PCR primer mix,0.5 μL SALSA聚合酶),95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,循环35 次,72 ℃、20 min。每个反应设置2 个平行。
取1 μL PCR产物(稀释10~100 倍),加入9 μL HiDi和0.5 μL Genescan 500 LIZ混合,用3500毛细管基因分析仪进行毛细管电泳片段分析。电泳条件为运行温度60 ℃、进样时间5 s、进样电压1.6 kV、运行时间1800 s、运行电压15 kV。数据由GeneMapper 4.0软件进行分析。
1.3.5 PCR产物测序
将6 种过敏原单重检测中PCR产物纯化送至武汉擎科生物有限公司进行双向测序,测序结果经Geneious 10.2.2软件拼接后在NCBI GenBank进行BLAST比对验证。
2 结果与分析
2.1 检测靶标的选择和探针的设计
ITS是核糖体基因18S-5.8S-26S之间内部转录间隔序列,核糖体编码基因在植物中高度保守,但ITS具有物种特异性,能够区分亲缘性较高的物种,是植物系统发育学最受关注的工具之一[25]。同时,由于ITS序列的多拷贝特性,更适合经过复杂加工的食品样品的DNA扩增,能够提高检测的灵敏度[26]。因此,本研究选取核糖体DNA ITS区域作为靶标序列设计大豆、芝麻、核桃、杏仁、榛子和花生6 种过敏原探针。
MLPA检测每个靶标需要设计两个相邻的半探针LPO和RPO,包含各自特异性杂交位点(hybridizing site,HS)以及通用引物结合位点(primer binding site,PBS)。为便于片段分析,每个靶标LPO和RPO连接片段长度应相差4 bp以上,本研究在PBS和HS间加入了填充序列调整产物长度以区分不同靶标。当相邻的半探针与目标结合并连接后,会产生特定大小的目标DNA产物,经通用引物PCR扩增后即可由毛细管电泳分离检测。
2.2 特异性分析
探针序列在NCBI GenBank中经BLAST比对验证,显示6 对探针特异性良好。每种探针与其靶标物种DNA模板进行MLPA测试,均产生单一扩增峰,其大小分别为芝麻103.16 bp、榛子110.98 bp、大豆115.67 bp、花生119.61 bp、核桃123.75 bp、杏仁130.78 bp,结果见图1。将PCR产物测序序列经BLAST比对确证为对应物种ITS序列,同源性均为100%。利用6 种探针组合进行随机多重检测,均可产生与预期大小一致的扩增峰,这说明该MLPA体系能够进行六重过敏原的同时检测。混合探针实际片段大小与理论值有2 bp左右偏差,其原因可能为1)Genescan 500LIZ与待测片段荧光标记不同导致的电泳迁移率不同;2)不同片段DNA结构和碱基组成的不同导致迁移率不同[27]。

图1 6 种过敏原混合MLPA毛细管电泳检测图Fig.1 Capillary electrophoresis of the MLPA system using a mixture of sesame,hazelnut,soybean,peanut,walnut and almond DNAs
鉴于食品成分的复杂性,有必要将含过敏原食品中可能出现的物种作为特异性筛查对象进行验证。结果表明(表2),除杏仁外,其他探针与待测物种均无交叉反应。而杏仁探针与杏、桃均有交叉反应,这与其物种亲缘关系较近有关,这提示当食品中同时含有杏仁与这几种成分时阳性结果需通过测序或其他技术手段进一步区分。
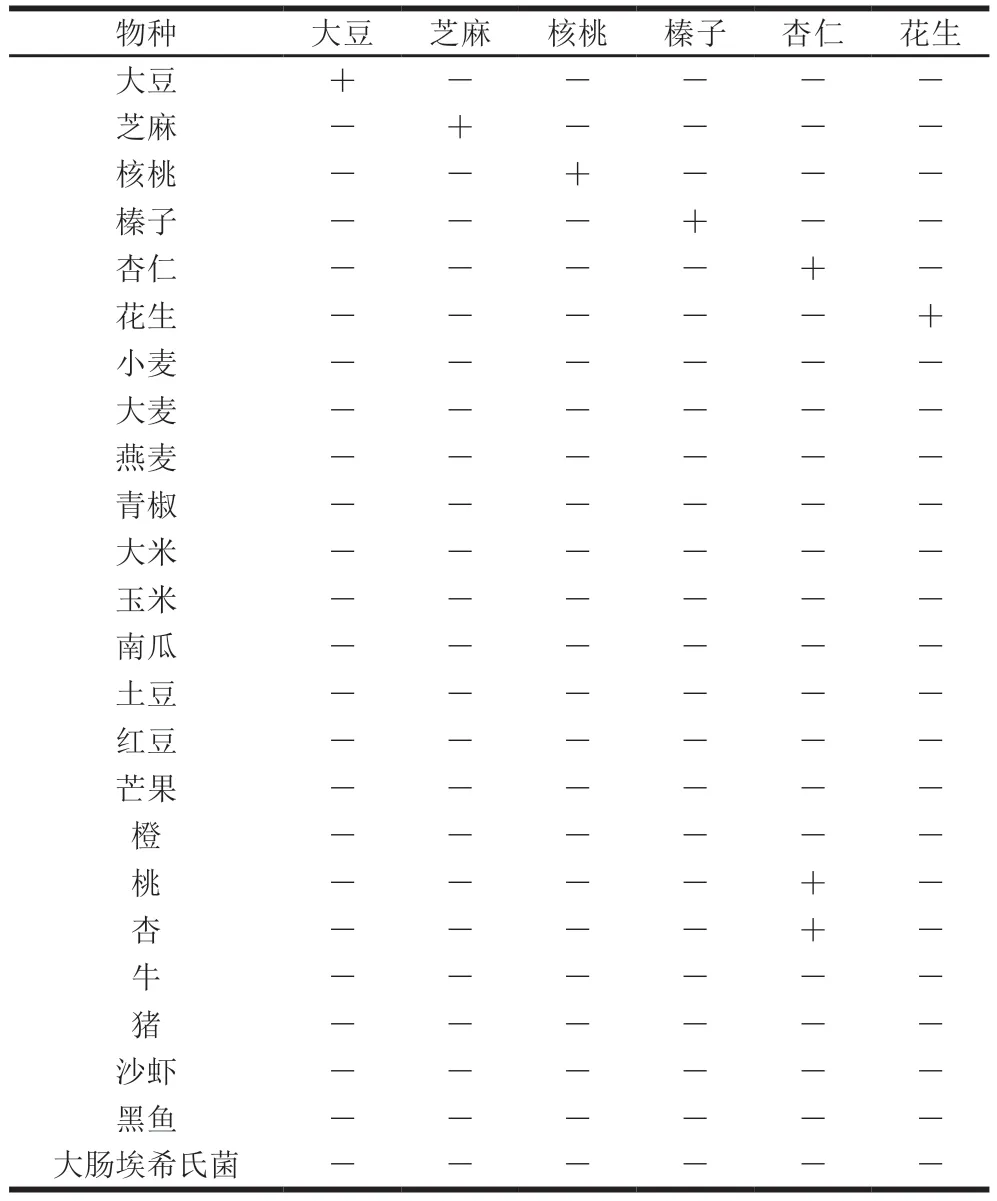
表2 过敏原MLPA体系特异性验证结果Table 2 Specificity of allergen-MLPA system
2.3 灵敏度分析结果
由于缺乏多重过敏原成分检测的标准样品,课题组自制模拟参考样品测定MLPA体系的灵敏度。考虑到大豆、芝麻、核桃、杏仁、榛子和花生以配料形式广泛存在于各类食品中,本研究选取了饼干作为模拟样品制备的基质,同时添加6 种过敏原,其中各过敏原含量0.1~10000 mg/kg不等,充分模拟了食品加工过程中过敏原的无意污染和有意添加的情况。所有原材料均预先进行了MLPA测定,证实不含有靶标物质。
该方法灵敏度定义为在该含量下,所有平行实验均为阳性结果。图2显示了模拟参考样品在过敏原含量为100、10、5、1 mg/kg时MLPA毛细管电泳测定图谱,可见随着过敏原含量逐渐降低,扩增峰信号值也随之降低,直至含量为1 mg/kg时平行实验结果部分为阴性。因此,经测定本方法总灵敏度为5 mg/kg。6 种过敏原中,核桃信号峰较其他成分始终较低,含量为5 mg/kg时信号值已降至接近1000 RFU,而在各模板浓度相同的混合样本测定时并非如此(图1),推测与该成分DNA提取效率较低有关。起始材料取样量相同的情况下进行DNA提取时,其他5 种过敏原材料最终提取质量浓度可达50~100 ng/μL之间,而核桃质量浓度只有20 ng/μL左右。主信号峰左侧(n-1)处出现的低信号峰与进样速度和寡核苷酸杂质有关。为避免导致严重过敏反应,理想的过敏原检出限应为1~100 mg/kg过敏原成分或1~10 mg/kg蛋白组分[28],而本方法达到的检出限5 mg/kg能够满足该要求,且低于López-Calleja[20]、Mustorp[29]以及García-García[30]等报道的10~50 mg/kg的检出限。与现有过敏原标准SN/T 1961—2013《出口食品过敏原成分检测》[31]对比,利用单重real-time PCR检测大豆、杏仁、芝麻、核桃、榛子时其检出限为100 mg/kg,远高于本方法检出限。

图2 添加6 种过敏原模拟样品MLPA毛细管电泳检测图Fig.2 Capillary electrophoresis patterns for MLPA analysis of model cookie spiked with six allergens at different concentrations
2.4 实际样品分析结果
为评估过敏原MLPA体系对于实际样本的检测能力,对市售30 份食品样品进行过敏原MLPA测定,包括糖果、巧克力、调味酱、麦片、冰淇淋、糕点、饮料、婴幼儿辅食等。根据各国过敏原标识规定,商品的过敏原标签应包括强制标识含有的过敏原成分及交叉接触导致可能含有的过敏原标识。本研究采集的30 份样品中,通过标识“该产品含有××”、“可能含有××”或“该生产线同时生产××”等提示添加或可能含有的过敏原成分。表3显示了各样品过敏原标识情况及最终检测结果,图3显示了典型样品的MLPA检测结果。

表3 市售食品过敏原MLPA检测结果Table 3 Results of MLPA analysis of commercial food products
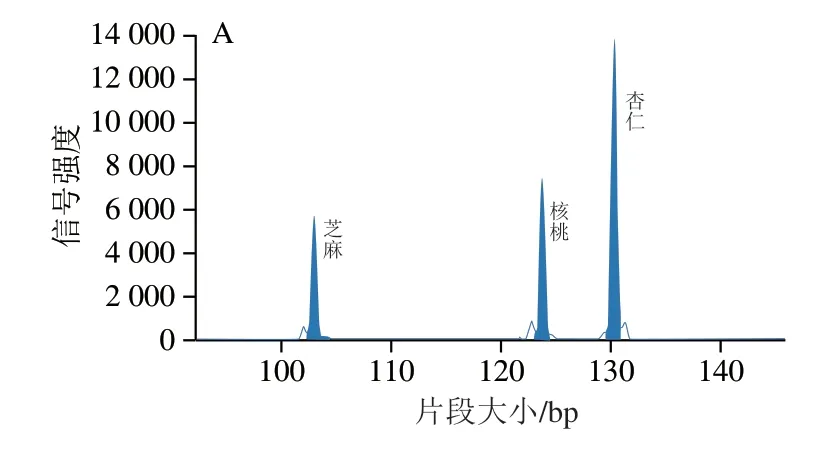

图3 实际样品MLPA毛细管电泳检测图Fig.3 Capillary electrophoresis patterns for MLPA analysis of commercial food products
从表3可见,50%的样品检测结果与过敏原标称不一致(样品3、4、5、9、10、13、15、18、19、22、23、24、25、29、30),其中样品3、4、5、9、13、22、23、25、29、30检出未标称的过敏原成分,而样品3、10、15、18、19、24部分标称过敏原未检出。这可能是由于同一生产线生产不同产品中途未清洗彻底或原料储存时的交叉污染导致,也有部分结果可能是以低价原料冒充高价原料的故意掺假行为所致。但无论是何种原因,这种与标称过敏原不一致的情况很可能会导致过敏人群的误食行为,带来安全隐患。
由于微量过敏成分便有可能引发过敏反应,市售商品一般会在食品包装上以“可能含有”字样进行免责申明。以上检测结果中,样品4、5、9、23、25所检出的与声称不一致的成分均在可能含有提示中出现,从一定程度上能够提醒消费者避免食用风险。然而,大部分可能含有的提示成分也并未在最终检出结果中呈现,这也提示在过敏原标签管理上应该更加严格和谨慎,避免因为过度标注而提升过敏症人群选购食品的难度。
3 结论
与其他过敏原检测方法相比,MLPA检测具备以下优势:探针标记简单、用量少、成本低;探针之间相互影响小,能够在体系中灵活添加或减少,多重检测靶标数量多等。但食品中过敏原核酸检测受限于食品基质和加工的影响,对方法的检出限和抗抑制能力要求较高。本研究建立的六重过敏原MLPA检测体系能够同时对芝麻、花生、大豆、杏仁、榛子和核桃进行检测,检出限为5 mg/kg,特异性较好、灵敏度高,性能满足市售样品检测需求,有望成为过敏原标签监管的有力技术支撑。而杏仁源性探针的特异性有待进一步提升,以区分亲缘关系较近物种。

