基于方波伏安法的聚多巴胺@纳米银修饰玻碳电极测定畜禽肉中氯丙嗪
邹玉婷,段宁馨,古飞燕,黄泓凯,赵晓娟,刘功良,罗忠润
(仲恺农业工程学院轻工食品学院,农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东省岭南特色食品科学与技术重点实验室,广东 广州 510225)
氯丙嗪(chlorpromazine,CPZ)因具有镇静、催眠的功效而被不法商家广泛用于食用动物的增质量催肥[1],人体长时间或较大剂量摄入有CPZ残留的动物源食品会导致体质量增加,严重时还会引发心律异常、昏迷和癫痫发作等,对人体健康有不容忽视的影响[2]。中国是动物源食品生产和消费大国,对CPZ进行检测是保证动物源食品安全的一项重要举措[3]。
动物源食品中CPZ的检测主要以高效液相色谱法、液相色谱-质谱联用法等高效、准确地确证分析方法为主[4-5],而电化学传感检测法具有操作简便、快速灵敏、仪器便捷和成本较低等优势[6-8],在食品安全领域也备受研究关注。例如:Lu Zhiwei等[9]将氮掺杂氧化石墨烯量子点和金纳米粒子共同沉积在修饰了NiS2纳米粒子/碳基纳米球的玻碳电极(glassy carbon electrode,GCE)上,以烟酰胺为功能单体,CPZ为模板制备分子印迹聚合物膜进行特异性识别,CPZ的检出限为0.00025 µmol/L,可应用于人体血清、尿液和药品分析。Periyannan等[10]通过一步水热法改变掺杂在铋酸铜纳米粒子中铟离子(In3+)的浓度,CPZ的检测限为0.0012 µmol/L。这些电化学检测方法虽然具有较高的灵敏度,但修饰材料的制备往往需要在高温高压条件下进行,存在程序复杂和耗时长等问题,因此,探索新型绿色修饰材料和进一步降低制备难度,从而缩短制备时间和降低成本,对提高电化学传感检测方法在食品安全领域的应用价值具有重要意义[11]。
纳米银(sliver nanoparticles,AgNPs)材料具有导电性强、电子转移速率快和催化活性高等独特性质,被广泛用作电极修饰材料[12-14]。因多巴胺(dopamine,DA)分子中上含有易于被氧化的酚羟基和胺基,通过自聚反应可在工作电极或各种材料表面形成聚多巴胺(polydopamine,PDA)膜,是一种高效绿色的修饰材料[15-16]。PDA具有还原性,将银离子还原为AgNPs的同时,其结构中未被氧化的酚羟基以及残余的多巴胺醌与AgNPs可通过非共价键(如氢键、电荷转移和π-π堆叠作用)结合,从而防止AgNPs团聚,促进AgNPs的电催化活性[17]。
如图1所示,本实验将GCE置于AgNPs和DA的混合溶液中,DA通过自聚反应在AgNPs和电极表面形成PDA膜,制得修饰电极(PDA@AgNPs/GCE)。对该修饰电极的制备条件和CPZ的测定条件进行优化,利用循环伏安(cyclic voltammetry,CV)法、电化学阻抗(electrochemical impedance,EIS)分析和扫描电子显微镜(scanning electron microscopy,SEM)对修饰电极进行表征。便可实现最后用PDA@AgNPs/GCE对畜禽肉中的CPZ含量的进行测定,并利用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法进行方法验证。
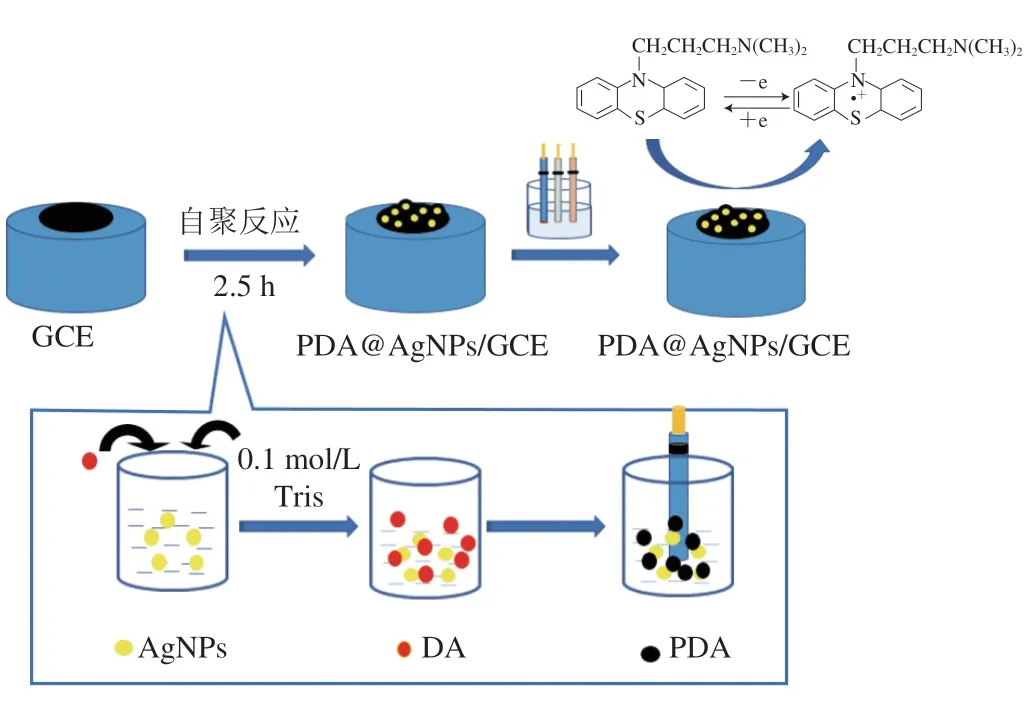
图1 PDA@AgNPs/GCE的制备过程Fig.1 Flow chart of the preparation process of PDA@AgNPs/GCE
1 材料与方法
1.1 材料与试剂
猪肉、牛肉和鸡肉 广州海珠万国超市;硝酸银(≥99.8%) 广东光华科技股份有限公司;盐酸多巴胺(≥99.8%)、聚乙烯吡咯烷酮(58000,K30)上海麦克林生化科技有限公司;硼氢化钠(≥98.0%)天津市福晨化工试剂厂;盐酸氯丙嗪(≥99.0%,标准品)上海阿拉丁生化科技股份有限公司;三羟甲基氨基甲烷(≥99.9%) 美国西格玛生物试剂公司。所用试剂均为分析纯。
1.2 仪器与设备
CHI660E电化学分析仪 北京华科普天科技有限公司;工作电极为GCE(Φ3 mm),参比电极为Ag/AgCl电极,辅助电极为铂丝电极、Vortex Mixer V6旋涡混匀器 上海辰华仪器有限公司;HR/T20M台式高速冷冻离心机 湖南赫西仪器装备有限公司;便携式pH计 奥豪斯仪器(上海)有限公司。
1.3 方法
1.3.1 AgNPs溶液的制备
参考文献[18]方法制备AgNPs溶液。移取4 mL 1 mg/mL聚乙烯吡咯烷酮溶液于装有43.5 mL超纯水的烧杯中,在电磁搅拌下加入1 mL 5 mmol/L硝酸银溶液(换算成制备液中的浓度为1×10-4mol/L),逐滴加入1.5 mL 11.8 mg/mL硼氢化钠溶液(现配现用),搅拌30 min,直至溶液变为透明的亮黄色,制备成AgNPs溶液于4 ℃保存备用。
1.3.2 PDA@AgNPs/GCE的制备
GCE按参考文献[8]方法进行预处理。
将适量的盐酸多巴胺固体溶解于AgNPs溶液中,用0.1 mol/L Tris缓冲溶液调pH 8.5,最后得到1 mg/mL DA和AgNPs的混合溶液。将GCE置于该混合溶液中,在避光自聚2.5 h,取出电极用超纯水淋洗后,即得到测定CPZ的修饰电极(PDA@AgNPs/GCE)。
1.3.3 样品前处理
分别称取去皮去骨的猪肉、牛肉和鸡肉(2.00±0.01)g置于50 mL具塞离心管中,准确加入乙腈(含1%乙酸)10 mL,旋涡提取5 min,10000 r/min高速离心10 min后取上清液。重复提取1 次合并上清液。于30 ℃减压旋转蒸发至干,加入5 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(含10%乙腈)溶解后待测。
1.3.4 电化学仪器条件
将三电极电化学系统置于含有盐酸CPZ的pH 7.0 PBS中,静置210 s后于电位0~1.0 V,电位增量为12 mV,方波振幅为60 mV,方波频率为40 Hz条件下进行方波伏安(square wave voltammetry,SWV)扫描。
1.3.5 PDA@AgNPs/GCE的表征
CV法:将修饰电极置于5 mmol/L的K3Fe(CN)6溶液中,采用CV法在电位为-0.2~0.8 V,扫描速率为50 mV/s,对该工作电极进行表征,即可得到K3Fe(CN)6在该工作电极的电化学响应情况。
EIS法:将修饰电极置于5 mmol/L的K3Fe(CN)6溶液中,采用EIS在振幅为5 mV,频率范围为0.1~100000 Hz下对该工作电极进行表征,即得到EIS交流阻抗谱图,结合等效电路拟合便可用于分析电极与溶液界面处的反应动力学参数。
SEM法:将扫描电镜电极置于修饰物溶液自聚2.5 h,利用型号为VEGA 3 SBH的SEM对修饰物进行不同放大倍数的观察与拍摄。
1.4 数据处理
利用Excel对实验数据统计汇总和分析。用Origin 8.1软件进行绘图分析。
2 结果与分析
2.1 修饰材料的选择
CPZ容易发生氧化反应,用GCE测定时出现了一个明显的氧化峰,但GCE的选择性较差。为了提高测试灵敏度和选择性,需要对GCE进行修饰。将AgNPs溶液滴涂在GCE表面,或将GCE置于不含/含AgNPs的DA溶液中进行自聚反应,得到AgNPs/GCE、PDA/GCE和PDA@AgNPs/GCE共3 种修饰电极。分别考察2×10-7mol/L和5×10-6mol/L CPZ在3 种电极上的电化学响应,结果如图2所示。虽然5×10-6mol/L CPZ在AgNPs/GCE表面的峰电流响应值最大,但2×10-7mol/L CPZ仅产生了微弱的电流响应。此外,在电极表面滴涂修饰的AgNPs的稳定性较差,在淋洗和测定的过程中容易脱落,影响实验的准确性和重现性[19]。与PDA/GCE相比,PDA@AgNPs/GCE对2×10-7mol/L、5×10-6mol/L CPZ均产生了灵敏的响应,且峰形尖锐,可能是由于自聚在AgNPs和电极表面的PDA中含有大量的羟基(—OH)和氨基(—NH2)等活性基团[20],不仅能使AgNPs均匀分散在电极表面,提高AgNPs的稳定性,而且能与CPZ分子的吩噻环之间产生较强的氢键及静电吸引作用力,从而有利于溶液中的CPZ吸附在修饰电极表面发生电化学反应,提高测试灵敏度。故选用PDA@AgNPs对GCE进行修饰。
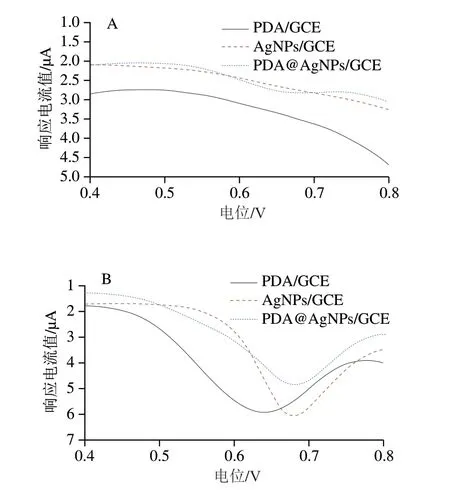
图2 不同修饰电极对2×10-7 mol/L(A)和5×10-6 mol/L(B)CPZ的电化学响应情况Fig.2 Electrochemical responses of different modified electrodes to 2 × 10-7 (A) and 5 × 10-6 mol/L (B) CPZ
2.2 硝酸银和DA含量的选择
将适量DA加入AgNPs溶液(AgNPs制备液中硝酸银浓度分别为2×10-6、1×10-5、2×10-5、1×10-4、2×10-4mol/L)中,用0.1 mol/L Tris缓冲溶液调pH值为8.5,制成1 mg/mL DA和AgNPs的混合溶液,将GCE置于各溶液中避光自聚2.5 h,用各修饰电极对5×10-6mol/L CPZ的电化学响应进行测定。如图3A所示,随着AgNPs制备液中硝酸银浓度的增加,所制备的修饰电极对CPZ的峰电流值也随之上升。尽管AgNPs制备液中硝酸银的浓度为2×10-4mol/L时CPZ的峰电流值明显增加,但氧化峰的峰形较为宽大,在测试实际样品时容易受到基质的干扰。此外,硝酸银的浓度过高会使所制备的AgNPs的粒径变大,影响电极表面AgNPs的稳定性。故AgNPs制备液中硝酸银的浓度选择为1×10-4mol/L。
DA的浓度会直接影响其在材料表面的聚合速率和PDA膜的厚度。因此,分别配制质量浓度为0.5、1.0、1.5、2.0 mg/mL的DA和AgNPs的混合溶液,其他制备步骤同上,并对5×10-6mol/L CPZ的电化学响应进行测定,结果如图3B所示。当DA质量浓度低于1 mg/mL时,所制备的修饰电极对CPZ的响应电流值随着DA质量浓度的增加而增大;当DA质量浓度高于1 mg/mL时,CPZ的响应电流值减小,可能是由于高质量浓度的DA在AgNPs和GCE表面形成了较厚的自聚薄膜,测定时会影响CPZ向电极表面的电子传递,从而导致测定时灵敏度降低,故DA质量浓度选择以1 mg/mL为宜。
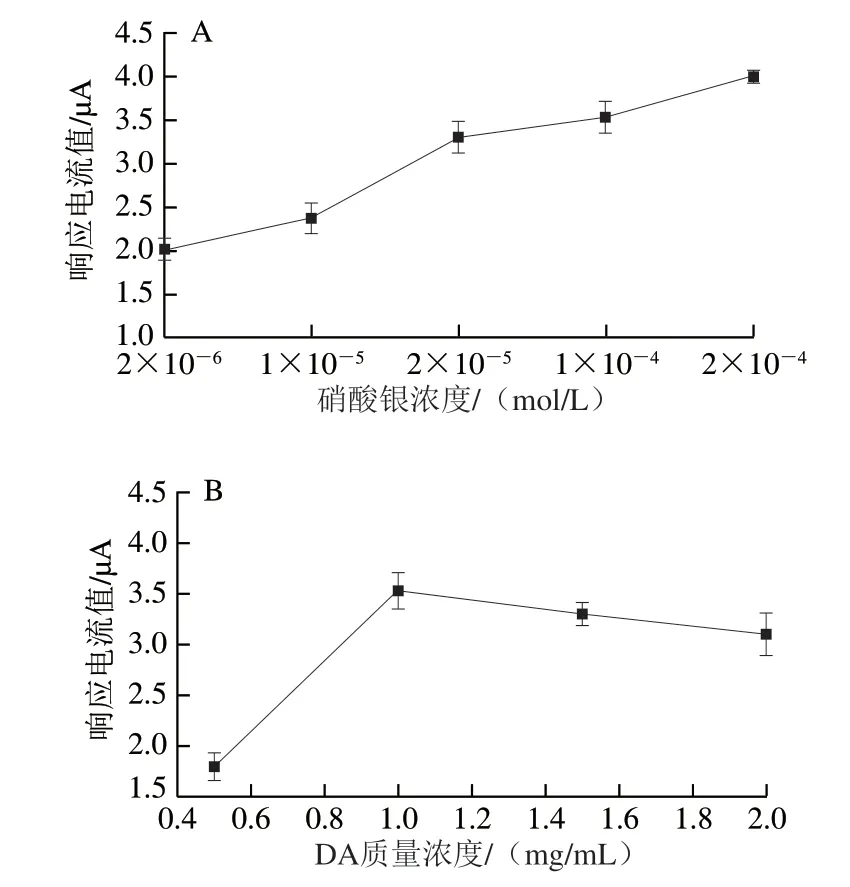
图3 硝酸银(A)和DA(B)质量浓度对5×10-6 mol/LCPZ电化学响应的影响Fig.3 Effects of different concentrations of silver nanoparticles (A) and dopamine (B) on the electrochemical response to 5×10-6 mol/L CPZ
2.3 自聚溶液反应介质和自聚时间的选择
在有氧条件下,DA在弱碱性的水介质中通过1,4-迈克尔加成反应生成多巴醌,然后经过重排形成PDA[21]。选择不同弱碱性的水介质会影响DA的聚合速率,进而改变PDA的形貌和粒径,最终影响CPZ在PDA@AgNPs/GCE表面的电子转移。因此分别用0.1 mol/L NaOH、PBS、氨水和Tris缓冲溶液调配1 mg/mL的DA与AgNPs的混合溶液(pH 8.5),将GCE置于各溶液中于室温避光反应2.5 h。由图4可知,与Tris缓冲液相比,氨水作为反应介质时制备的修饰电极对CPZ的电流响应值明显较小;NaOH溶液或PBS作为反应介质时,电极对5×10-6mol/L CPZ的电流响应值较高,但对2×10-7mol/L CPZ的测试效果明显较差。可能是由于DA在NaOH溶液中的氧化速率快,易于在AgNPs和电极表面形成PDA膜,但AgNPs表面聚合膜厚度的增加导致PDA起主体作用而抑制AgNPs对CPZ的电催化作用;PBS中的磷酸盐离子与DA之间形成氢键,聚合时会产生阻聚作用[22],影响PDA膜的生成速率,电极表面AgNPs的稳定性较差;Tris缓冲液和氨水中均有氨基,可参与DA的自聚过程[23],但DA的自聚反应对溶液的pH值非常敏感,氨水作为反应介质时无法保持溶液pH值的稳定,从而影响PDA膜的形成,而DA在Tris缓冲液中更易于在基材表面形成稳定的PDA膜,使AgNPs均匀分散在电极表面,从而使CPZ产生良好的电化学响应。综合考虑,选择Tris缓冲液作为自聚溶液的反应介质。
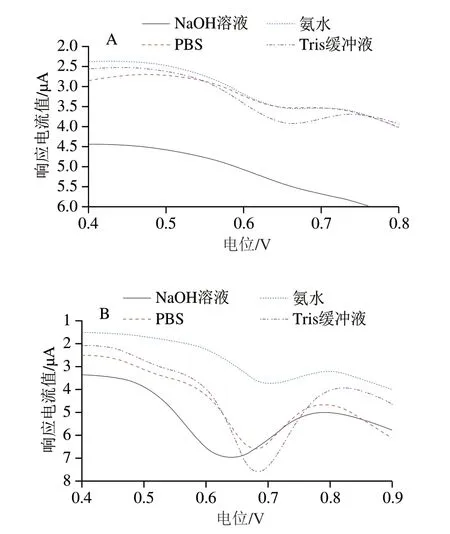
图4 不同自聚溶液对PDA@AgNPs/GCE测定2×10-7 mol/L(A)和5×10-6 mol/L(B)CPZ的影响Fig.4 Influence of self-aggregation solutions on PDA@AgNPs/GCE detection of 2 × 10-7 (A) and 5 × 10-6 mol/L (B) CPZ
自聚时间影响PDA膜的厚度,从而影响修饰电极对CPZ的电化学响应。将GCE置于1 mg/mL DA和AgNPs的混合溶液中,分别自聚0.5、1、2、2.5、3、4、6 h,考察不同自聚时间制备的PDA@AgNPs/GCE对5×10-6mol/L CPZ的电化学响应,如图5所示。随着自聚时间的延长,CPZ的响应电流值迅速增大;而当自聚时间大于2.5 h后,峰电流值便开始逐渐下降。由于自聚时间过长时,会使PDA修饰膜致密厚实,影响AgNPs对CPZ的电催化作用,也阻碍了CPZ在PDA@AgNPs/GCE表面的电子转移,降低了电子迁移的效率,从而使CPZ的氧化峰电流值降低。根据响应灵敏度和修饰电极的制备效率,DA的自聚时间确定为2.5 h。
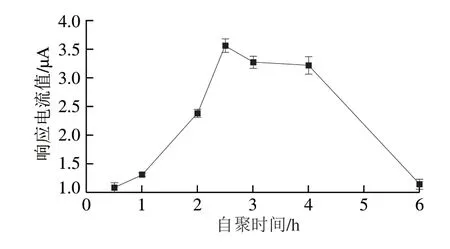
图5 自聚时间对PDA@AgNPs/GCE测定5×10-6 mol/L CPZ的影响Fig.5 Influence of self-aggregation time on PDA@AgNPs/GCE detection of 5×10-6 mol/L CPZ
2.4 测试底液的选择
测试底液的种类和pH值通常会影响CPZ的分子结构和稳定性,从而影响CPZ在修饰电极表面的结合能力。分别以pH 4.0、5.0、6.0、7.0、8.0、9.0、10.0的PBS,pH 4.0、5.0、6.0、7.0、8.0的伯瑞坦-罗宾森(britton-robinson,BR)缓冲溶液和pH 4.0、5.0、6.0的醋酸-醋酸钠缓冲溶液(acetate buffer solution,ABS)配制5×10-6mol/L CPZ溶液,考察PDA@AgNPs/GCE在不同缓冲液配制的CPZ溶液中的电化学响应,结果如图6所示。用pH 7.0 PBS配制的CPZ在PDA@AgNPs/GCE上的峰电流值最大,且峰形最好。故选择pH 7.0的PBS作为CPZ的最佳测试底液。
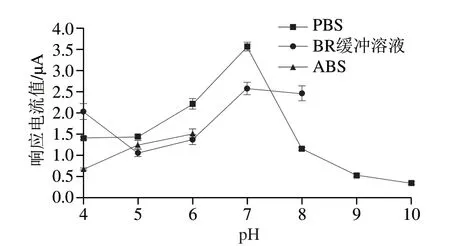
图6 不同pH值的PBS、ABS和BR对5×10-6 mol/L CPZ测定效果的影响Fig.6 Effects of PBS,ABS and BR at different pH on the detection of 5×10-6 mol/L CPZ
2.5 富集时间
通过延长溶液与电极的接触时间将待测物质富集在电极表面,从而增加响应电流。考察富集时间分别为0、30、60、90、120、150、180、210、240、270、300 s时,5×10-6mol/L CPZ在PDA@AgNPs/GCE上的电化学影响,结果如图7所示。当富集时间小于180 s时,峰电流值随富集时间的延长而增大,而富集时间大于180 s后,峰电流值趋于稳定,此时CPZ在PDA@AgNPs/GCE表面达到吸附平衡,故选择180 s为最佳富集时间。
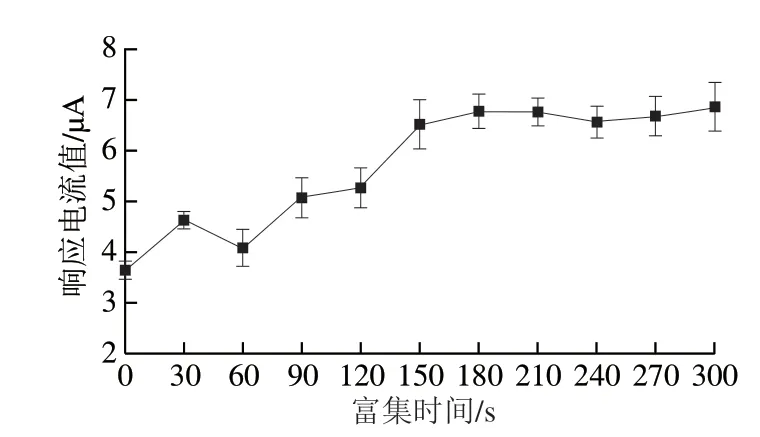
图7 富集时间对5×10-6 mol/L CPZ的电化学响应值的影响Fig.7 Effect of enrichment time on electrochemical response to 5×10-6 mol/L CPZ
2.6 PDA@AgNPs/GCE的表征
2.6.1 CV法
将GCE、AgNPs/GCE、PDA/ GCE和PDA@AgNPs/GCE置于5 mmol/L的K3Fe(CN)6溶液中,利用CV法对修饰电极进行表征,结果如图8所示。K3Fe(CN)6在GCE、AgNPs/GCE、PDA/GCE和PDA@AgNPs/GCE表面均出现了明显的氧化还原峰,4 种电极的峰电流分别为99、43、65 μA和79 μA。由于带负电荷的AgNPs对铁氰酸根阴离子的排斥作用,使K3Fe(CN)6在AgNPs/GCE上的峰电流远小于GCE;PDA膜本身不导电,导致K3Fe(CN)6的响应电流下降;当在GCE表面利用DA的自聚特性包裹和分散AgNPs时。由于PDA与AgNPs之间的协同作用,使K3Fe(CN)6的响应电流进一步提高。上述实验结果表明,利用PDA@AgNPs对电极进行修饰能提高电子转移速率,增加电极过程的可逆性,同时也表明AgNPs与PDA均已成功地修饰在GCE表面。
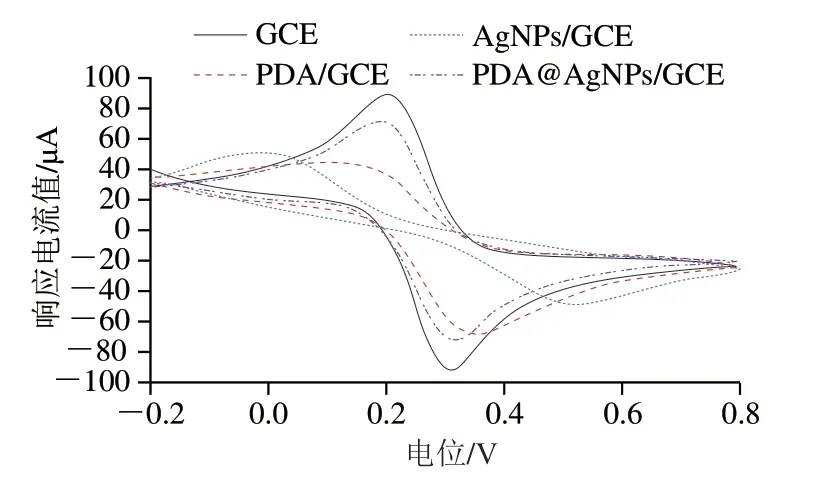
图8 GCE、AgNPs/GCE、PDA/ GCE和PDA@AgNPs/GCE在K3Fe(CN)6溶液中的CV图Fig.8 CV curves of GCE,AgNPs/GCE,PDA/ GCE and PDA@AgNPs/GCE in K3Fe(CN)6 solution
2.6.2 EIS分析
利用EIS可以监测PDA@AgNPs/GCE的制备过程,研究修饰电极界面发生的电子转移和特性,得到相应的Nyquist图谱。高频区半圆的直径代表电子转移阻抗(Rct),其大小反映铁氰化钾等氧化还原探针在电极表面的电子转移动力学特性[24]。由图9可知,与GCE相比,PDA@AgNPs/GCE、AgNPs/GCE和PDA/GCE在高频区半圆的直径及低频区直线与实轴的截距均呈增大趋势,说明AgNPs和PDA均已成功修饰到GCE表面,其过程受动力学和扩散联合控制。
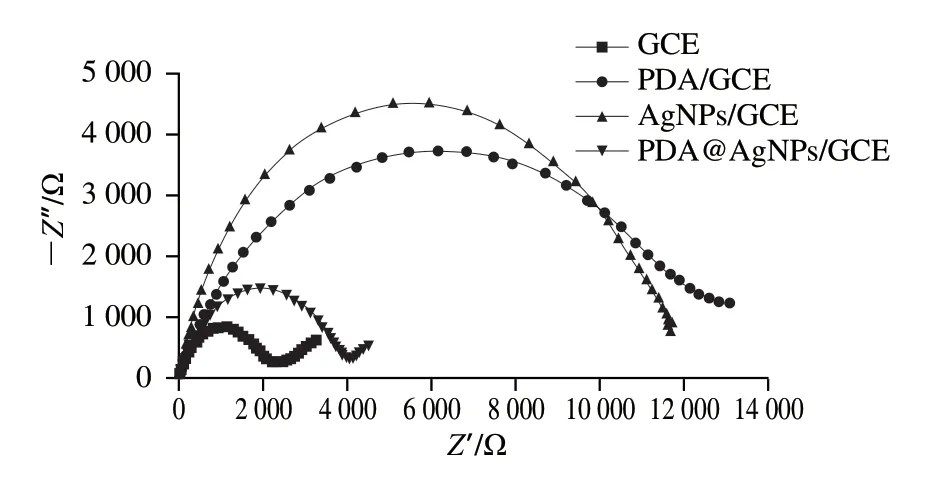
图9 GCE、AgNPs/GCE、PDA/GCE和PDA@AgNPs/GCE在5 mmol/L K3Fe(CN)6溶液中的EIS图Fig.9 EIS patterns of GCE,AgNPs/GCE,PDA/GCE and PDA@AgNPs/GCE in 5 mmol/L K3Fe(CN)6 solution
2.6.3 SEM观察
利用SEM对AgNPs/GCE、PDA/GCE和PDA@AgNPs/GCE三种修饰电极的表面形貌特征进行表征,结果如图10所示。由AgNPs/GCE(图10A)的SEM图可明显地看到球形的AgNPs均匀地分散在电极表面,粒径约为20~40 nm。可能是由于在电极表面形成了比较致密的PDA膜,在PDA/GCE的SEM图(图10B)中没有观察到PDA的膜结构,与文献[25]中PDA膜的SEM表征结果一致。在PDA/GCE的SEM图中可明显看到分布较为均匀的粒径约为80~150 nm的微球。张弘弢等[26]研究表明,DA不仅可以在固体材料表面形成牢固黏附的涂层,还可通过自身组装形成纳米粒子,因此,将GCE置于DA溶液中时,一方面溶液中的DA会形成PDA纳米微球,另一方面DA在GCE表面自聚成膜,同时将PDA纳米微球修饰在电极表面。与AgNPs/GCE(图10A)相比,PDA@AgNPs/GCE(图10C)的SEM图中电极表面的纳米微球的粒径增大,尺寸约为50~100 nm,表明在AgNPs的表面形成了PDA膜,同时AgNPs已经均匀地分散在电极表面。
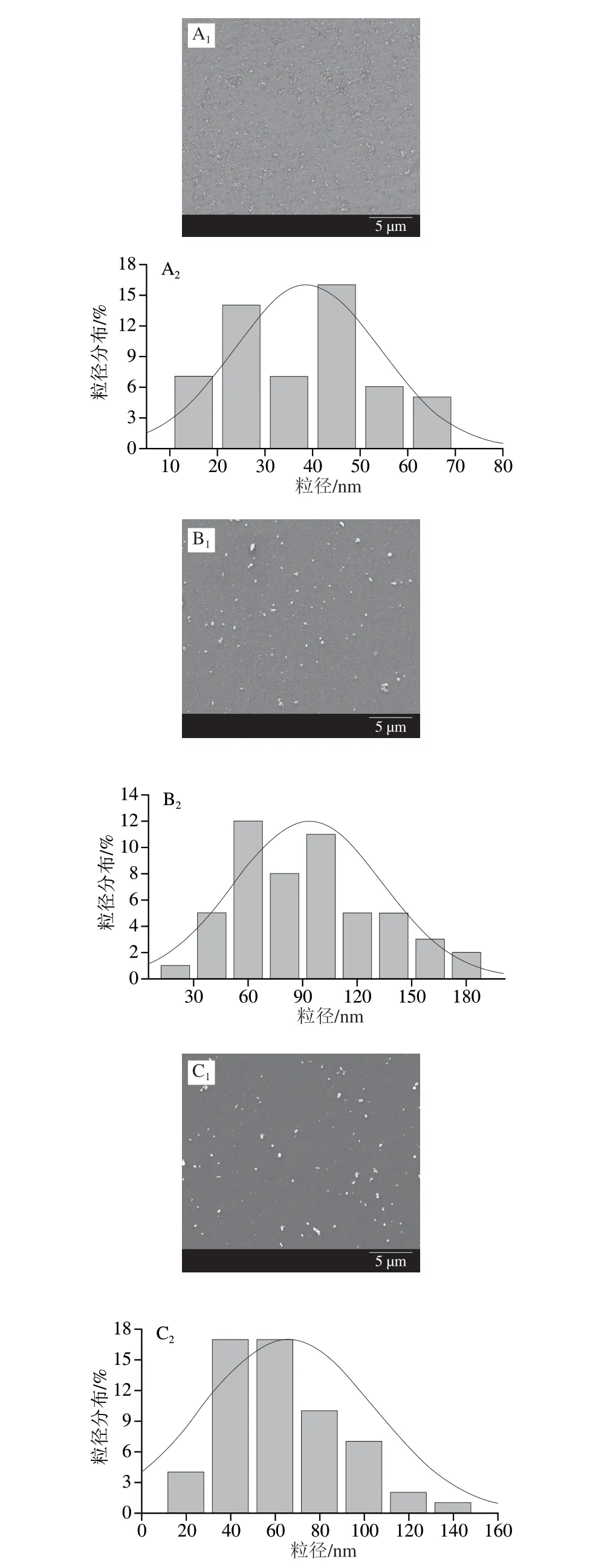
图10 AgNPs/GCE(A)、PDA/ GCE(B)、PDA@AgNPs/GCE(C)修饰电极的扫描电镜图和粒径分布图Fig.10 SEM images and particle size distribution of AgNPs/GCE (A),PDA/GCE (B) and PDA@AgNPs/GCE (C)
2.7 性能测试
2.7.1 重复性
测试重复性:用同一支PDA@AgNPs/GCE对浓度为5×10-6mol/L的CPZ溶液,连续6 次扫描测定,测得CPZ响应电流的相对标准偏差(relative standard deviation,RSD)为5.0%(n=6),表明PDA@AgNPs/GCE有较好的测试重复性。
制作重复性:按照相同条件制备6 支PDA@AgNPs/GCE,记录测定5×10-6mol/L的CPZ溶液的响应电流值,测得CPZ响应电流的RSD为4.8%(n=6),表明PDA@AgNPs/GCE有良好的制作重复性。
2.7.2 稳定性
制备3 支PDA@AgNPs/GCE,第1天测定浓度为5×10-6mol/L的CPZ溶液并记录其峰电流值,然后置于4 ℃冰箱中避光保存7 d,测得CPZ的氧化峰电流值能达到初始值的90.8%,表明PDA@AgNPs/GCE在7 d内稳定性良好。
2.7.3 干扰实验
考察常见化合物和离子对5×10-6mol/L CPZ测定的干扰。100 倍浓度的葡萄糖,50 倍浓度的K+、Na+、Ca2+、Mg2+、Fe3+、Cl-、、均不干扰CPZ的测定;但在考察其他酚噻嗪类药物时发现,相同浓度的异丙嗪和奋乃静均会在CPZ的氧化峰电位附近产生氧化峰,表明该电化学法可对样品中是否含有此类酚噻嗪类药物进行定性分析。当样品中不含有这2 种物质时,该电化学法可准确测定样品中CPZ的含量;如果样品中含有异丙嗪和奋乃静,在样品前处理时需排除才能得到CPZ的准确含量。
2.7.4 线性范围和检出限
在最优条件下,考察不同浓度的C P Z 溶液在PDA@AgNPs/GCE上的电流响应。结果如图11所示,CPZ氧化峰的响应电流值与物质的浓度在5.0×10-8~1.0×10-5m o l/L 范围内呈线性关系,线性方程为I=2.2528C-0.0082(R2=0.991),检出限(RSN=3)为1.7×10-8mol/L。对文献报道的CPZ电化学检测方法进行比较,如表1所示,与其他方法相比,本SWV法修饰材料的制备条件温和、简单价廉,传感器的制备时间短,检出限较低。
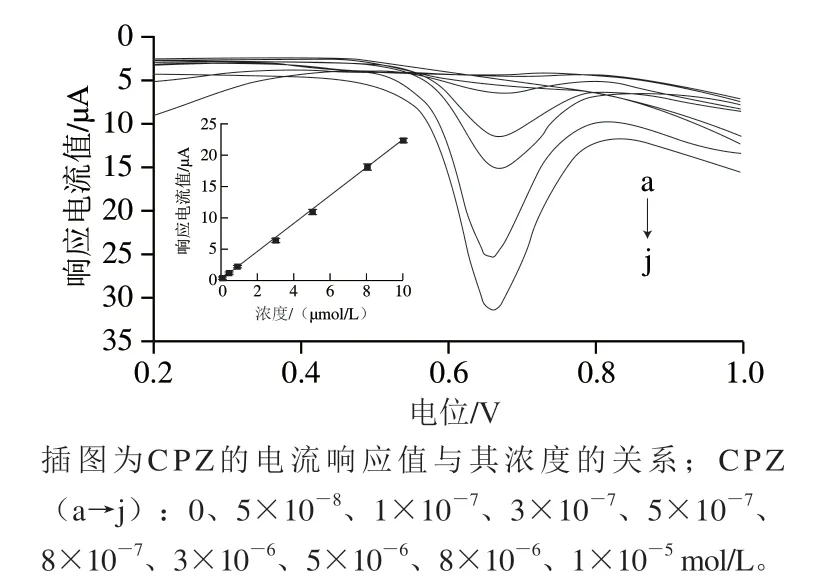
图11 PDA@AgNPs/GCE在不同浓度CPZ溶液中的SWV图Fig.11 SWV plots of PDA@AgNPs/GCE in CPZ solutions of different concentrations
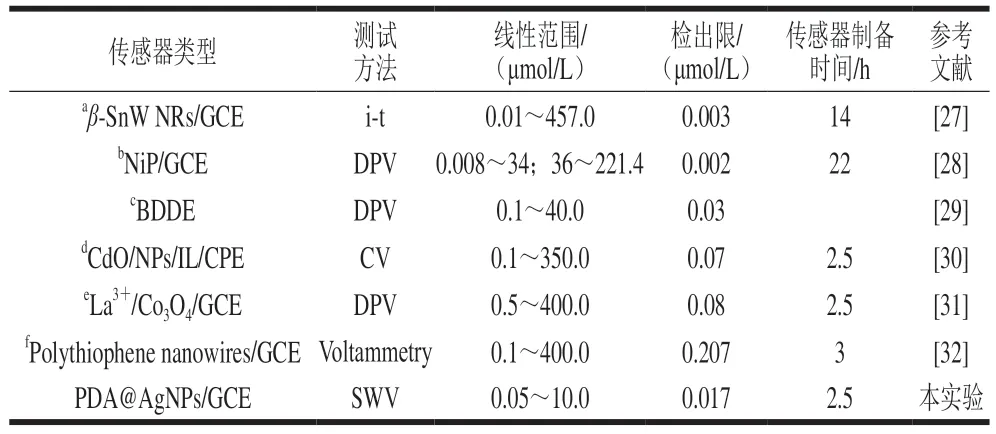
表1 CPZ电化学测定方法的比较Table 1 Comparation of different electrochemical sensors for CPZ detection
2.8 样品分析与回收率的测定
取购于超市的猪肉、鸡肉、牛肉样品,按照1.3.3节进行前处理,在最优条件下利用SWV法进行检测。结果发现样品溶液均未出现CPZ的特征氧化峰,表明所测样品均不含CPZ。在以上各样品中分别添加低、中、高3 个不同浓度的CPZ标准溶液,并用色谱方法进行验证,结果如表2所示。猪肉、鸡肉、牛肉样品的加标回收率分别为84.9%~88.8%、79.8%~93.8%、80.6%~93.9%,RSD分别为4.0%~6.9%、1.9%~5.1%、3.9%~6.4%。根据GB/T 20763—2006《猪肾和肌肉组织中乙酰丙嗪、氯丙嗪、氟哌啶醇、丙酰二甲氨基丙吩噻嗪、甲苯噻嗪、阿扎哌隆、阿扎哌醇、咔唑心安残留量的测定 液相色谱-串联质谱法》中液相色谱-质谱联用法对以上3 种畜禽肉中CPZ进行测定,结果与该电化学方法的测定结果一致,表明该电化学法具有良好的准确度和可信度。
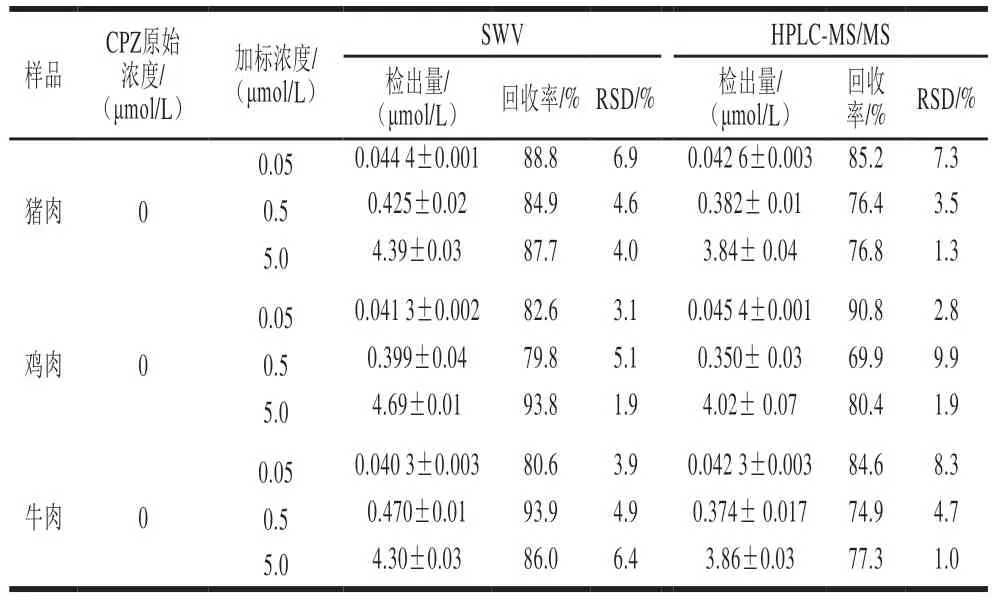
表2 畜禽肉中CPZ回收率测试结果Table 2 Recoveries of chlorpromazine in spiked livestock and poultry meat
3 结论
基于DA的自聚反应在AgNPs和GCE表面形成PDA膜,使AgNPs均匀分散在GCE表面,形成稳定的复合修饰电极(PDA@AgNPs/GCE),建立了一种测定CPZ含量的SWV检测方法。为了达到最佳测定效果,对电极修饰材料和修饰方法、CPZ的电化学测定方法及条件进行优化,通过CV法、交流阻抗法和SEM对PDA@AgNPs/GCE进行表征,并对3 种畜禽肉中CPZ的残留量进行测定。结果显示,PDA@AgNPs/GCE具有良好的测试性能,且该修饰电极的制备方法简单、便于批量制备,可用于畜禽肉中CPZ含量的检测。

