牛乳蛋白生物脱敏技术研究进展
刘一璇,鲁丁强,刘丹阳,王新倩,刘玉姣,胡志和
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
0 引言
牛乳是人体优质蛋白的良好来源,但同时也是FAO及WHO认定的世界八大过敏食物之一[1-2]。约2%~7.5%的新生婴儿存在牛乳过敏的问题,其中绝大多数在3~4岁时不再出现过敏症状,但有些个体的过敏反应会一直存在[3]。对于不同学者的研究,牛乳患病率存在较大差异,这可能是由于研究人群的年龄、地理差异及研究方法的不同造成的[4]。目前解决该问题只能避免摄入,医学上采用口腔食物激发试验(Oral food challenge,OFC)为牛乳过敏患者检测,提供避免摄入的依据。相关研究认为该检测有一定的作用,但准确性不能保证,存在牛乳过敏患者OFC呈阴性的情况[5]。通过不同加工工艺处理以降低甚至消除牛乳致敏能力,是有前景的研究方向。通常用于牛乳消敏(牛乳消敏)的加工工艺被分为物理法、化学法和生物法。其中生物法不仅可以改变牛乳蛋白的构象表位也可以改变其线性表位,是更有前景的降敏方法。本文将介绍生物酶法、发酵作用和转基因技术3种生物降敏法的研究现状,旨在为之后的相关研究提供参考。
1 牛乳蛋白致敏机理
食物过敏的患者主要通过胃肠道、口腔、呼吸道及皮肤接触过敏原,从而引发过敏反应。人们普遍认为,大多数患者通过肠道使个体敏感,这是因为肠道内的菌群失衡可以影响免疫耐受[6]。牛乳在人体内的过敏反应主要分为IgE介导的Ⅰ型超敏反应(又称速发型超敏反应)、非IgE介导的过敏反应及IgE和非IgE相结合的免疫反应。虽然目前尚不清楚总食物过敏人口中由IgE介导引起食物过敏的人口水平[7],但其反应机制更明确,分为致敏阶段、激发阶段和过敏阶段。
致敏阶段是指过敏机体的相关作用被破坏从而使食物过敏源的信息传递到T淋巴细胞上,T淋巴细胞随之分化为Th2细胞从而在体内引起细胞免疫,产生IgE抗体[8]。IgE抗体与过敏原结合形成的免疫复合物与消炎细胞结合使机体致敏。激发阶段即同一抗原再次进入人体,消炎细胞表面的IgE抗体快速识别抗原并与之结合,使得消炎细胞脱颗粒。效应阶段就是激发阶段作用于各效应组织和器官,使得人体出现麻疹、湿疹、呕吐、腹泻等各种症状[9]。
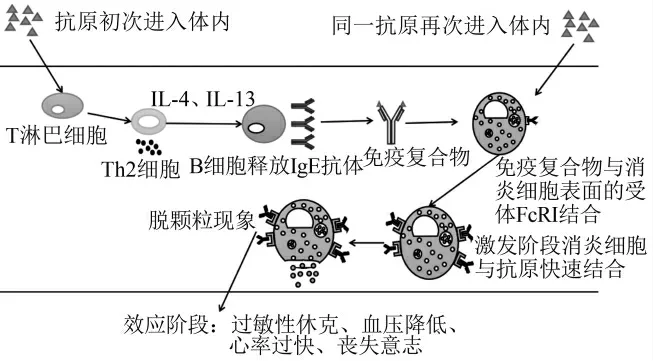
图1 IgE介导的Ⅰ型超敏反应机制
2 牛乳致敏蛋白及其表位
牛乳蛋白可以分为酪蛋白和乳清蛋白。酪蛋白占总蛋白质的80%,可分为αs1-酪蛋白(αs1-casein,αs1-CN)、αs2-酪蛋白(αs2-casein,αs2-CN)、β-酪蛋白(β-casein,β-CN)和κ-酪蛋白(κ-casein,κ-CN),前3种酪蛋白以较为稳定的半球形内核形状存在,κ-酪蛋白在最外层形成“毛发层”进行包裹。乳清蛋白占总蛋白质的20%,包括α-乳白蛋白(α-Lactalbumin,α-LA)、β-乳球蛋白(β-Lactoglobulin,β-LG)、乳铁蛋白、牛血清白蛋白(Bovine Serum Albumin,BSA)和牛免疫球蛋白(Bovine immunoglobulin,LGS)[10]等。普遍认为α-LA、β-LG的致敏性更高。
2.1 酪蛋白
2.1.1 αs1-CN
αs1-CN由199个氨基酸残基组成,占总酪蛋白含量的40%。它广泛存在于哺乳动物乳汁中,但在人乳中不含有,是一种高度磷酸化蛋白。并具有2种常见的磷酸化状态,其中大部分情况下含有8个磷酸基团(αs1-CN-8P),少部分含有9个磷酸基团(αs1-CN-9P)。这两种不同的状态是由其基因决定的。
αs1-CN致敏的线性表位,Spuergin等[11]早在1996年就通过纤维素衍生膜上合成法研究鉴别了3个IgG和IgE共同的表位,但未发现结合IgG和IgE的特异性表位。Chatchatee等[12]在2001年通过纤维素衍生膜上合成法研究鉴别了6个IgE主要表位、3个次要表位和5个IgG主要表位、1个次要表位,为1-10。其中表位69-78和173-194可以被大多数年龄组的患者识别过敏,考虑作为检测个体是否患有牛乳过敏的识别表位。Cerecedo等[13]在2008年通过肽微阵列分析法研究鉴别了1个IgE线性表位。Cong等[14]在2012年通过丙氨酸扫描分析鉴定了4个IgE表位和3个IgG表位。范安妮[15]等在2016年通过IEDB数据库预测了10个B细胞表位。表1中详细列举了这些表位及其检测方法。
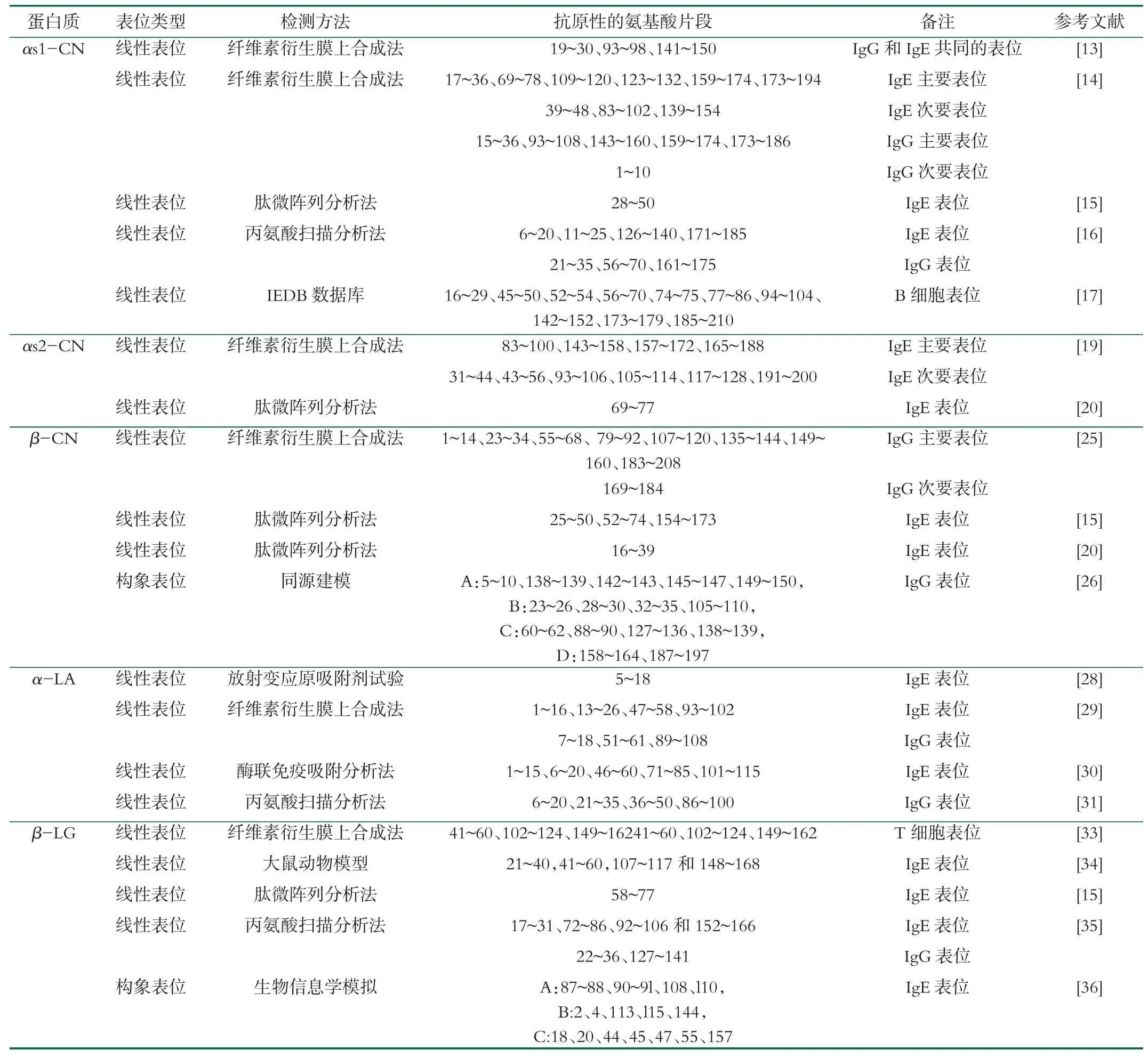
表1 牛奶蛋白的抗原表位
2.1.2 αs2-CN
αs2-CN由209个氨基酸残基组成,占总酪蛋白含量的10%。人乳中不含有。与αs1-CN一样具有高度磷酸化。牛乳中的αs2-CN有A、B、C、D 4种基因变异体,它们具有一致的氨基酸序列,不同的磷酸化程度,不同变异体的分子中分别含有10~13个磷酸基[16]。
αs2-CN致敏的线性表位,Busse等[17]在2002年鉴别了4个IgE主要表位和6个IgE次要表位。Jing Lin等[18]在2009年通过肽微阵列分析法研究鉴别了1个新的IgE线性表位,为69~77。此外,该研究鉴定的表位与前人通过SPOT膜技术鉴定的表位基本一致,确定了肽微阵列分析法鉴定蛋白质致敏表位的可靠性。
2.1.3 β-CN
β-CN由226个氨基酸残基组成,在牛乳中占总酪蛋白含量的35%。三级结构是紧密排列的折叠结构,因其富含脯氨酸而限制了更高级的有序结构。牛乳中的β-CN有13种遗传变异型,其中最常见的是A1型和A2型[19]。A2型在奶牛杂交中具有优势[20]。目前认为A2型为牛乳β-CN的原始形态,A1型是由A2型的第67个氨基酸脯氨酸突变为组氨酸而产生的。A1型β-CN在人体内消化过程中会产生生物活性物质β-酪啡肽(BCM-7),该物质对人体健康的影响具有争议性。有研究认为它会导致人体患动脉粥样硬化[21]、心血管疾病和Ⅰ型糖尿病[22]等疾病的几率增大。
β-CN致敏的线性表位,Chatchatee等[23]通过纤维素衍生膜上合成法研究鉴别了8个主要IgG表位和1个次要IgG表位。Cerecedo等[15]在2008年研究通过肽微阵列分析法鉴别了3个可能的线性表位。Jing Lin等[20]在2009年同样通过肽微阵列分析法研究鉴别了1个新的线性表位,为16~39。刘法辉[24]在2011年利用同源建模、折叠识别法建模、从头预测方法构建出β-CN构象模型并鉴别了4个IgG构象表位。
2.2 α-LA
α-LA由123个氨基酸残基组成,在牛乳中约占乳清蛋白的25%,是牛乳清中第二丰富的蛋白质。牛乳中的α-LA有a和b两种遗传变异体,在西方奶牛中均以a型为主。α-LA可以用于制药工业和功能性食品的制备。常常通过膜分离等技术从乳清蛋白中分离出来后,作为具有抗癌、抗菌、抗病毒等作用的良好生物活性肽使用[25]。
α-LA致敏的线性表位,Adams等[26]在1991年通过放射变应原吸附剂试验(RAST)研究鉴别了1个IgE表位。Jrvinen等[27]在2001年通过纤维素衍生膜上合成法研究鉴别了4个IgE表位和3个IgG表位。丛艳君等在2017年通过酶联免疫吸附分析法研究鉴别了5个IgE表位[28]并在2018年通过丙氨酸免疫表位扫描技术研究鉴别了4个IgG表位[29]。
2.3 β-LG
β-LG由162个氨基酸残基组成,在牛乳清中占主要地位并且含量较高,约占乳清蛋白的50%。牛乳中的β-LG有A、B、C 3种遗传变异体,主要存在的是A型和B型。天然的β-LG在胃中不易被消化。
β-LG致敏的线性表位,Tsuji等[30]早在1993年就研究鉴别了3个T细胞表位。Miller等[31]在1999年通过棕色挪威大鼠动物模型,鉴别了4个IgE表位和5个IgG表位。该实验步骤为使批标准化(BN)大鼠模型在有角叉菜胶佐剂的情况下,通过腹膜内途径暴露β-乳球蛋白,之后再使用乙酰胆碱酯酶底物直接进行酶免疫测定。该研究也证明了BN大鼠和人类的免疫系统对分子或肽水平上的牛乳蛋白抗原性表位具有相似的识别能力。Cerecedo等[15]在2008年研究鉴别了1个线性表位。Cong等[32]在2012年通过丙氨酸扫描分析鉴定了4个IgE表位和2个IgG表位。其中IgE结合表位的关键氨基酸是Thr20、Met23和Asp27,IgG结合表位的关键氨基酸是Leu26和Val31。武涌[33]在2012年通过生物信息学模拟出了3个构象性表位,分别是A:87-88、90-9l、108、l10,B:2、4、113、l15、144,C:18、20、44、45、47、55、157,其可信度由大到小依次为A、B、C。
3 生物法降低致敏性
3.1 生物酶法
自1833年世界上第一种酶被发现,其就作为商品进入了人类的视野。在全世界工业用酶中,食品用酶约占31%。酶制剂发展的早期,多数种类的酶是从动物或者植物原料中提取的,随着食品酶学的发展,目前微生物发酵产生的酶在工业用酶中占据主要地位。在食品领域中,利用各种酶进行加工生产以制造所需产品仍然是目前重要的研究方向之一。在已有的研究中已证明使用酶处理可以不同程度的破坏牛乳致敏蛋白的构象表位和线性表位以达到牛乳脱敏的功效,但未能找到一种酶制剂可以完全达到脱敏效果以适用于牛乳过敏人群食用。因此,寻找合适的酶仍然为目前牛乳降敏的可行研究途径。
3.1.1 酶法消敏原理
酶处理消敏的原理是破坏蛋白质致敏表位,一般有3种情况:第一种是酶水解特异性氨基酸位点,使蛋白质分子结构改变从而破坏构象表位;第二种是通过一些物理手段处理后,蛋白质三、四级结构被破坏,构象表位也随之改变,同时线性表位暴露出来,此时酶处理可水解破坏蛋白质线性表位并降低分子量大小;第三种是酶的交联作用,其可以改变蛋白质的构象表位并覆盖其线性表位。交联酶与牛乳蛋白中特定的氨基酸残基作用,形成分子内或分子间共价键从而诱导蛋白质交联,不同种交联酶的作用位置和反应机制各不相同[34]。
Abd El-Salam等[35]将常见的酶法消敏按照所用酶形式的不同可以分为直接酶水解、直接酶交联、固定化酶和酶膜反应器。其中直接酶水解和直接酶交联实验原理、过程最为简单,即将水解酶或交联酶直接与待测样品混合,在其最佳反应条件下充分反应。直接酶水解在反应完全后,还可以通过加热使酶失活而结束反应并通过超滤等手段分离样品中未水解完全的大分子肽段以控制乳制品的低敏性。固定化酶即将目标酶固定在不溶性载体上(吸附法、包埋法、结合法、交联法等),控制其自由流动后在最佳反应条件下加入待测样品中搅拌一段时间,反应结束后通过过滤将酶与样品分离;或者通过控制待测样溶液的流速和温度,使其流过固定化酶进行反应,该方法反应结束后不再需要将酶与样品进行分离[5]。酶膜反应器的使用可以实现连续反应、分离混合物中产物、避免酶固定化的困难等优点,其中低分子量物质通过膜渗透,高分子量物质被阻截,但其也存在膜污染等缺点[36]。
3.1.2 酶法消敏研究
目前已有大量酶在牛乳消敏加工工艺中被研究认为可降低牛乳致敏性,部分酶已经可以达到工业化生产的要求。酶法降敏工艺的研究多采用单酶水解牛乳蛋白和多酶复合水解牛乳蛋白,所用的酶根据其来源可分为植物蛋白酶(木瓜蛋白酶、菠萝蛋白酶)、动物蛋白酶(胰蛋白酶、胃蛋白酶)和微生物蛋白酶(枯草杆菌蛋白酶)。表2列举了酶法消敏的相关研究。
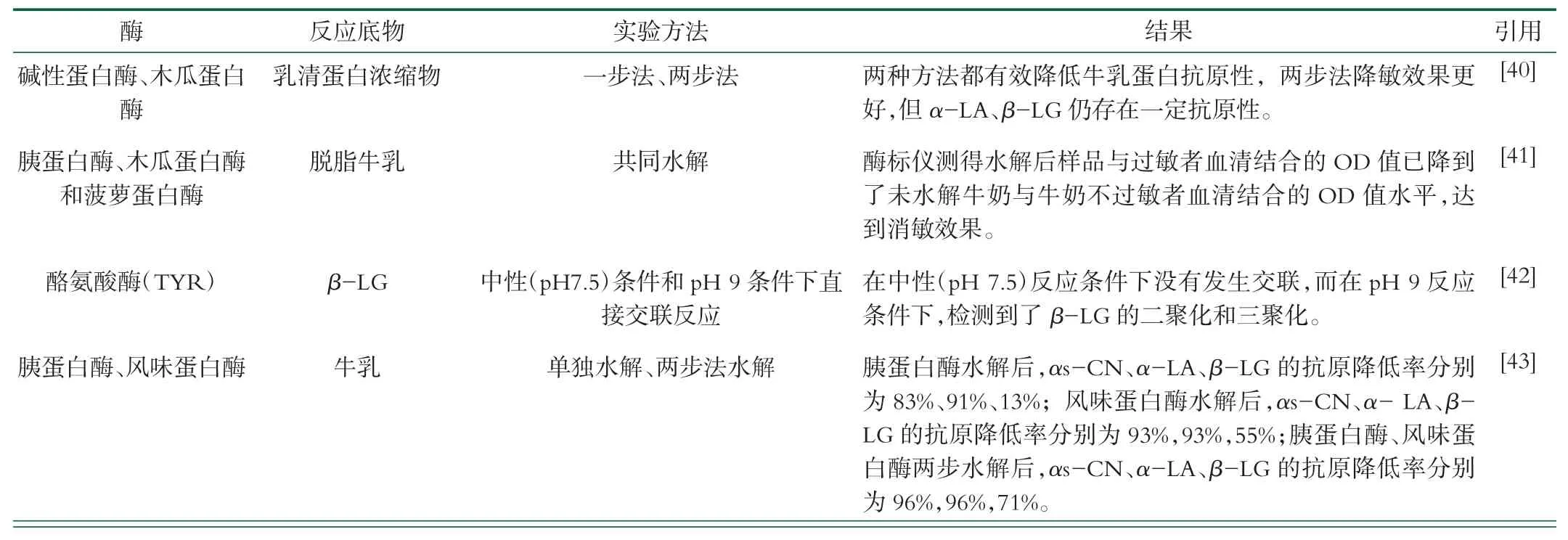
表2 酶法消敏的相关研究
相对于各种水解酶在该领域的研究,交联酶的研究略少,但其更具有前景。其原理是蛋白质分子间或分子内共价交联,既可能通过改变蛋白质结构而改变其构象表位,也可能是交联后的表位被遮盖而无法表现出抗原性。Karaki N[37]认为可以交联消敏的4种主要酶为漆酶(Laccase,LAC)、酪氨酸酶(Tyrosinase,TYR)、过氧化物酶(Peroxidase,POD)和谷氨酰胺转氨酶(Glutamine transaminases,TG)[37]。TG酶是通过催化蛋白质分子间或分子内的酰基转移而使蛋白质交联的,是其中唯一可以应用于商业的食品级蛋白质酶[45]。可能是基于此原因,相关研究较为充分[46,50]。与TG酶相比,其余3种酶的相关研究较少[45]。LAC酶可以通过单电子去除机制催化蛋白质中酚类(常见于酪氨酸侧链)的氧化反应[38],其氧化产物苯醌可以发生聚合或与自由芳香基聚合,从而使蛋白质交联。TYR酶可以将单酚羟基化为二酚,二酚可进一步氧化为具有高度反应性的二醌,而二醌可与自身或其它不同集团发生非酶反应,以此建立分子间或分子内交联。由于都对催化酚类物质的氧化反应有作用,TYR酶与LAC酶也被合称为多酚氧化酶[39]。POD酶可以与酪氨酸残基反应,其反应物进一步与酚类、巯基等反应形成交联物质。另外,酶的固定化是酶工程中重要的一项技术,但其对低敏乳制品的作用能力取决于被固定的酶在该方面的能力,因此相关研究的商业意义更大。
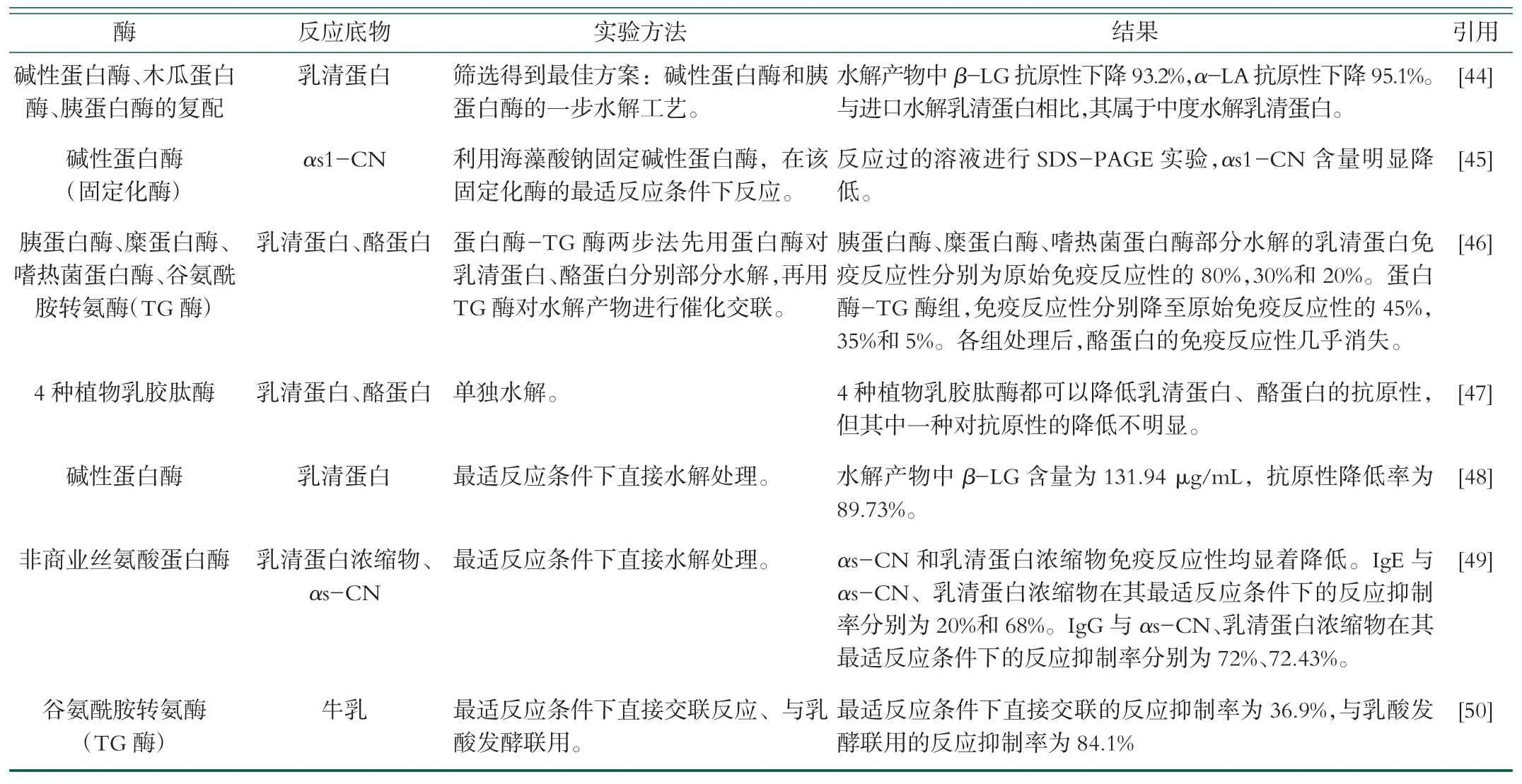
(续表2)
3.2 发酵作用
近些年来,益生菌的作用逐渐被人们重视。有研究表明,肠道内益生菌对于预防和治疗人体口腔健康[51]、糖尿病[5]和直肠癌[52]等多种疾病具有一定的作用。作为一种益生菌,乳酸菌发酵处理是牛奶加工中一种常见且重要的加工工艺。在无氧条件下,牛奶中天然存在和人工添加的乳酸菌分解乳糖,产生大量乳酸,使体系p H值下降至酪蛋白等电点(p H 4.6)附近,酪蛋白聚集沉淀,牛奶变为固态酸奶产生。可用于酸奶发酵的乳酸菌种种类繁多,其中嗜热链球菌、保加利亚乳杆菌是发酵的常规菌种[53]。
3.2.1 发酵消敏机制
不同菌株的作用特点不同,工业生产中往往使用多种菌株同时发酵,可以使酸奶具有单独使用一种菌株所无法达到的品质。这一过程通常也伴随着牛乳致敏性的降低,其可能机制分为乳酸菌调节Th1/Th2细胞平衡、乳酸菌发酵产生的蛋白酶水解牛乳致敏蛋白表位两种。第一种机制是由Matsuzaki等[54]研究发现的,该研究表明益生菌可以通过增加丁酸盐的产生和机体对IL-4、IL-10、IFN-γ、Treg、TGF-β等细胞因子的诱导耐受性,降低血清嗜酸性粒细胞水平和基质金属蛋白酶-9(MMP-9)的表达等方式从而增进Th1型免疫反应来调控因过敏而反应过度的Th2型免疫反应。也就是说乳酸菌本身可以调节人体肠道菌群平衡,从而降低机体对牛乳的敏感程度[9]。第二种机制的相关研究较为丰富。乳酸菌无法直接利用外源蛋白质为菌体提供营养,但具有复杂的蛋白水解系统,由胞膜蛋白酶(CEP)、肽酶和肽转运系统组成[55]。该过程是CEP将外源蛋白质水解为多肽,肽转运系统将多肽转运到乳酸菌细胞内,胞内的肽酶随之将其水解为可被自身利用的游离氨基酸[56]。CEP是大分子酶,存在于在细菌表面,具有水解αs1-酪蛋白、β-酪蛋白的能力,但目前对CEP编码基因表达的调控知之甚少[57]。另外,益生菌也是肠道黏膜的重要组成部分,在肠道免疫中发挥作用。这也解释了前面提到的牛乳过敏在婴幼儿中的发病率高,而大部分的过敏症状在儿童时期消失[4]。婴幼儿(尤其是早产儿和剖宫产新生儿)的肠道系统发育不足,肠道内有益菌的含量少,因此无法消化牛乳蛋白而导致免疫反应。
3.2.2 发酵消敏研究
发酵是目前认为在研发低敏乳制品时,一种对产品品质有益处的处理手段。尽管在理论上,发酵消敏时小肽段和游离氨基酸的产生会使产品呈苦味,但目前市售的酸奶滋味可以被消费者广泛接受。这一现象的可能原因是,在人体内乳酸菌发酵产生的蛋白酶水解程度不高。伍恒[58]等也认为对于广泛的乳酸菌菌株,其发酵后牛乳产品的抗原性普遍下降,但没有被消除。另外,其在体内的抗原性降低程度不高。
李艾黎等[59]使用发酵乳杆菌处理牛乳后,通过酶联免疫分析技术(enzyme linked immunosorbent assay,ELISA)检测食用样品小鼠的细胞上清液中Th1型细胞因子(IL-12、IFN-γ)和Th2型细胞因子(IL-4)的水平,发现乳杆菌发酵可能通过增进Th1型免疫反应来改善小鼠β-LG的过敏情况。M.Pescuma等[60]使用保加利亚乳杆菌处理β-LG后进行小鼠实验,发现该菌株处理后的牛乳喂养小鼠,其血清内IgE与β-LG的结合程度下降,Th1型细胞因子含量升高,认为该株菌株对降低乳制品致敏性,维持肠道Th1/Th2平衡有益。Ahmadova A等[61]使用瑞士乳杆菌作用于酪蛋白,之后通过ELISA检测发现,发酵后样品与IgE结合的能力降低。Lina Zhao[62]等采用ELISA和液相色谱质谱联用法对helveticus KLDS 1.8701、plantarum KLDS 1.0386两株乳酸菌联合发酵脱脂乳蛋白的抗原性进行评价,结果发现联合发酵过程可通过在α-酪蛋白上结合CEP和肽酶来降低牛奶蛋白的致敏性。随着研究的深入,目前发现一些非乳酸菌处理也可以降低食物致敏性,如Meinlschmidt[63]等研究表明,液态发酵菌(枯草芽孢杆菌、米根瘤菌、酿酒酵母、海尔维酸乳杆菌)对大豆分离蛋白的免疫反应性、理化和感觉特性均产生影响。
3.3 转基因技术
转基因技术即改变奶牛基因以获得低敏牛奶的技术,它被称为“人类历史上应用最为迅速的重大技术之一”并很快应用于畜产、食品领域,但大众对于转基因食品的消费仍持观望态度[64]。或许基于这些原因,国内外的相关研究较少,但不可否认的是其目前仍然为一种可降低牛乳致敏性的研究方向。
牛乳蛋白脱敏可以通过改变致敏蛋白线性结构,即对蛋白线性表位的氨基酸进行突变、转基因而达到目的。Totsuka等[65]通过将β-LG的一个免疫显性决定簇(AA119-133)转基因为TCR拮抗剂肽抑制了T细胞的增殖。Taheri-Kafrani等[66]利用转基因技术,将β-LG位于86的丙氨基酸转化为谷氨酰胺,结果突变后该表位与IgE结合较弱。其在另一研究中,将β-LG位于69的赖氨酸转化为天冬酰胺,结果突变后与患者血清中IgE结合的亲和力减弱了9倍,IgG的结合力与突变前相比没有差异[67]。
除此以外,控制致敏蛋白的合成模板以降低其浓度也可以在一定程度上达到牛乳蛋白脱敏的目的。但是,Song等[68]研究发现羊乳中的αs1-CN与β-CN含量之间呈Pearson负相关,即随着αs1-CN合成模板CSN 1S1丰度的降低,αs1-CN含量降低,但同时合成β-CN的mRNA丰度升高,β-CN含量升高。这一现象也符合Th细胞的刚性调节现象,即体内Th1细胞含量高于正常值时会抑制Th2细胞的含量,相反Th2细胞含量高于正常值时也会抑制Th1细胞的含量。
3.4 多种加工方式共同处理
通常情况下酶处理、物理手段与发酵,其中两者或三者共同作用,对降低牛乳致敏性比单一手段处理作用更显著。这可能是因为不同处理方式的作用原理不同。如超高压的降敏原理是使蛋白质去折叠,破坏构象表位而同时暴露了之前被覆盖的线性表位[69],此时水解酶共同处理就能更好的水解其线性表位,不受蛋白质多级构象的干扰。Ambrosi V等[70]的实验证明了这一点。在超高压条件下,用胰蛋白酶和菠萝蛋白酶处理乳清蛋白浓缩物,结果表明共同处理效果显著增加。Lozano-O等[71]研究也表明胃蛋白酶在400 MPa高压下可以水解乳清蛋白为小分子肽链,这些肽链抗原性低并符合低敏乳制品的相关要求,即水解酶与高压共同处理可有效降低乳清蛋白抗原性。另外,Quintieri等[72]研究证实了胃蛋白酶与超滤共同作用可减弱β-LG的抗原性。Abd El-Salam[73]等研究表明,水解酶和乳酸菌发酵两种处理方式均可造成牛乳蛋白抗原性不同程度的降低,其共同作用也可以降低牛乳抗原性。Pi X[74]等在总结发酵缓解食物过敏的最新进展时提出:混合菌株发酵结合热处理、脉冲光和超声波等加工手段,可有效的降低各种食物的过敏性并保持其营养成分和独特的味道,对过敏食品的加工具有意义。
4 过敏原检测方法
4.1 聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)
PAGE是一种用于分离蛋白质和寡核苷酸的实验方法,根据凝胶中是否添加变性剂(Sodium dodecyl sulfate,SDS),可分类为非变性聚丙烯酰胺凝胶电泳(Non denaturing polyacrylamide gel electrophoresis,Native-PAGE)和变形聚丙烯酰胺凝胶电泳(SDSPAGE)。其不能检测致敏性,但可以定性分离出特定蛋白,并通过条带宽度半定量出各种蛋白的含量。由于牛乳蛋白在牛奶体系中以不同种形式存在,尤其是β-LG常与αs1-CN、αs2-CN形成聚合物,其自身也会形成二聚体。而这些聚合物都是由二硫键连接的,因此Native-PAGE与SDS-PAGE同时检测时,可以评估该体系中二聚体的含量[75]。
4.2 生物传感器
生物传感器被认为是一种区别于食物过敏源传统检测方法(实时荧光定量PCR、免疫印迹、高效液相色谱等)的新兴检测手段。它具有分析快、成本低、准确度高、专一性强等优点。但生物传感器电极的制备较繁琐,抗体结合电极后易失活,因此当样本制备不当时结果可能会出现假阳性或者假阴性[76]。当抗体失活,识别元件无法与待测物结合,即出现假阴结果;当待测物样品受污染时,生物传感器就可能出现假阳结果。光学生物传感器与电化学生物传感器常被用来检测牛奶蛋白抗原性[77-78]。
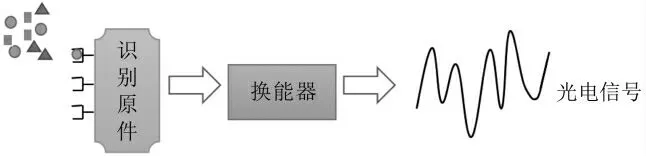
图2 生物传感器工作原理
4.3 酶联免疫分析技术(ELISA)
ELISA的原理是待测物(抗体或抗原)可以与抗原或抗体特异性反应,其结合形成的底物与标记酶产生颜色反应,根据产生颜色的吸光度,定量检测底物。在常见的牛乳过敏原ELISA检测中双抗体夹心法和间接法使用较多,近年来商品化的ELISA试剂盒体系已经比较完整,因此目前ELISA实验多通过试剂盒进行。Zhang[79]等使用商品化特异性ELISA试剂盒检测了超声-离子液体联合预处理对乳清蛋白酶解产物致敏性的影响,发现超声-离子液体联合预处理可以有效降低酶解产物致敏性。Liang[80]等使用竞争性ELISA试剂盒检测了水解酶对牛乳致敏性的降低程度。
4.4 圆二色光谱(Circular Dichroism,CD)
CD的检测原理是根据多肽及蛋白质内光活性生色基团对左、右平面圆偏振光吸收的不同,以鉴定其存在于分子中的二级结构(螺旋、折叠、转角)[81]。目前普遍认为CD对α-螺旋含量的检测可靠性高,但对β-折叠含量的估计存在一定误差[82],因此Micsonai等[83]使用BeStSel方法修正CD的检测误差,该方法提供关于β-折叠的方向等额外信息,可以更准确的预测CD光谱。
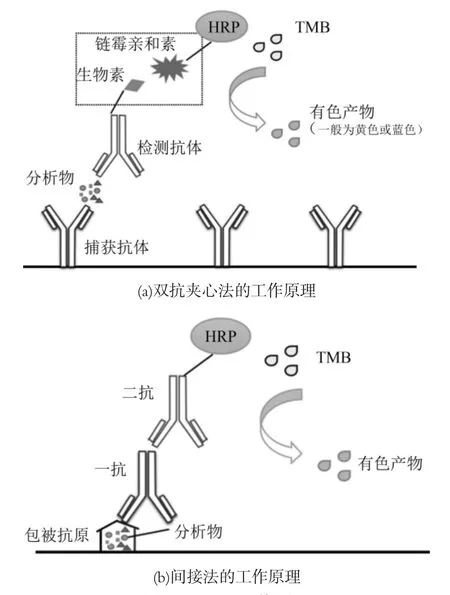
图3 ELISA工作原理
5 结论与展望
综上所述,由于生物酶法、发酵作用和转基因技术对于降低牛乳致敏性的机制及特性不同,且其各自作用时都显示出了明显的脱敏作用。另外,多种加工手段联合使用也是一种具有前景的思路,本文列举了相关研究,但生产出的低敏乳制品均达不到可供所有牛乳过敏患者食用的水平。现阶段研究中,乳制品致敏蛋白基本确定、致敏表位研究更加完善、配方奶粉种类更加丰富,但是,牛乳致敏相关研究中仍存在一定困难和不足。如除IgE介导的Ⅰ型超敏反应外,其他牛乳致敏机理不明确;致敏蛋白种类多且不同加工处理对蛋白质的高级结构变化具有随机性;患者过敏程度不同所需的低敏乳制品程度也不同等。这些问题的研究,也许可以为未来低敏乳制品的加工提供新的方向。

