RBP、miR-126、Sirt1在急性脑梗死中的表达及与颈动脉粥样硬化斑块稳定性的相关性
刘梓宸 ,李克娇*,畅 莎,宋 雪,李 芳
(1.河北省廊坊市第四人民医院神经内二科,河北 廊坊 065700;2.河北省廊坊市第四人民医院检验科,河北 廊坊 065700)
急性脑梗死指脑动脉血管粥样硬化形成斑块,脱落后阻塞血管、血流中断或减少引起的脑组织坏死,是临床常见的脑血管疾病[1-3],近年来其发病率呈增加趋势,该病致残率及致死率高,严重影响患者的生活和生命安全[4]。研究指出,高血压、高血脂、高血糖等是急性脑梗死、颈动脉粥样硬化斑块的影响因素,其参与急性脑梗死的病情进展[5]。因而,发掘与斑块稳定性有关的标志物对急性脑梗死的诊断、治疗及评估具有重要意义。相关研究指出,血清视黄醇结合蛋白(retinol binding protein,RBP)、微小核糖核酸126(microRNA-126,miR-126)及沉默信息调节因子1(silent information regulator 1,Sirt1)与颈动脉粥样硬化斑块的稳定性存在关联,并且在急性脑梗死的发生发展中发挥作用[6-8]。本研究旨在探索急性脑梗死患者血清RBP、miR-126、Sirt1水平变化,并分析其水平变化与颈动脉粥样硬化斑块稳定性的相关性,为急性脑梗死的诊断及治疗、评估提供新思路。
1 资料与方法
1.1一般资料 选取2020年5月—2021年7月来我院就诊的急性脑梗死患者140例为病例组,另选同期健康体检者60例为对照组,病例组患者行彩色多普勒超声检查,据超声结果分为稳定斑块组(n=78)和不稳定斑块组(n=62)。纳入标准:①患者经CT、MRI检查且符合急性脑梗死诊断标准[9];②发病24 h内入院;③精神状态良好能正常配合研究;④患者临床资料完整;⑤患者及其家属均知情同意。排除标准:①心血管疾病者;②癌症患者;③免疫系统疾病。病例组、对照组一般资料差异无统计学意义(P>0.05),具有可比性,见表1。
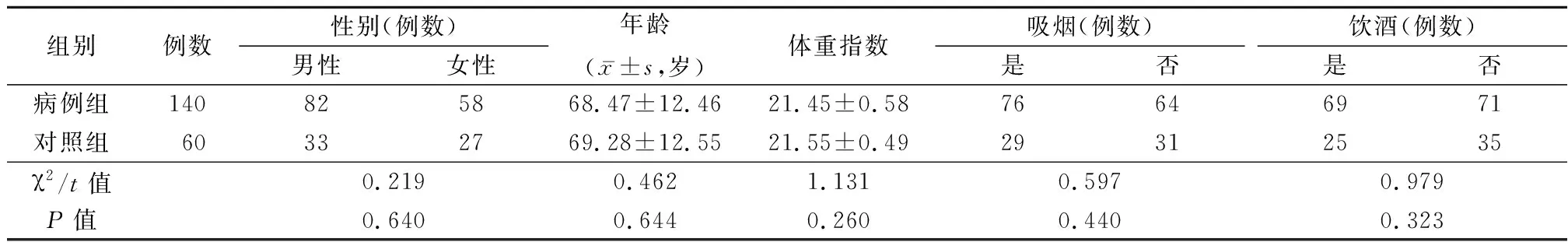
表1 2组研究对象一般资料比较Table 1 Comparison of general data of study subjects between two groups
本研究经医院伦理委员会批准,且患者及家属均签署知情同意书。
1.2方法
1.2.1颈动脉超声检查 采用美国GE-LOGZQ5彩色多普勒超声诊断仪,探头频率7.5~12 MHz。患者取平卧位,于肩下垫软枕,将头部偏向一侧,充分暴露颈部,观察颈动脉内膜结构、光滑程度、增厚情况、斑块形态、位置、大小、内部回声、血流等情况,测量双侧颈动脉和分叉处及颅外段颈动脉内中膜厚度,取平均值为最终颈动脉内中膜厚度[10]。
1.2.2MRI检测 采用荷兰皇家Philips Achieva TX3.0T MR成像系统,32通道高分辨头颅线圈,对血管定位,确定血管分叉处,在颈动脉分叉处分别向上、下各扩展1.6 cm行横断扫描及冠状面扫描[10]。
1.2.3斑块稳定性判断 根据颈动脉超声及MRI进行判断。若为软斑块或溃疡斑块,伴随斑块内出血、纤维帽破裂即为不稳定斑块;扁平斑块或硬斑块即为稳定斑块[11]。
1.2.4血清RBP、Sirt1表达检测 收集2组研究对象清晨空腹静脉血5 mL,HC-2066高速离心机(北京东南仪诚实验室设备有限公司) 3 500 r/min离心10 min,分离上清,酶联免疫吸附试验检测血清RBP(K6110,广东固康生物科技有限公司)、Sirt1(SEE912Hu-96T,北京博尔优生物技术有限公司)表达水平,按试剂盒说明书操作,多功能酶标仪(昆明赞纳生物科技有限公司)检测。
1.2.5血清miR-126表达检测 Trizol提取血清总RNA,加Trizol与样品比例3∶1,混匀,静置5 min,加200 μL氯仿,静置,离心,取上层RNA,加异丙醇,静置,离心,留沉淀,加75%无水乙醇离心,弃上清,室温干燥RNA10 min,加DEPC水溶解RNA,测定RNA浓度及纯度,RNA逆转录为cDNA,反应条件为:42 ℃ 2 min,去除DNA,反转录应条件为:37 ℃ 15 min,85 ℃ 5 s,反应结束后,将cDNA放在-20 ℃冰箱备用,引物序列见表2。实时荧光定量PCR,U6为内参基因,2-△△Ct法计算miR-126的相对表达量,重复3次。

表2 引物序列Table 2 Primer sequences
1.3统计学方法 应用SPSS 21.0软件进行统计分析。计量资料采用比较t检验,计数资料比较采用χ2检验, Spearman相关性分析RBP、miR-126、Sirt1表达与颈动脉粥样硬化斑块稳定性的关系;ROC曲线分析RBP、miR-126、Sirt1表达对颈动脉粥样硬化斑块稳定性的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.1病例组与对照组研究对象血清RBP、miR-126、Sirt1表达 与对照组相比,病例组患者血清RBP表达增加,miR-126、Sirt1表达降低,差异有统计学意义(P<0.05),见表3。
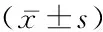
表3 2组血清RBP、miR-126、Sirt1表达Table 3 Expression of serum RBP, miR-126 and Sirt1 between two groups
2.2稳定斑块组和不稳定斑块组血清RBP、miR-126、Sirt1表达 与稳定斑块组相比,不稳定斑块组血清RBP表达增加,miR-126、Sirt1表达降低(P<0.05),见表4。
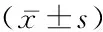
表4 2组血清RBP、miR-126、Sirt1表达水平Table 4 Expression levels of serum RBP, miR-126 and Sirt1 between two groups
2.3Spearman相关性分析 血清RBP表达与颈动脉粥样硬化斑块稳定性存在正相关关系(P<0.05),血清miR-126、Sirt1表达与颈动脉粥样硬化斑块稳定性存在负相关关系(P<0.05),见表5。

表5 Spearman相关性分析Table 5 Analysis of Spearman correlation results
2.4ROC曲线分析 血清RBP、miR-126、Sirt1单独及联合表达对颈动脉粥样硬化斑块稳定性的预测价值:RBP、miR-126、Sirt1及联合预测的AUC为0.746、0.798、0.712、0.892,敏感度为59.7%、75.8%、75.8%、74.2%,特异度为84.6%、70.5%、64.1%、92.3%,见表6,图1。
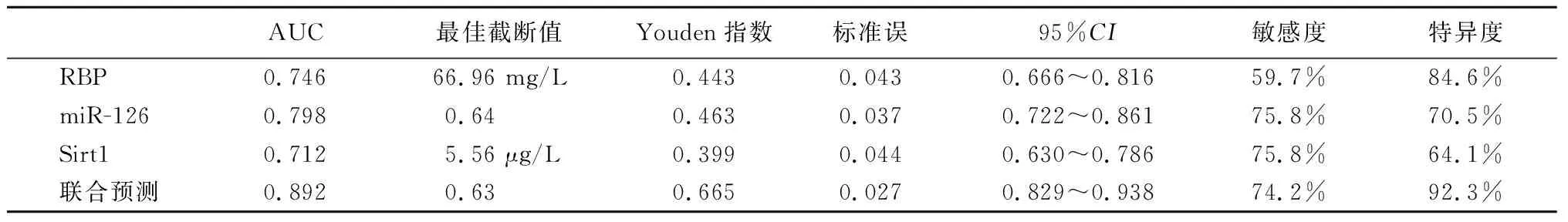
表6 ROC曲线结果分析Table 6 Analysis of ROC curve results
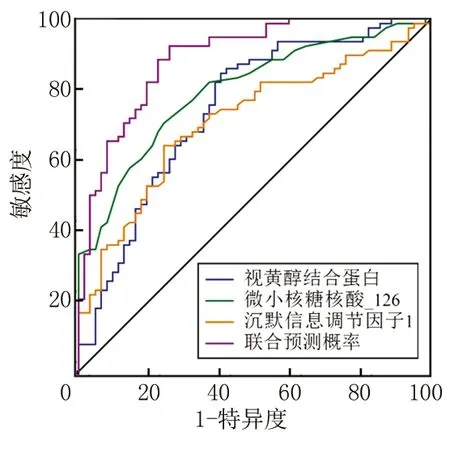
图1 血清RBP、miR-126、Sirt1单独及联合表达对颈动脉粥样硬化斑块稳定性的预测价值Figure 1 Predictive value of serum RBP, miR-126, and Sirt1 expression alone and in combination for the stability of carotid atherosclerotic plaques
3 讨 论
脑血管疾病是全球疾病负担的第3位疾病,根据《2018中国卫生健康统计提要》报告显示,2017年我国农村和城市脑血管疾病病死率分别为23.18%和20.52%,约每5例脑血管疾病患者中有1例死亡[12]。急性脑梗死是脑血管疾病的常见类型。文献指出,约七成脑梗死患者存在单侧颈动脉粥样硬化,约六成脑梗死患者存在双侧颈动脉粥样硬化;通过手术去除颈动脉粥样硬化病变组织后,患者发生脑梗死的概率大大降低,提示着颈动脉粥样硬化斑块易损结构破裂、血小板聚集形成血栓是脑梗死的主要危险因素[13]。颈动脉粥样硬化斑块可通过超声检查区分为稳定性斑块与不稳定性斑块,其中稳定性斑块的炎性细胞少且纤维多,不易破裂;而不稳定性斑块炎性细胞较多且质地柔软,新生成的微血管多,容易破裂,进而促进急性脑梗死的病情进展,所以,对斑块稳定性的检测有助于急性脑梗死的预防和治疗。目前,临床常采用彩色多普勒超声检查来判断、评估患者的颈动脉粥样硬化,但该方法对斑块稳定性的诊断较差[14],因此,探索与颈动脉粥样硬化斑块稳定性相关的指标对急性脑梗死的诊断、治疗及评估具有重要意义。目前关于RBP、miR-126、Sirt1与颈动脉粥样硬化斑块稳定性的研究较多,但国内尚未有其联合预测颈动脉粥样硬化斑块稳定性的报道,所以本研究检测患者与健康者RBP、miR-126、Sirt1表达水平波动情况,分析其对颈动脉粥样硬化斑块稳定性的预测价值。
研究表明,RBP可抑制PI3K酶活性,对胰岛素相关通路产生影响,导致胰岛素抵抗,进而引起机体高血糖,形成高胰岛素血症,刺激血管平滑肌增殖,促进动脉粥样硬化斑块形成[15]。本试验中检测研究对象RBP水平发现,病例组患者血清RBP表达较对照组增加,且不稳定斑块组血清RBP表达较稳定斑块组增加,Spearman相关性分析的结果表明,RBP与颈动脉粥样硬化斑块稳定性呈正相关,ROC曲线也指出,RBP对颈动脉粥样硬化斑块稳定性均有较好的预测价值。这可能是因为RBP在肝脏中合成,可以引起肝脏脂肪酸代谢异常,加剧患者胰岛素抵抗,另外RBP水平升高可引起血管的氧化应激反应,刺激炎性因子的生成及释放,引起血管损伤,促进动脉粥样硬化的发生及发展,这一点在何伟等[16]、张海燕等[17]的研究中也有提到。
miR-126是内皮细胞特异性的miRNA,研究表明[18],机体miR-126水平降低会损伤血管的完整性,减少新血管生成,改变血管正常形态与功能。还有研究指出[19],miR-126与血管损伤及动脉粥样硬化斑块相关,miR-126在凋亡小体内运转,对血管细胞发挥旁分泌作用,刺激血管细胞产生趋化因子基质细胞衍生因子1,减少炎性细胞,形成稳定斑块,这表示其具有抗颈动脉粥样硬化作用。研究结果表明,病例组患者血清miR-126表达较对照组降低,不稳定斑块组血清miR-126表达也较稳定斑块组降低,Spearman相关性分析指出,miR-126与颈动脉粥样硬化斑块稳定性呈负相关,ROC曲线表明,miR-126对颈动脉粥样硬化斑块稳定性均有较好的预测价值。这在范翥元等[20]的研究中也有提到。
Sirt1是去乙酰化酶,可与wnt、Notch等信号通路中的蛋白相互作用,维持基因组和染色体稳定性,参与神经保护、炎症反应、氧化应激及细胞生物学行为等过程。研究表明Sirt1可以抑制低密度脂蛋白受体1的水平,降低氧化型低密度脂蛋白摄取,降低泡沫细胞数量,起到抗颈动脉粥样硬化作用[21]。本研究结果表明,病例组患者血清Sirt1表达较对照组降低,不稳定斑块组血清Sirt1表达也较稳定斑块组降低,Spearman相关性分析指出,Sirt1与颈动脉粥样硬化斑块稳定性呈负相关,ROC曲线表明,Sirt1对颈动脉粥样硬化斑块稳定性均有较好的预测价值。这是因为Sirtl可减轻内皮细胞氧化应激反应,促进内皮型NO合酶表达,保护内皮细胞功能;此外,Sirtl可催化NF-κB去乙酰化,抑制其活性,减少等炎症因子的产生,减轻炎症反应病理损伤,保护内皮细胞,这一观点在唐宇姣等[22]的研究也有提到。
综上所述,急性脑梗死患者血清RBP表达增加,miR-126、Sirt1表达降低,可能参与急性脑梗死患者颈动脉粥样硬化斑块形成与发展,进而与急性脑梗死的病情进展相关,且RBP、miR-126、Sirt1联合对颈动脉粥样硬化斑块稳定性具有较好预测价值,所以监测急性脑梗死患者RBP、miR-126、Sirt1对急性脑梗死的及时干预与治疗具有重要意义。但本研究也存在一定的局限性,一方面,本研究纳入的病例来源较为单一且数量较少,研究结果缺乏广泛性;另一方面,血清RBP、miR-126、Sirt1水平与急性脑梗死及颈动脉粥样硬化斑块稳定性相关的机制通路尚不明确,所以,还需扩大病例来源,增加病例数进行更深层次地探索。

