不同浓度CB对小鼠纺锤体移植后重构卵细胞骨架及囊胚发育影响的研究
王启航,王 伟,王伟周,商 微
(1.中国解放军总医院第七医学中心生殖医学科,北京 100700;2.中国人民解放军总医院第六医学中心生殖中心,北京 100037;3.中国人民解放军总医院第七医学中心妇产医学部,北京 100700)
线粒体是真核细胞中必不可少的细胞器,主要通过氧化磷酸化(oxidative phosphrylation,OXPHOS)产生细胞能量[1]。线粒体疾病是指线粒体基因组和(或)核基因组突变,导致细胞OXPHOS障碍引起的一类疾病,目前尚无方法治愈[2]。在大多数病例中,临床表现往往各不相同,疾病谱重叠[3]。儿童每10万人中5~15人患病[4],成年人每10万人中12.5人患病,在所有致病性突变中每10万人中23人患病[5]。目前预防重线粒体DNA(mtDNA)疾病遗传的常规方法包括产前诊断和胚胎植入前遗传学诊断(preimplantation genetic diagnosis,PGD)。产前诊断是一种对不同妊娠早期阶段的细胞进行采样的技术,可用于降低严mtDNA疾病地风险,并可在突变负荷高时选择终止[6]。产前诊断的主要困难是mtDNA突变负载在不同组织之间可能不同,也可能取决于取样时的胎儿发育阶段[7]。PGD技术开发于30年前[8],最近几年才应用于减少或消除mtDNA疾病。该技术是从早期胚胎中取出的一个或多个细胞进行基因检测,并选择无突变或低突变负荷的胚胎移植到子宫[9-10]。但PGD并不适合所有携带致病性mtDNA突变的患者,包括具有同源mtDNA突变或仅产生高突变负荷的患者。然而,女性患者必须生产出突变水平低于疾病表达临界阈值的胚胎,才有可能生育一个健康的婴儿。这就有了对替代技术的需要,以减少mtDNA疾病的遗传风险,如核质置换技术[3]。核质置换技术是从携带mtDNA突变的卵母细胞或受精卵中取出细胞核,然后转移到的去核供体卵母细胞或受精卵中。该技术包括生发泡移植[11-12]、极体移植[13-14]、纺锤体移植[15-16]、原核移植[17-18]等。其中纺锤体移植是迄今为止研究最充分的核质置换技术。有大量数据显示该技术安全性最强,最具临床转化及临床推广潜力。本研究小鼠纺锤体移植,采用不同浓度的细胞松弛素B(cytochalasin B,CB)处理,通过检测重构卵母细胞骨架和统计重构胚胎发育情况,筛选出更优CB浓度,为人类纺锤体移植技术提供可靠的实验数据。
1 材料与方法
1.1实验动物及主要试剂 小鼠品系为C57BL/6清洁级小鼠,购买自北京维通利华实验动物技术有限公司。雌鼠周龄为6~8周,雄鼠月龄为6~7个月。CB(Sigma,德国)、仙台病毒(Hemagglutinating virus of japan,HVJ)(ISK,日本)、PMSG(宁波三生,中国)、绒毛膜促性腺激素(human chorionic gonadotropin,hCG)(宁波三生,中国)、4%多聚甲醛(Sigma,德国)、小鼠抗β-微管蛋白抗体(Sigma,德国)、Triton X-100(Sigma,德国)、FITC-山羊抗鼠抗体(Sigma,德国)、FITC标记的鬼笔环肽(Solarbio,中国)、DABCO聚乙烯醇封片剂(Sigma,德国)
1.2实验方法
1.2.1卵子准备 雌性C57BL/6小鼠腹腔注射PMSG 10 U,48 h后注射hCG 10 U诱导超排,注射hCG14~16 h后取卵,挑选形态正常的MⅡ期卵母细胞(形态饱满,光亮),用体外操作液洗3次。再转移到过夜平衡的受精液中,置于培养箱中待用。
1.2.2纺锤体移植(spindle transfer,ST)及分组 ST是指从MII期卵母细胞中取出纺锤体-染色体复合物,并将其转移到另一个已去核的MII期卵母细胞中的过程。将准备好的卵子放在含有不同浓度CB操作液中孵育,时间均为5 min。用持卵针固定住卵,在偏振光镜下将纺锤体摆放成梭形,置于12~1点钟位置,再用激光打透纺锤体对应部分的透明带,去核针经透明带缺口轻轻地吸出纺锤体-染色体复合物,注意尽量少带纺锤体周围的胞浆。然后把取出的细胞核转移到HVJ-E中浸泡10 s左右,再将带有HVJ-E的细胞核注入另外已经去核的卵母细胞的卵周间隙中,最后将其转入受精液中继续孵育,观察融合情况。分组:CB浓度7.5 mg/L为常规组、CB浓度3.5 mg/L为低剂量组、CB浓度10 μg/mL为中剂量组、CB浓度12.5 mg/L 高剂量组。
1.2.3精子获能 成年健康的公鼠断颈处死,迅速分离出附睾尾和输精管,剪下附睾尾(尽可能去除脂肪),在体式镜下用精细剪将附睾尾剪 2~3 下,用镊子轻轻挤出精子,然后将其转移到过夜平衡的精子获能液中,再置于CO2培养箱中获能,获能1 h后行体外受精(in vitro fertilization,IVF)。获能好的精液呈云雾状,杂质少。
1.2.4IVF 各组重构卵,洗涤后分别置于过夜平衡的20 μL受精液中(每滴放小于或等于10枚), 然后将1 μL已获能的精液加入到有卵母细胞的受精液滴中,放入37 ℃/ 6%CO2/5%O2培养箱,IVF 6 h后观察受精情况,并转移到卵裂液中继续培养。
1.2.5囊胚细胞计数 各组挑选出20枚左右扩张期囊胚,分别用4%多聚甲醛固定,室温30 min;1%PVA/PBS液清洗3次,5 min/次;将囊胚放入配制好的10 mg/L Hoechst 33342中染核,室温避光孵育15 min;1% PVA/PBS液再清洗3次,5 min/次;将处理好的囊胚转移到载玻片上,用DABCO聚乙烯醇防荧光淬灭封片剂封片;在荧光显微镜下观察,用紫外光激发蓝色荧光,统计囊胚细胞总数。
1.2.6微管β-Tubulin蛋白和微丝的免疫荧光染色 本实验对各组重构卵母细胞融合后0.5 h、1 h、2 h进行取样固定。简单介绍染色过程如下:各组重构卵母细胞通过连续激光打孔方式去除透明带,清洗,用 4%多聚甲醛中固定半小时,转移到0.5%TritonX 100中,清洗,转移到含有1%BSA的封闭液中。处理好的卵放入1∶200封闭液稀释的小鼠抗β-微管蛋白抗体中,4 ℃冰箱过夜;然后转入1∶1 000封闭液稀释的二抗(山羊抗鼠抗体)中,室温避光1 h;再转移到1∶100封闭液稀释的TRITC标记鬼笔环肽液中,室温避光1 h;最后转移到1∶200清洗液稀释的DAPI中,室温避光5~10 min。根据盖玻片的大小,把凡士林/石蜡混合物,滴在干净的盖玻片上做4个小柱,在4个小柱中间滴上1%PVA/PBS液1 μL,将处理好的卵转到1%PVA/PBS液中,小心盖压,使样品位置固定,用DABCO聚乙烯醇防荧光淬灭封片剂封片。低温保存,尽快用共聚焦显微镜观察,拍照。
1.3Aipathwell免疫荧光分析
1.3.1分析方法 采用AI深度学习原理,基于海量数据进行算法训练并集成为自动化图像分析软件。具体过程如下,①循迹:自动定位并沿待测组织圈定待测区域,可根据具体要求手动定位;②选色:根据HSI自动进行阳性判断,可根据具体情况手动修正;③运算:根据需求,软件自动定位细胞核并扩展胞质范围;计算阳性细胞数量以及面积;累积光密度 (integrated optical density,IOD);组织面积等不同参数;④分析:高倍下逐步计算待测区域。完成后根据原始基础数据以及算法公式自动对各个项目进行计算得出分析结果。
1.3.2评价项目 阳性强度,个阳性点颜色深浅的平均值:反应整个片子或者某个区域阳性的平均深浅度。明场为平均光密度,暗场为平均强度,数值越大阳性程度越强。平均光密度值=累积光密度值阳性像素面积。
1.4统计学方法 应用SPSS21.0统计软件分析数据。计量资料采用单因素方差分析和SNK-q检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1比较各组移植效率 低剂量组、中剂量组、高剂量组与常规组相比,注核率、融合率差异无统计学意义,即小鼠纺锤体移植效率差异无统计学意义(P>0.05),见表1。

表1 各组移植效率比较Table 1 Comparison of transplantation efficiency in each group (株数,%)
2.2比较各组胚胎发育情况 高剂量组的受精率低于常规组(P<0.05);高剂量组的囊胚率、孵化率低于常规组(P<0.05)。见表2。

表2 各组胚胎发育情况比较Table 2 Comparison of embryonic development in each group (株数,%)
2.3比较不同浓度CB重构小鼠囊胚细胞总数 为了避免胚胎级别对实验结果的影响,所有实验均选择扩张期囊胚进行实验。高剂量组的囊胚细胞总数少于常规组(P<0.05),中剂量组的囊胚细胞总数多于常规组(P<0.05)。见表3,图1。

表3 各组囊胚细胞总数比较Table 3 Compared the total number of blastocysts in each group
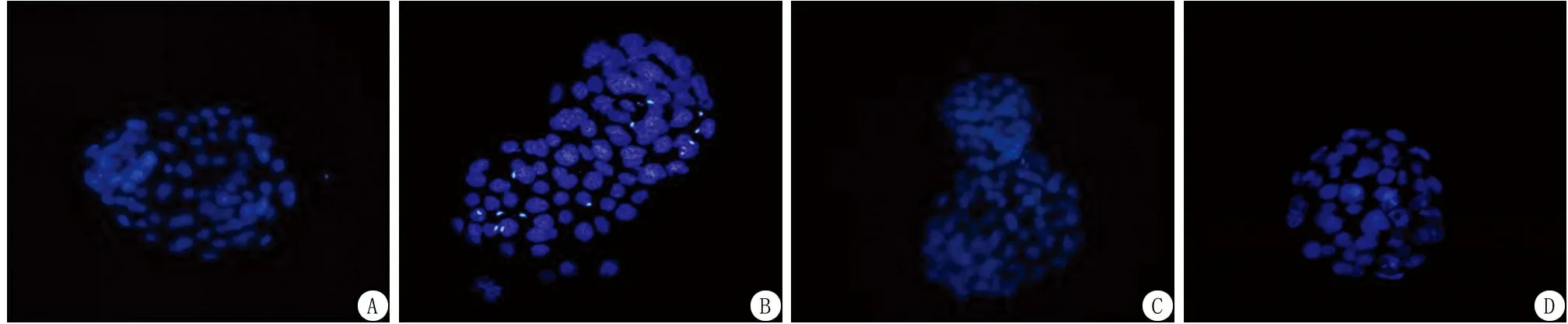
图1 各组囊胚免疫荧光染色A.常规组;B.低剂量组;C.中剂量组;D.高剂量组Figure 1 Immunofluorescence staining of blastocysts in each group
2.4免疫荧光染色比较重构小鼠卵母细胞骨架恢复情况 融合后0 h观察,微丝出现在纺锤体周围;融合后1 h观察,逐渐出现在皮质区域;融合后2 h观察,各组基本恢复正常。低剂量组、中剂量组、高剂量组和常规组相比,不同时间重构小鼠卵微丝阳性比率差异无统计学意义(P>0.05);但不同时间各组微丝的平均光密度值,组间比较差异有统计学意义(P<0.05),时间点间比较有差异(P<0.05),组间的时间变化趋势差异有统计学意义(P<0.05),即不同浓度CB和不同观察时间对小鼠重构卵细胞骨架恢复情况均有影响,且差异有统计学意义。见表4,5和图2~4。
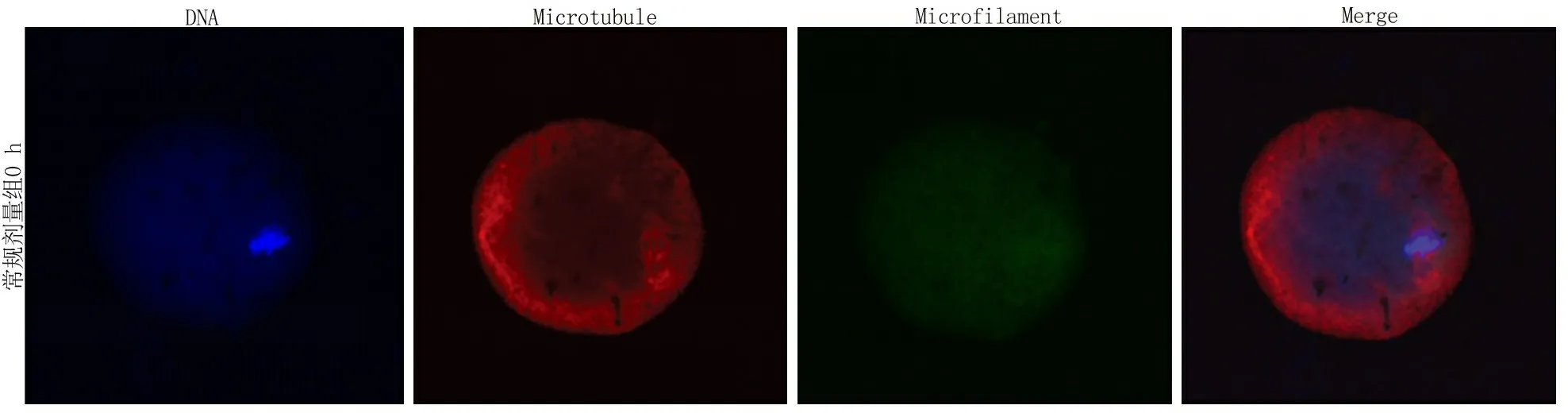

图2 各组融合后0 h细胞骨架恢复情况Figure 2 Cytoskeletal recovery in each group at 0 h after fusion
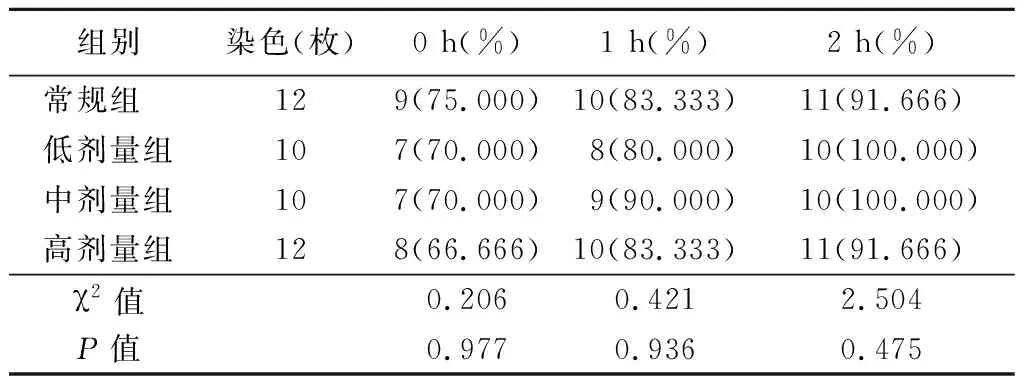
表4 不同时间各组微丝的阳性比率比较Table 4 Comparison of the positive ratio of microfilaments in each group at different time points (个数,%)

表5 不同时间各组微丝的平均光密度值比较Table 5 Comparison of the average optical density of microfilaments in each group at different time points
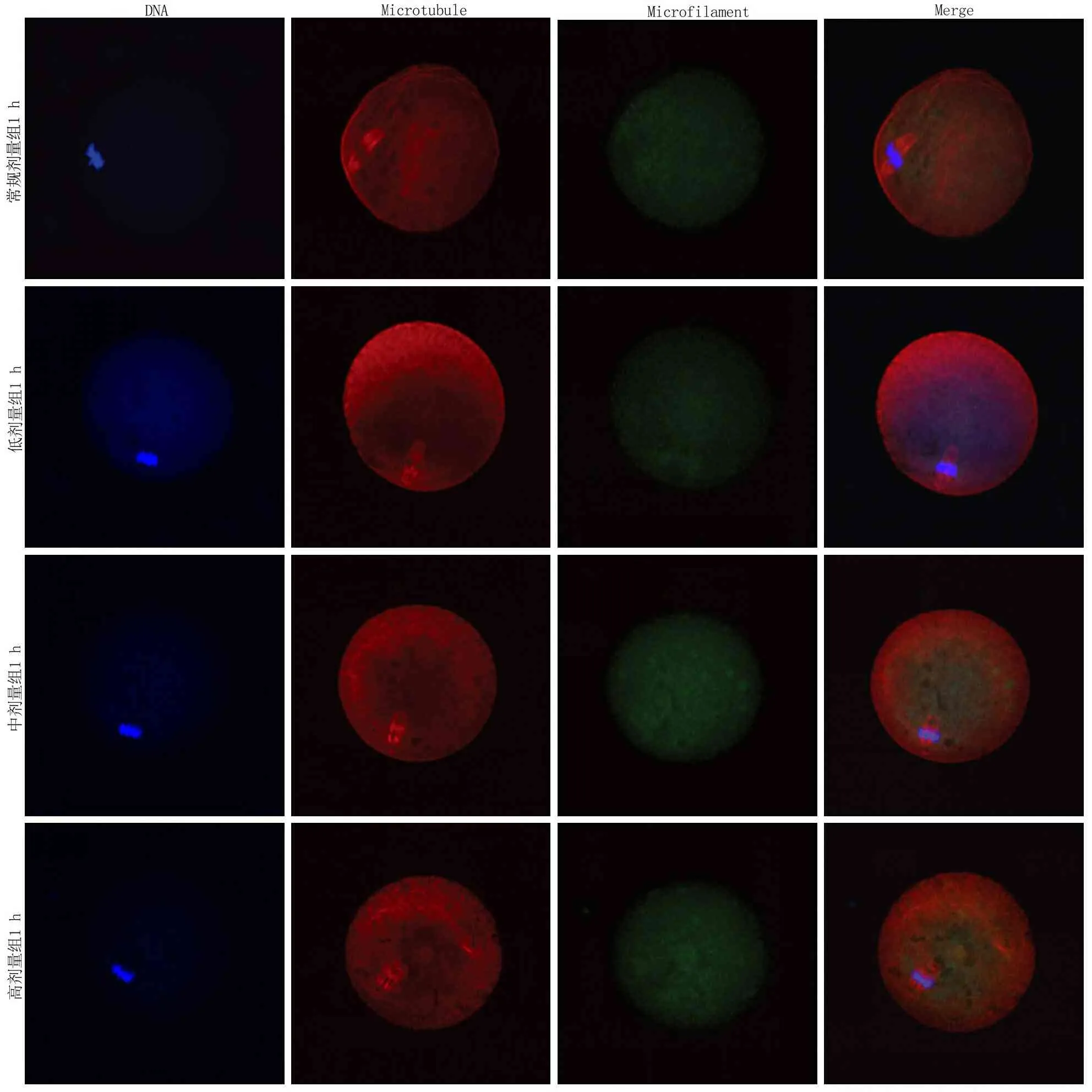
图3 各组融合后1 h细胞骨架恢复情况Figure 3 Cytoskeletal recovery in each group at 1 h after fusion
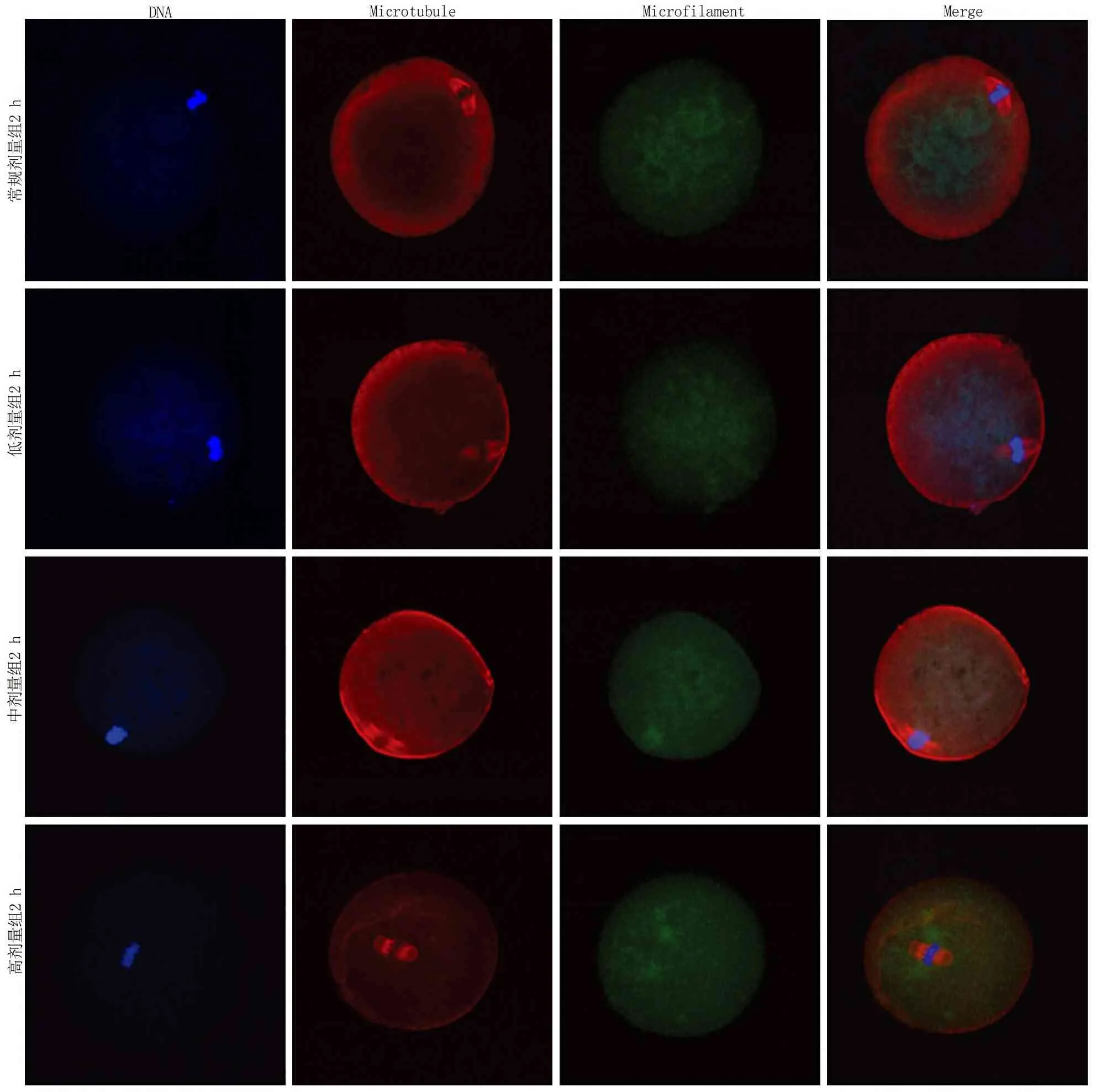
图4 各组融合后2 h细胞骨架恢复情况Figure 4 Cytoskeletal recovery in each group at 2 h after fusion
3 讨 论
线粒体病是因遗传缺陷引起线粒体代谢酶的缺陷导致APT合成障碍,能量产生不足而出现的一组系统疾病,目前临床不能治愈。核质置换技术的优势是可以有效预防突变mtDNA向子代传递,已在人类和动物模型上得到了证实。虽然临床上已有通过核质置换技术出生的婴儿,但是实验过程中重构囊胚效率及质量较低,且可用于移植的囊胚极少。因此,现阶段提升核质置换技术效率和重构囊胚的质量,已本领域研究的重点、难点和热点。1983年McGrath和Solter开发了小鼠原核移植,并获得子代,由此奠定了核质置换技术的基础。即从一个受精卵中取出原核,注入到另一个去核的胞质中,细胞骨架抑制剂(CB和秋水酰胺)的前提下,使得原核很容易被取出,从而提高了受精卵的存活率。96%的重组受精卵发育到桑椹胚或囊胚阶段,移植到假孕雌鼠后产生活的后代(活出生率:16%)。该研究中CB浓度为5 mg/L,原核移植效率为90% 左右[19]。2013年,Tachibana等[20]发表了第一篇人类卵纺锤体移植的文章,该研究进一步证实核质置换技术的可行性,同时报道卵胞质内单精子注射(intracytoplasmic sperm injection,ICSI)后,出现相当比例的受精异常。与正常组比较,人类重构卵的异常受精率更高(分别为13%、52%),但在非人类灵长类纺锤体移植后受精卵中未观察到,这可能是由于摘除和转移过程中卵母细胞过早激活或纺锤体损伤所致。在本研究中未观察到小鼠重构卵异常受精,考虑可能与细胞融合方式或受精方式有关。该研究人纺锤体移植使用的CB浓度为5 mg/L,重构卵正常受精的囊胚率是62%,对照组囊胚率是76%;而且重构胚胎中核相关的mtDNA含量很低。2017年,张进教授等报道了世界第一例人纺锤体移植活体婴儿出生。由张进教授等在墨西哥操作完成,并顺利活产一名健康男婴。患者为一名36岁的女性,经历了四次流产,活产两名儿童,但由于母亲遗传的mtDNA突变(>95%)水平过高而死亡,已知这种突变可导致Leigh综合征(m.8993T>G)。该研究人纺锤体移植,使用的CB浓度为7.5 mg/L,重构卵中受精5枚,有4枚发育至囊胚。选择胚胎移植的重构囊胚中,mtDNA突变负荷的平均水平为5.73%,而出生后采集的多个组织中mtDNA突变负荷的平均水平为(1.60±0.92)%[21]。以上研究均未提及不同CB浓度对移植效率及胚胎发育情况的探讨,本课题发现不同浓度CB对小鼠纺锤体移植效率差异无统计学意义,但是会影响重构囊胚质量。
2011年,Hu等[22]研究了CB对ICSI胚胎存活和体外发育的影响,该研究结果显示,与未经CB处理的对照组相比,用5 mg/L CB处理的ICSI胚胎的存活率显着提高,但2组的受精率、卵裂率和囊胚率均没有显著差异。 该研究发现正常卵母细胞经过5 mg/L CB处理后,纺锤体立即与质膜平行,并且微丝无法检测到。CB处理后0.5 h,在纺锤体周围观察到微丝(31/34,91.2%);1 h后,逐渐出现在皮层区域(31/33,93.9%);2 h后,已完全恢复(34/34,100%), 该研究表明CB处理对微丝无影响。本研究通过免疫荧光染色,观察小鼠卵的细胞骨架,并进行定量分析,比较不同时间重构小鼠卵微丝阳性比率及光密度值,结果显示重构小鼠卵微丝阳性比率无差别,但是不同浓度CB和不同观察时间对重构小鼠卵细胞骨架恢复情况均有影响,且有统计学差异。
综上所述,在本研究选取的CB浓度范围内,中剂量组优于常规组。CB在纺锤体移植中的作用是松弛细胞骨架,在胞质完整的前提下,细胞核更容易取出,探讨不同浓度CB在核移植过程中对重构卵母细胞骨架及胚胎发育的影响,旨在增加纺锤体移植的安全性,降低核移植对重构卵细胞骨架的影响,促进重构胚胎的发育,获得更优质囊胚。

