山羊源牛无浆体对Balb/c小鼠感染性研究
彭永帅,张 曼,张 艳,菅复春,王海燕,宁长申*
(1.河南牧业经济学院,河南郑州 450046;2.河南农业大学,河南郑州 450046)
牛无浆体(Anaplasmabovis)隶属于立克次体目(Rickettsiales)、无浆体科(Anaplasmataceae)、无浆体属(Anaplasma),1936年首次在牛体内被发现,可感染血液单核细胞和组织巨噬细胞,大小1 μm~6 μm,在单核细胞中表现多种包涵体形态,其中最常见的是小型(0.5 μm~1 μm)和中型(2 μm~3 μm)球状体,而成熟包涵体(3 μm~6 μm)较少见[1]。牛和水牛被认为是牛无浆体的主要宿主,后来在山羊、犬、狍子、马鹿、梅花鹿、獐、巴西的短角鹿、黄羊、豹猫、浣熊和棉尾兔等体内也被发现[2]。很多蜱类被怀疑可以传播牛无浆体,包括璃眼蜱属、花蜱属、扇头蜱属、血蜱属等[1]。牛无浆体主要分布在非洲、亚洲和南美洲,但它也在美国和欧洲南部被发现[3-4]。感染牛无浆体的动物一般表现轻微临床疾病,但也有报道可导致发热、虚弱、体重减轻、黏膜苍白和淋巴结炎等比较严重的临床症状[1],对动物生产性能影响较大。
近年来,随着人们对牛无浆体的持续关注,其在我国多种动物中的流行呈上升趋势。然而,目前关于牛无浆体的研究一直停留在流行病学调查水平,其对动物的致病性、疫苗研发、药物治疗等领域一直存在空白。因此,开展牛无浆体的分离鉴定及探索一种实验动物模型对该病原体的研究具有重要推动作用。
对无浆体的检测主要依赖于血液样本的显微镜检查和PCR检测技术相结合的方法。牛无浆体16S rRNA和groEL基因是公认的用于检测该病原的目的基因[5]。本研究旨在将分离的1株牛无浆体接种至人工饲养的Balb/c小鼠,验证该菌株对Balb/c小鼠的感染性,为牛无浆体Balb/c小鼠动物模型的建立奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 用EDTA-Na2抗凝采血管采集购自河南洛阳某羊场的山羊颈静脉血20 mL,4℃保存备用。
1.1.2 实验动物 Balb/c健康小鼠购自郑州大学实验动物中心,6周龄~8周龄,体重20 g~22 g,雌雄各半,饲养于河南牧业经济学院清洁级动物房,饲养方式为自由采食、自由饮水。将Balb/c小鼠随机分为9组,每组5只。
1.1.3 主要仪器设备 PCR 仪,美国ABI公司产品;荧光定量PCR仪,德国耶拿公司产品;超微量紫外分光光度计,美国Thermo Fisher公司产品;光学显微镜,日本奥林巴斯公司产品。
1.1.4 主要试剂 羊外周血单核细胞分离液试剂盒,天津灏阳生物公司产品;血液DNA 提取试剂盒,美国OMEGA公司产品;LaTaq酶和SYBR PremixTaq和pMD-18T,日本TaKaRa公司产品;大肠埃希氏菌DH5α感受态细胞和SanPrep柱质粒提取试剂盒,上海生工生物工程股份有限公司产品;姬姆萨原液,北京索莱宝科技有限公司产品。
1.2 方法
1.2.1 单核细胞分离 取血液样品2 mL,参照羊外周血单核细胞分离液试剂盒操作说明分离山羊单核细胞。
1.2.2 DNA提取 参照血液DNA提取试剂盒操作说明对300 μL全血或分离得到的单核细胞进行DNA提取,所得DNA置于冰箱-20℃保存备用。
1.2.3 病原鉴定及定量检测 分别基于牛无浆体16S rRNA和groEL基因位点对病原进行常规PCR(conventional PCR,cPCR)鉴定,同时为了排除不同无浆体种的混合感染,分别对山羊无浆体、绵羊无浆体、嗜吞噬细胞无浆体、边缘无浆体、扁平无浆体和中央无浆体进行检测(表1),并将PCR阳性产物送往北京擎科生物科技有限公司进行测序,测序结果在NCBI网站(https://www.ncbi.nlm.nih.gov/)进行比对分析;用实时荧光定量PCR(qPCR)对病原进行定量。
cPCR反应总体系:10×La buffer 2.5 μL,dNTPs 4 μL,上、下游引物(20 μmol/L)均0.5 μL,LaTaq酶0.25 μL,DNA模板2 μL,灭菌纯水补足至25 μL。PCR反应条件:94℃ 5 min;94℃ 30 s,退火30 s(表1),72℃延伸30 s,35个循环;最后72℃再延伸10 min。

表1 PCR引物信息及退火温度
qPCR反应体系:SYBR PremixTaq12.5 μL,上、下游引物各0.5 μL,DNA模板2 μL,加灭菌双蒸水补足至20 μL。PCR反应条件:95℃ 30 s;95℃ 5 s,57℃ 30 s,30个循环。
为了利用qPCR对牛无浆体的接种浓度进行绝对定量,构建包含牛无浆体gltA基因的质粒,用于构建标准曲线。将PCR产物(133 bp)克隆到pMD-18T,然后转化至大肠埃希氏菌DH5α感受态细胞。使用SanPrep柱质粒提取试剂盒从转化大肠埃希氏菌DH5α感受态细胞中提取质粒DNA,用超微量紫外分光光度计检测DNA浓度,大于20 ng/μL可用于下一步试验。
为了生成定量测定的标准曲线并评估扩增效率,以10倍倍比稀释(100ng/μL~1010ng/μL)的质粒DNA作为模板进行扩增。每份稀释液在-20℃条件下保存备用,为了减少污染的可能性,标准质粒DNA被储存在一个单独的冷冻箱。
1.2.4 病原接种 将不同浓度的牛无浆体采用腹腔接种方法接种至正常饲养的Balb/c小鼠,接种时每组内分别设置阴性对照,接种时按照高(初浓度)、中(1/2浓度)、低(1/4浓度)剂量进行,每组设置3个重复,阴性对照分别注射等剂量的生理盐水。
1.2.5 Balb/c小鼠牛无浆体感染情况检测
1.2.5.1 Balb/c小鼠血液样品采集 用断尾法采集人工感染后3、6、9、12、15 d的Balb/c小鼠血液,每次采集血液样品量约为300 μL,现场制作血涂片,剩余血液样品置冰箱4℃保存备用。
1.2.5.2 血涂片检查 将制作好的血涂片用甲醇固定2 min~3 min,再用姬姆萨原液与磷酸盐缓冲液配置的姬姆萨工作液染色15 min~30 min,用蒸馏水缓慢冲洗,室温晾干后在光学显微镜1 000倍镜下观察,并拍照记录结果。
1.2.5.3 PCR检测 参照1.3 DNA提取方法提取小鼠血液DNA,参照1.2.4中的用于检测牛无浆体的常规PCR引物、反应条件和体系对小鼠血液DNA进行检测。
2 结果
2.1 牛无浆体分离及鉴定结果
对山羊单核细胞DNA样品进行基于牛无浆体16S rRNA和groEL基因的PCR检测,发现该细胞样品牛无浆体呈阳性,其它无浆体种均呈阴性。通过对单核细胞DNA样品进行绝对定量,测得的牛无浆体浓度为1000 ng/μL。
2.2 Balb/c小鼠牛无浆体感染情况结果
2.2.1 姬姆萨染色检查 通过对血涂片姬姆萨染色镜检,在接种中等剂量和高等剂量牛无浆体Balb/c小鼠的单核细胞内均观察到1个或多个牛无浆体,呈紫红色,位于细胞质内,核的边缘(图1)。接种后3、6、9 d的血涂片中均可检查到牛无浆体;接种后12 d检查时,单核细胞中未见牛无浆体。由此可见,本研究接种的牛无浆体可造成Balb/c小鼠感染,9 d内可持续感染。
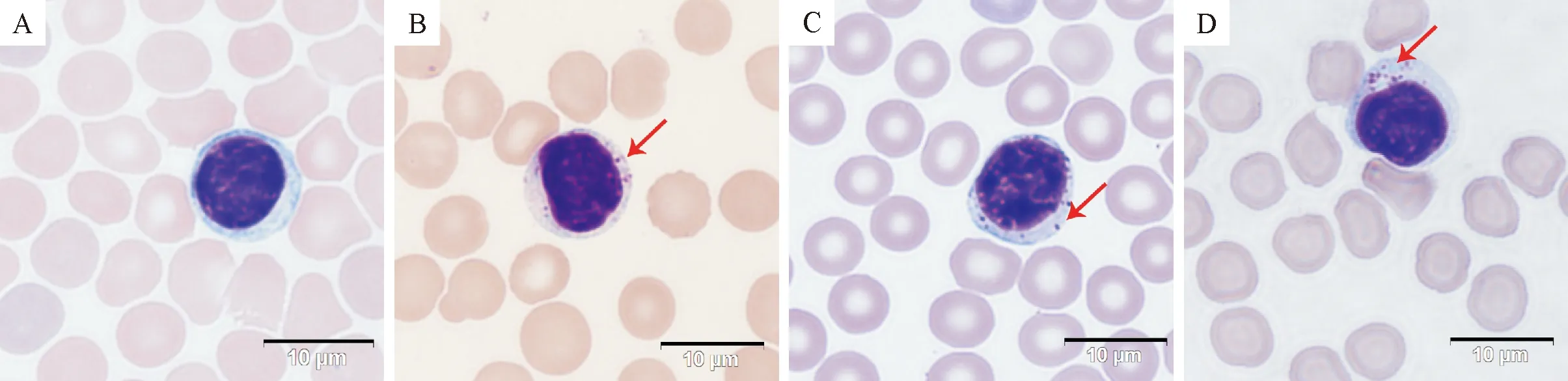
箭头指示为牛无浆体;A.阴性对照;B~D.牛无浆体感染阳性小鼠血涂片
2.2.2 PCR鉴定及检测结果 通过对分离得到的山羊单核细胞DNA分别基于牛无浆体16S rRNA和groEL基因的PCR检测,发现牛无浆体均呈阳性;测序比对发现,该阳性扩增产物为牛无浆体目的基因片段(551 bp和529 bp)。
通过对接种牛无浆体的Balb/c小鼠血液DNA进行检测,发现接种中剂量组和高剂量组牛无浆体后3、6、9 d的DNA样品中牛无浆体均呈阳性,低剂量组牛无浆体呈阴性;接种后12 d检查时,高、中剂量组DNA样品牛无浆体均呈阴性(图2),结果与姬姆萨染色结果一致。

S、M、L.低、中、高剂量组;P.阳性对照;N.阴性对照
3 讨论
无浆体属各成员均属于细胞内寄生的病原体,可从不同哺乳动物血液和硬蜱组织中分离,并且不同无浆体的分离不依赖于宿主类型和病原体的生态型。据报道,肩胛硬蜱细胞系已能成功用于分离马、犬、反刍动物、人类和硬蜱源无浆体株[13]。为了从犬血液中分离嗜吞噬细胞无浆体,将其接种至篦子硬蜱系胞系(IRE/CTVM20),培养7 d后在细胞中检测到病原包涵体并完成病原的分离[13]。然而,由于细胞系的培养持续时间较长,操作复杂,本研究采用单核细胞分离方法分离牛无浆体,并证明分离的菌株能够感染Balb/c小鼠,这为牛无浆体的分离提供了一种新方法,为无浆体其它菌种的分离鉴定提供了新思路。
据报道,从自然感染的动物细胞中分离无浆体已经可以实现,有研究从巴西鹿体内分离鉴定了一株边缘无浆体,并将其接种至肩胛硬蜱细胞系IDE8中,然后将感染有边缘无浆体的IDE8细胞接种至切除脾脏的牛体内,最后又用牛血成功感染了IDE8细胞[14]。将安氏革蜱和边缘无浆体作为蜱-病原体交互作用模型,使硬蜱以受感染的牛血为食,从而使未感染的硬蜱感染边缘无浆体,且感染的硬蜱被转移到未受感染的血液中,又使边缘无浆体感染血液[15]。用感染嗜吞噬细胞无浆体的IDE8细胞接种2只绵羊,14 d后成功感染,将感染绵羊的血液接种至另2只绵羊,不久后这2只绵羊感染并表现出与先前受感染的绵羊相似的临床症状[16]。上述研究表明,从动物细胞直接分离无浆体是可行的,得到的菌株具有活力。
鉴于牛无浆体能够感染动物单核细胞的特点,本研究通过分离山羊单核细胞达到了病原分离的目的,研究结果将使牛无浆体的分离鉴定、体外感染和疫苗研发方面研究更为便捷。但是,能否成功分离还应考虑原始样品材料中的病原载量。据报道,使用嗜吞噬细胞无浆体基于msp2基因的荧光定量PCR检测犬血液样品Ct值最低达13,轻微感染时Ct值达35[13]。本研究分离牛无浆体时并未对不同病原载量的血液样品进行定量检测,这是本试验的一项不足之处,探索用于分离牛无浆体血液样品中最低病原载量有待后续研究。另外,有报道从采集1周后的犬血液样品中进行嗜吞噬细胞无浆体分离时,许多病原体均已失活[13],因此样品的新鲜程度也是影响分离获取的无浆体质量的一个值得关注因素。
近年来无牛无浆体人工感染实验动物的报道,但是有其他无浆体人工感染实验动物的报道,李海辉等[17]对奶牛无浆体人工感染实验动物以及无浆体传播途径的研究,得出实验动物可以在免疫抑制条件下建立无浆体感染动物模型,同时证明了无浆体的感染方式有多种,如皮下接种、腹腔注射及非蜱类吸血昆虫机械性传播,该试验结果为其他无浆体的人工感染途径提供了依据。倪红波等[18]研究了边缘无浆体人工感染犊牛以及对犊牛血清生化和血液流变学影响的试验,观察到血液中红细胞的感染率呈现一定的消长规律,并揭示血液学与器官的变化状况。综上所述,无浆体的动物感染模型有据可依,开展牛无浆体对Balb/c小鼠感染试验对该病原动物模型的建立具有重要参考价值。

