不同日龄仔猪肠道菌群的组成与差异
刘 丹,孟江海,曹 斌,李 灿,曾 维,纪春晓,陈 韬*
(1.湖南农业大学动物医学院,湖南长沙 410128;2.湖南省兽药工程技术研究中心,湖南长沙 410128)
新一代测序技术极大地拓展了人们对肠道微生物群在人类健康和疾病中作用的认识。猪是人类重要的蛋白质来源和人类疾病的生物医学模型,使猪肠道微生物群越来越受到关注。特别是在猪的关键生长阶段,肠道微生物在猪的健康和生产中发挥着重要的作用[1]。由于各种应激、肠道屏障功能降低和病原体感染增加,断奶与肠道微生物群失调有关[2]。通过益生菌和益生元调节猪肠道微生物以维持健康微生物群可有效预防病原体感染和促进有益细菌丰度[3]。有研究收集273份直肠拭子和粪便分别进行测序和粪便微生物群移植,共检测到19个菌门,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)最多,不同阶段健康猪微生物群可能是由饲料或猪生理特性差异决定的[4]。对来自法国、丹麦和中国的287头猪的粪便进行宏基因组测序,确定了770万个非冗余基因,代表了719个宏基因组物种[5]。在人类基因目录中发现的96%的功能途径都存在于猪肠道微生物目录中,这证实了猪在生物医学研究中的潜在用途[6]。仔猪体内肠道微生物群被认为是其疾病发生和健康平衡的关键[8]。因此,肠道微生物在猪的健康和生产中发挥着重要作用,分析猪肠道微生物群落的组成和演替机制,可有效促进养猪业发展。
传统分子生物技术多以检测粪便中的菌群为主,而对结肠内容物的检测相对较少。近年来,新一代高通量测序技术的成熟,弥补了传统分子生物技术手段对肠道微生物群的研究,能够更全面、客观、准确地反映肠道微生物群的真实情况[9]。据了解,目前对猪出生到断奶后的肠道微生物群的组成和多样性,在不同日龄仔猪肠道微生物群的纵向变化较少有系统的研究。本试验主要选取不同日龄(0、5、10、15、20、25、30 d)健康二元仔猪,收集其结肠内容物,用16S rRNA基因高通量测序方法,探究不同日龄仔猪肠道微生物群的菌群组成、分布及其多样性的变化。
1 材料与方法
1.1 材料
1.1.1 试验用动物 从湖南新祥和农牧科技有限公司随机选择不同日龄(0、5、10、15、20、25、30 d)的健康二元仔猪(大约克 × 长白猪)各3头,总共21头。健康二元仔猪在断奶前饲喂常规教槽料,断奶后饲喂常规乳猪料。
1.1.2 主要试剂与仪器 Phusion®High-Fidelity PCR Master Mix,New England Biolabs公司产品;GeneJETTM Gel Extraction Kit 琼脂凝胶回收试剂盒和Ion Plus Fragment Library Kit 建库试剂盒,Thermo Scientific公司产品。Qubit@ 2.0 Fluorometer荧光定量仪、Ion S5TM XL高通量测序系统和超低温冰箱,Thermo Fisher公司产品;SX300 高压灭菌锅,Tomy公司产品。
1.2 方法
1.2.1 样品采集 通过肌肉注射40 mg/kg戊巴比妥钠麻醉仔猪,收集仔猪结肠内容物2 g~3 g,装入2 mL无菌EP管中,并迅速置于液氮中进行速冻,随后保存在-80℃冰箱备用。
1.2.2 DNA提取 采用CTAB法(十六烷基三甲基溴化铵)对样本进行基因组DNA提取,得到所有样品的基因组DNA,并用紫外分光光度计检测DNA浓度和纯度,再用Agilent 5400全自动毛细管电泳检测DNA的完整性。
1.2.3 PCR扩增和16S rRNA测序 使用引物序列:806R(5′-GGACTACHVGGGTWTCTAAT-3′)和338F(5′-ACTCCTACGGGAGGCAGCAG-3′),对细菌16S rRNA基因V3-V4区PCR扩增。PCR反应程序为:98℃ 1 min;98℃ 10 s,50℃ 30 s,72℃ 30 s,30 个循环;72℃ 5 min;10℃保存。PCR产物混合后用浓度为20 g/L的琼脂糖凝胶回收PCR产物,用凝胶回收试剂盒(Gene JETTM gel extraction kit)回收,并构建文库(Ion plus fragment library kit),再通过Qubit@ 2.0 fluorometer (thermo scientific)和qPCR定量,合格后用Ion S5TM XL高通量测序系统进行测序。
1.2.4 生物信息分析 通过生物信息学分析数据,从而获取准确、可靠的结果,再使用Barcode拆分获得各样本数据后用FLASH(V1.2.7)对每个样本的Reads进行拼接,得到原始数据,再对原始数据进行严格的拼接、过滤,去除干扰数据得到高质量的Tags数据。参照Qiime(V1.9.1)的Tags质量控制流程,进行排序与去除嵌合体序列,得到最终的有效数据。利用Uparse软件(Uparse v7.0.1001)基于有效数据进行OTUs聚类和物种分类分析,筛选每个OTUs的代表性序列,对每个OTU的代表序列做物种注释。为研究不同OTUs的系统发育关系以及不同样本间的优势菌群差异,用MUSCLE(Version 3.8.31)软件进行多序列比对分析,得到所有OTUs代表序列,后对各样本的数据进行均一化处理,再使用R软件进行α多样性组间差异分析与β多样性分析。通过T-test检验,Wilcox秩和检验与Tukey检验分析组间物种多样性差异是否显著。用SPSS 22.0软件进行单因素方差分析(One-way ANOVA)比较不同日龄α多样性指数组间差异,统计结果以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 DNA样品质检结果
DNA样品质检结果显示,除3个样品不合格外,其他样本均检测合格,检测不合格的3个样品用备份样品重新质检,所有样品均检测合格。
2.2 OTUs聚类分析
试验共采集样本21个,原始数据总reads共获得1 872 460条原始测序数据,通过双端拼接,获得1 761 558条序列,经质控、嵌合体过滤,获得1 281 153条reads用于后续的OTUs注释分析,平均每个样本61 007条;OTUs的总数目为12 306个,平均每个样本545个OTUs。其中,30 d(断奶后)样品具有最高数量的OTUs(OTUs平均数为689)。每个样本的公共和特有的OTU数的统计结果被用来组成图1,图1显示0 d中特有718个OTUs,5 d中特有362个OTUs,10 d中特有32个OTUs,15 d中特有56个OTUs,20 d中特有208个OTUs,25 d中特有314个OTUs,30 d中特有135个OTUs,表明7个日龄仔猪肠道中的微生物菌群存在差异。

每个椭圆代表不同日龄的仔猪。重叠和不重叠部分分别代表公共和特有的OTUs。一个OTU代表一种菌群。重叠部分中的数字代表组间共公的OTU总数,不重叠部分的数字代表不同日龄特有的OTU数。其中N00、N05、N10、N15、N20、N25、N30分别表示0 d~30 d的仔猪日龄
2.3 猪肠道菌群多样性分析
通过Alpha多样性指数分析发现,试验样本Coverage均超过99.7%,说明了此次测序结果基本反映了肠道内微生物的状况。由表1分析物种多样性差异可知,25 d仔猪Shannon指数和Simpson指数要显著低于30 d仔猪(P<0.05),表明25 d时群落多样性显著低于30 d仔猪。同时,25 d仔猪的Simpson指数也要显著低于5、10、20 d仔猪的,因此,5、10、20 d仔猪肠道菌群的多样性也要显著高于25 d仔猪的(P<0.05)。30 d时,物种观察指数和Chao1指数最高,表明群落样品中包含的物种总数最多,物种丰富度最高。除此之外,Observed species指数和Chao1指数在0 d~20 d时降低,在20 d~30 d时升高,表明在0 d~20 d时,物种丰富度呈现降低趋势,在20 d~30 d时,物种丰富度呈现增高趋势。

表1 不同日龄仔猪Alpha多样性指数统计结果
采用非加权组平均法UPGMA分析进行进一步验证(图2)。结果显示,不同日龄各个阶段肠道微生物菌群聚类为两大簇,0日龄和25日龄的样本为一簇,其中N00.2为离散样本,其他各个日龄的样本为一簇,0日龄和25日龄与其他各个日龄的肠道菌群结构存在显著差异。

图2 不同日龄仔猪样品聚类图
2.4 猪肠道菌群的组成
通过OTU样本的群落丰度对样本中的不同菌群,在门水平和属水平进行差异性分析,生成相对丰度柱状堆积图,从而分析不同日龄的样本之间菌群分布和相对丰度变化情况。
仔猪0 d~30 d在门水平上肠道菌群相对丰度分析见图3。在门水平新生仔猪肠道菌群主要由Firmicutes(43.5%)、Bacteroidota(26.9%)两个门组成,约占70.4%,但是其在每个日龄中的所占比例有所不同,Firmicutes的相对丰度在0 d(36.9%)~5 d(52.4%)时有上升趋势(P>0.05),在5 d~20 d的相对丰度基本维持稳定,差异变化不明显(P>0.05),在25 d(18.7%)时显著下降(P<0.05),30 d(47.7%)的相对丰度开始上升趋于稳定(P>0.05)。Bacteroidota的相对丰度在各个日龄中差异并不显著(P>0.05),从出生0 d(14.7%)~10 d(43.9%)整体呈现上升趋势(P>0.05),20~25 d(18.9%)时呈现下降趋势(P>0.05)。其中变形菌门(Proteobacteria)的相对丰度从0 d(35.6%)下降到20 d(1.65%),20 d(1.65%)上升到25 d(30%)。梭杆菌门(Fusobacteriota)的相对丰度从0 d上升到25 d(21.7%)。螺旋体菌门(Spirochaetota)和广古菌门(Euryarchaeota)在30 d的相对丰度分别为5.84%、4.7%,在其他日龄时均少于1%。放线菌门(Actinobacteriota)、互养菌门(Synergistota)、脱硫菌门(Desulfobacterota)在不同日龄间的差异并不显著(P>0.05)。
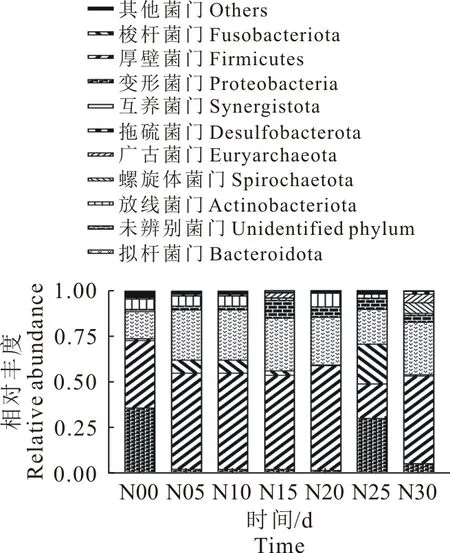
图3 门水平上的物种相对丰度
仔猪0~30 d在属分类水平上的菌属相对丰度分布见图4。在属分类水平上前10类菌属分别为青枯菌属(Ralstonia)、埃希氏菌-志贺氏菌属(Escherichia-Shigella)、梭杆菌属(Fusobacterium)、乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、理研菌科-RC9菌属(Rikenellaceae-RC9-gut-group)、拟普雷沃菌属(Alloprevotella)、双歧杆菌属(Bifidobacterium)、普雷沃式菌属(Prevotella)、密螺旋体菌属(Treponema)。断奶(25 d)前,仔猪肠道中优势菌种以Lactobacillus(占前20 d的全部菌属的19.7%)、Bacteroides(占前20 d的全部菌属的7.2%)、Escherichia-Shigella(占前20 d的全部菌属的7.2%)为主,断奶后的肠道菌群变化明显,断奶后Ralstonia、Prevotella、Ruminococcaceae-UCG-005、Alloprevotella、Treponema、Fusobacterium为优势菌群。0 d时Escherichia-Shigella显著高于30 d(P<0.05);0 d~20 d时,菌属的变化差异不显著(P>0.05),20 d时,Lactobacillus要显著高于25 d和30 d(P<0.05);25 d CHKCI001显著高于10 d~20 d(P<0.05),而Eubacterium显著高于其他日龄(P<0.05),其中Ralstonia、Rothia、CAG-873在25 d的相对丰度均比较20 d时有所上升;30 d中Alloprevotella、Prevotella、Treponema、Ruminococcaceae-UCG-005、CHKCI001的相对丰度比较0 d~25 d时均有所上升(P<0.05)。

图4 属水平上的物种相对丰度
3 讨论
本研究对不同日龄仔猪样本菌群相对丰度分析发现,在门水平进行差异性研究,其Firmicutes(43.5%)、Bacteroidota(26.9%)、Proteobacteria(11.5%)这3个门占据肠道微生物的82%,这与文献[10-11]报道一致。其中Firmicutes和Bacteroidota是肠道内2个优势菌门,约占70.4%[10]。主要成因可能是由于Firmicutes属于革兰氏阳性菌,具有十分重要的作用,例如属于厚壁菌门的乳酸杆菌属,可阻止病原菌对肠道的入侵和定植,抑制病原菌,抗感染,抑制内毒素的产生,维持肠道的微生态平衡[11];而Bacteroidota不但能够抵御病原菌的入侵,还能够降解大量的多糖以及分解碳水化合物[12]。研究表明0 d仔猪肠道的优势菌群主要是Firmicutes、Bacteroidota和Proteobacteria,但是不同菌门在不同样品中所占比例不一样,这与仔猪取样来自于不同栏舍有关。而哺乳期间(5~20 d)的仔猪肠道菌群,Firmicutes比例有所增加,Bacteroidota比例有所减少,但二者依然是优势菌门,与文献[13]报道一致,主要是由于厚壁菌门的乳酸杆菌随着进食母乳的增加逐渐占据优势,迫使Bacteroidota由于竞争抑制而减少。同期Proteobacteria的相对丰度则显著下降,这种变化可能主要与Proteobacteria中多数细菌为兼性或者专性好氧有关,当肠道中的氧被好氧细菌消耗殆尽时,好氧细菌将会被兼性厌氧菌和专性厌氧菌取代[14]。研究中仔猪断奶(25 d)时,Firmicutes和Bacteroidota所占比例均显著减少,而Proteobacteria、Fusobacteriota的相对丰度显著上升,这与现实情况相符。许多养殖场为提高生产效率,对25 d左右仔猪进行断奶,由于此时仔猪肠道微生物的组成以及各方面均未发育成熟,又受到环境、饮食等外界因素的影响,此时仔猪极易发生断奶应激,肠道菌群及结肠代谢产物也会发生显著变化[11-14],致使仔猪肠道菌群失调,而多数属于病原菌属的Proteobacteria和Fusobacteriota开始增加。断奶后1周左右时(30 d),Firmicutes和Bacteroidota的相对丰度逐渐恢复到之前的比例,这可能是由于仔猪逐渐习惯周围环境、适应新的饮食以及肠道进行自我调整而使肠道菌群趋于稳定。另外,在属水平,Bacteroides、Lactobacillus、Escherichia-Shigella、Ralstonia、Clostridium、Rikenellaceae-RC9-gut-group、Prevotella为肠道内的优势菌属,占肠道微生物的48.8%,与文献[15]研究结果一致。
对于0 d仔猪而言,肠道组织中最开始占据优势的菌种是Escherichia-Shigella、乳酸杆菌属Lactobacillus、Bacteroides,究其原因可能是通过垂直传播母猪将这些菌属带给仔猪。同时,有研究证实了仔猪出生时仔猪的粪便微生物菌群与产仔母猪阴道的微生物菌群相似[16-17]。断奶后仔猪(25 d)受到断奶应激的影响,仔猪肠道内的乳酸杆菌属和拟杆菌属显著下降;而Ralstonia、Clostridium、CAG-873显著上升。其中的Lactobacillus和Bacteroides通常被用于评价肠道的健康水平。断奶后仔猪肠道的健康水平开始出现下降是Ralstonia、Clostridium、CAG-873对肠道造成了有害作用。有研究已证明Fusobacterium具有致病性,可与肠道调节性T细胞相互作用,发挥炎症调节和过敏活性,还与炎症性肠病和腹泻在内的严重胃肠疾病相关。断奶后1周(30 d),断奶仔猪度过应激阶段,开始适应新的饮食,而此时肠道菌群主要由Bifidobacterium、Alloprevotella、Treponema、Prevotella、Methanobrevibacter、CHKCI001等菌种组成,其中Prevotella刚出生时相对丰度比较低,但断奶后,由于饮食中膳食纤维的增加,Prevotella作为膳食纤维发酵菌迅速增加,并且Prevotella能降解多糖,有助于增加糖原储存[18]。同时,Bifidobacterium作为益生菌,可以调节Treg细胞的体内平衡,并促进肠免疫球蛋白A(immunoglo bulin A,IgA)的产生。除此之外,还存在一些有害菌,使仔猪肠道菌群结构达到相对稳定状态,有些类似成年猪肠道组织。
本研究随机选择不同日龄的健康二元仔猪(大约克 × 长白猪)为研究对象,对新生仔猪肠道菌群组成以及新生仔猪不同发育阶段肠道菌群的分布和变化进行分析,仔猪断奶后的肠道菌群结构与仔猪哺乳期的肠道菌群结构存在显著差异,同一日龄段的仔猪肠道菌群组成也存在个体差异。处于不同日龄仔猪的肠道微生物,随着日龄的增加多样性具有显著性变化。不仅如此,仔猪在不同的生长日龄,虽然肠道菌群在不断的发展变化,但Firmicutes和Bacteroidota作为核心菌群是一直存在的,断奶前仔猪肠道中Lactobacillus、Bacteroides等与碳水化合物等营养物质代谢相关的菌属丰度较高,断奶后Prevotella、Ruminococcaceae-UCG-005、Alloprevotella等与纤维消化有关的菌属丰度较高。这说明肠道菌群的微生物组成在仔猪生长的不同阶段是动态变化的。

