男性体检人群血尿酸水平对前臂骨密度的影响及其与体质量指数的交互作用
刘焕欣 李忠 聂倩陈菲菲 张令霞 马慧娟
1.河北省人民医院体检中心,河北 石家庄 050051
2.石家庄市人民医院普外一科,河北 石家庄 050011
3.河北省人民医院代谢病重点实验室,河北 石家庄 050051
4.河北省人民医院内分泌科,河北 石家庄 050051
骨质疏松症(osteoporosis,OP)是一种以骨量低,骨组织微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性骨骼疾病[1]。目前我国50岁以上人群OP患病率为19.2%,50岁以下人群的低骨量率也高达32.9%,因此,加强OP的一级预防和健康管理至关重要。OP的流行受多因素影响,包括遗传、环境因素、不健康的生活方式、基础疾病和药物等[2]。除传统因素外,近年国内外研究开始关注血清尿酸(serum uric acid,SUA)水平对于OP的影响。研究表明,氧化应激可影响OP的发生发展[3]。SUA作为一种强内源性抗氧化剂,可抑制破骨细胞前体氧自由基的生成,降低骨转换率,可能为OP的保护因素[4]。然而,也有研究认为,SUA与男性骨质疏松性骨折呈“U”型关系或无明显相关性[5-6]。可见,对SUA水平与OP的关系研究并未得到一致结论。
研究显示,与女性相比,男性前臂OP的发生率更高[7-8]。在50岁及以上的男性人群中,前臂远端的骨质流失以相同速率持续存在,其低骨密度(bone mineral density,BMD)水平不仅反映了脊柱或髋关节的低BMD状态,而且与死亡率增加显著相关[9-10]。此外,随着前臂BMD水平下降,腕部脆性骨折风险将明显升高,这可导致长期活动受限,造成重大公共卫生负担[11]。由于目前关于SUA在男性人群中与前臂远端BMD的相关性研究较少,因此,本研究拟探讨50岁及以上男性体检人群SUA与前臂远端BMD的关系,同时分析影响因素间的交互作用。
1 资料与方法
1.1 研究对象
收集2020年1~12月于河北省人民医院体检中心进行年度体检的人群。纳入标准:①年龄≥50岁男性;②调查问卷和相关检查项目数据完整。排除标准:①患慢性肝肾疾病、急性感染性疾病、恶性肿瘤等影响骨代谢疾病者;②6个月内使用过影响骨及尿酸代谢水平药物者;③吸烟、滥用酒精、既往有骨折病史者;④备孕妊娠哺乳妇女。最终2 270名体检者被纳入研究,年龄50~88岁,平均年龄(59.96±8.36)岁。以上研究对象均知情同意,并通过河北省人民医院伦理委员会批准(审批号:2020662)。
1.2 研究方法
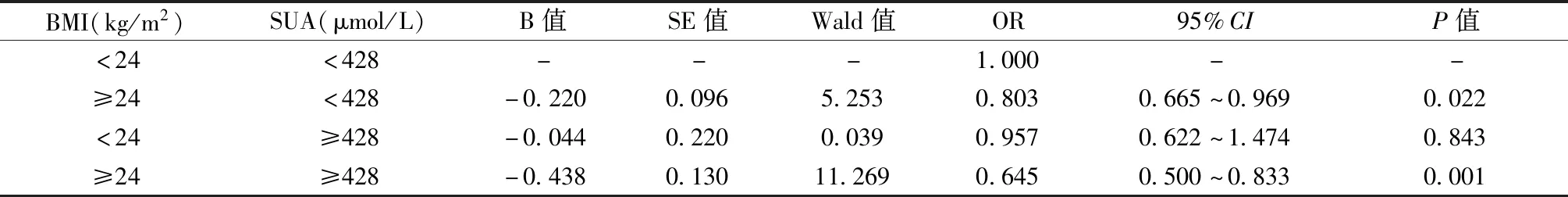
收集研究对象的性别、年龄、既往史、目前用药史等基本信息,测量身高、体重、腰围(WC),计算体质量指数(body mass index,BMI)。采用欧姆龙HEM-7125型血压计测量静息状态的血压,测量3次取平均值。抽取空腹静脉血5 mL,3 000 r/min离心15 min,收集血清。采用日立7 600-110型全自动生化测定仪测定SUA、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等。采用OsteoSys EXA-3000型双能X线骨密度仪测定非优势侧前臂桡骨远端1/3处BMD值。OP的诊断标准参照2017年版《中国原发性骨质疏松症诊治指南》[2],T值≥-1.0为骨量正常,-2.5 男性SUA水平在正常范围者按四分位分为Q1~Q4组,高于正常范围者为 Q5 组。Q1组<311 μmol/L,311 μmol/L≤Q2组<356 μmol/L,356 μmol/L≤Q3组<402 μmol/L,402 μmol/L≤Q4组<428 μmol/L,Q5组≥ 428 μmol/L。 与骨量正常组相比,骨量减少组的年龄、收缩压(SBP)、HDL-C水平升高,BMI、eGFR、BMD和T值水平降低(P<0.05)。与骨量正常组相比,骨质疏松组的年龄、SBP、高血压、冠心病、脑血管病的患病率均增加,BMI、SUA、eGFR、BMD、T值水平显著降低(P<0.05)。骨质疏松组的年龄、SBP、冠心病、脑血管病患病率均高于骨量减少组,SUA、eGFR、BMD、T值水平均低于骨量减少组,差异具有统计学意义(P<0.05)。三组间余指标差异无统计学意义(P>0.05)。见表1。 表1 不同骨量状态下研究对象的基本特征比较Table 1 Comparison of basic characteristics among research subjects in different bone mass status 2 270名研究对象中,Q1~Q5组的BMD值、T值、骨量减少患病率、骨质疏松症患病率比较,差异均有统计学意义(P<0.05)。见表2。 表2 不同SUA水平研究对象的骨量比较Table 2 Comparison of bone mass among research subjects in different SUA levels Pearson相关分析显示,BMD值与BMI、TC、TG、LDL-C、SUA、eGFR呈正相关性,与年龄、SBP呈负相关性(P<0.05);T值与BMI、LDL-C、SUA、eGFR呈正相关性,与年龄、SBP呈负相关性(P<0.05)。余指标不具有相关性(P>0.05)。见表3。 表3 BMD值、T值与各代谢指标的相关性Table 3 Association between BMD value, T value, and metabolic indicators 以骨量异常情况(骨量正常=1,骨量减少=2,骨质疏松=3)为因变量,分别以年龄、BMI、SBP、TC、TG、LDL-C、SUA、eGFR、糖尿病、高血压、冠心病、脑血管病为自变量并进行赋值。单因素Logistic回归分析显示,年龄、BMI、SBP、TG、SUA、eGFR、患有糖尿病、高血压、冠心病和脑血管病是骨量异常的影响因素(P<0.05)。 以单因素Logistic回归分析中有统计学差异的变量为自变量,经有序多分类Logistic回归分析显示,在调整其他变量的影响下,年龄、SBP、患有高血压与骨量异常的风险呈正相关性,BMI、SUA与骨量异常的风险呈负相关性(P<0.05)。见表4、5。 表4 影响骨密度的变量定义及赋值Table 4 Definition and assignment of variables affecting bone mineral density 表5 骨量异常影响因素的Logistic回归分析Table 5 Logistic regression analysis of influencing factors of abnormal bone mass 多因素分析结果表明,骨密度的影响因素较多,各因素间可能存在交互作用,本研究运用相乘和相加效应模型进行分析。在BMI与SUA的交互作用分析中,将BMI分为<24 kg/m2和≥24 kg/m2两层,SUA分为<428 μmol/L和≥428 μmol/L两层,并根据BMI和SUA是否正常分成4类,以<24 kg/m2和SUA<428 μmol/L为参照,应用有序多分类Logistic回归分析其他三类的效应(OR值)。结果显示,调整相关影响因素后,BMI与SUA间的相乘交互作用差异有统计学意义(似然比χ2=199.060,df=11,P<0.01),各分类的OR值及95%CI见表6。两者相加交互作用指标RERI、AP和S的估计值(95%CI)分别为-0.114(-0.622,0.394)、-0.177(-0.980,0.627)和1.475(0.189,11.485),说明二者不存在相加交互作用。 表6 BMI与SUA对骨量影响的交互作用分析Table 6 Interaction analysis of the effect of BMI and SUA on bone mass SUA是嘌呤代谢的主要产物,与高血压、心血管疾病及肾结石等疾病的风险密切相关[12]。但近年研究发现,SUA具有抗氧化损伤的作用,可改善衰老和OP等疾病相关的氧化应激反应[13-14]。目前SUA水平与OP之间的关系已成热点研究问题,但结论尚存在争议。本研究以50岁及以上男性人群为研究对象,探讨前臂BMD与SUA水平的相关性。结果显示,与前臂骨量正常组相比,骨量减少组和骨质疏松组的SUA水平均显著降低;与骨量减少组相比,骨质疏松组的SUA水平也有所降低。在双变量相关性分析中,前臂BMD和T值均与SUA水平呈正相关性。经过校正多项混杂因素后,SUA水平升高与前臂OP的风险降低有关,提示SUA是男性OP的保护因素,这可能与SUA以剂量依赖方式降低破骨细胞的生成并减少破骨细胞前体生成活性氧物质有关[15]。因此对于男性人群,保持适当水平的SUA有助于维持骨量及降低OP的发生率。Hwang等[16]研究发现,在健康成年男性中,SUA水平与腰椎BMD呈正相关,与骨转换和椎体骨折的患病率呈负相关。Ibrahim等[17]对2 981名健康成年人的横断面研究显示,较高水平SUA与股骨颈、髋部和骨盆的BMD增加显著相关,SUA最高四分位者OP或骨质减少的风险显著降低。上述结论与本研究结果一致。体外实验发现,尿酸以浓度依赖的特点促进Wnt-3a/β-catenin信号通路及CBF-α-1/Runx2的高表达,从而正向调控骨髓间质干细胞向成骨细胞分化[18-19]。但也有一些研究结论与此相悖。Zhang等[20]构建的诱导型轻度高尿酸血症的大鼠模型,与正常SUA水平的对照组相比,其BMD、体积骨密度和骨生物力学特性无明显差异。另有研究报道,当SUA水平明显升高时,会形成尿酸结晶沉积于肾间质及关节周围,从而抑制成骨细胞的增殖,并引起骨破坏,加重OP[21]。 本研究发现BMI也是男性OP的保护性因素。研究认为BMI较高者骨骼负重增加,这可促进成骨细胞的增殖和分化,抑制破骨细胞的凋亡,促进骨的形成,降低骨转换,增加BMD和骨骼强度[22-24]。本研究中,BMI与SUA对骨密度的交互作用分析结果显示,BMI与SUA存在相乘交互作用,但不存在相加交互作用。提示在男性BMI<24 kg/m2人群中,SUA<428 μmol/L时,发生OP的风险更大,但对这部分人群的SUA水平进行干预并不能获得更大的公共卫生效益。本研究显示年龄、SBP水平、既往高血压病史是男性OP发生的危险因素,这为今后OP的防治提供了依据。因此,不仅要对既往有高血压病史的患者进行干预,同时也要对本次体检SBP偏高的人群进行血压监测及健康管理,以降低OP的发生风险。 本研究结果为男性OP的防治提供了临床参考,为下一步研究提供了新思路。但本研究未对日照时间和饮食运动等影响BMD的其他因素进行研究,同时未探讨在男性人群中,SUA水平与骨质疏松性骨折的相关性。未来还需进行大规模长时间的流行病学和前瞻性研究,以探索该相关性、合适的SUA阈值及其可能机制,为男性OP和骨质疏松性骨折的防治提供更多依据。 综上所述,在50岁及以上的男性体检人群中,年龄、SBP、患有高血压是骨量异常的危险因素,BMI、SUA是骨量异常的保护因素,BMI与SUA之间存在相乘交互作用,但不存在相加交互作用。需要重点关注SUA、BMI和血压等指标的波动,通过早期干预SUA、体重和血压水平,达到预防和延缓OP进展的目的。1.3 SUA水平分层
1.4 统计学方法
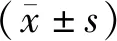
2 结果
2.1 研究对象的基本特征

2.2 不同SUA水平研究对象的骨量比较
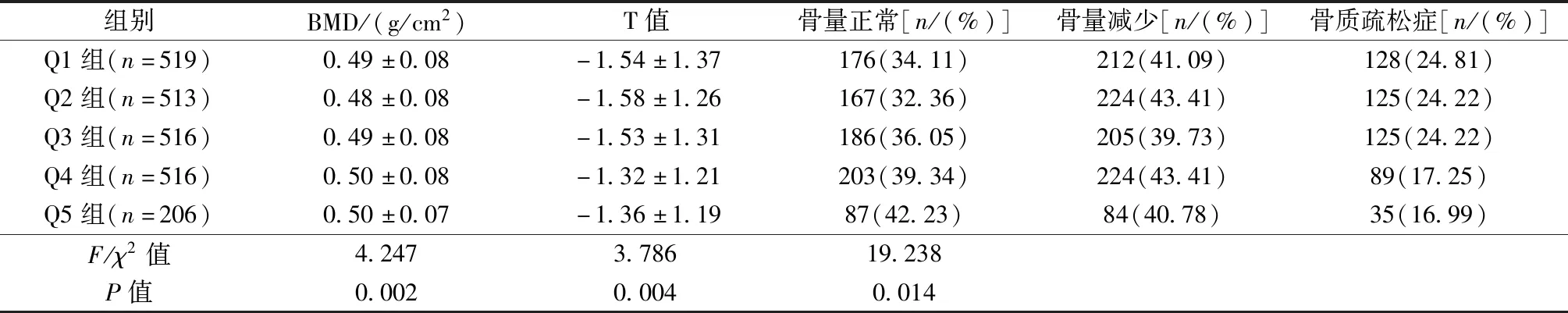
2.3 BMD值、T值与各代谢指标的相关性
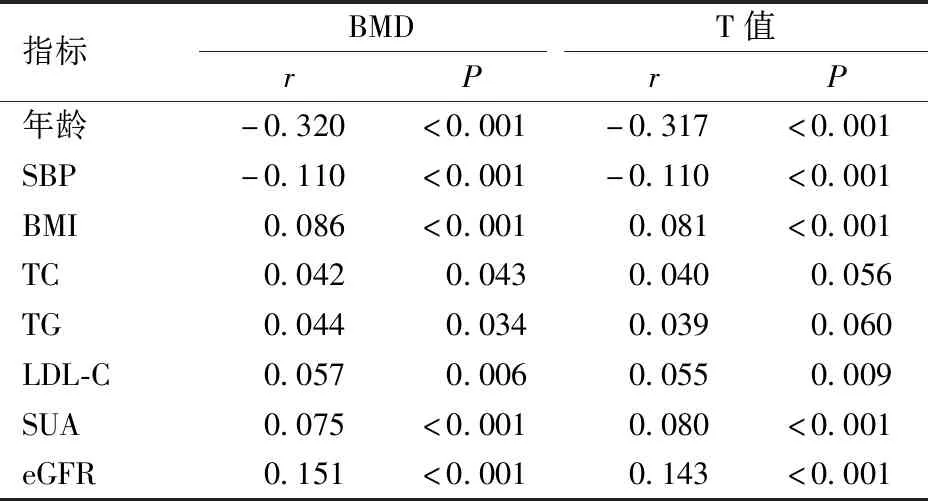
2.4 骨量异常影响因素的Logistic回归分析

2.5 SUA与BMI对骨量影响的交互作用分析
3 讨论

