乳腺癌的淋巴引流及前哨淋巴结分布规律的研究进展*
杨俊杰 综述 白俊文 审校
(内蒙古医科大学研究生学院,呼和浩特 010010)
淋巴系统是乳腺癌的重要转移途径,主要包括腋窝、内乳、锁骨下、锁骨上和胸肌间淋巴结,转移可能性分别为98.2%、35.3%、1.7%、3.1%、0.7%[1]。区域淋巴结状态是乳腺癌患者分期、预后、辅助治疗方案制定的重要影响因素。既往针对内乳、腋窝等区域的处理主要采用淋巴结清扫术。但清扫内乳淋巴结(internal mammary lymph node,IMLN)并不会提高患者的远期生存率[2],并且对于腋窝淋巴结(axillary lymph node,ALN)阴性的患者,清扫淋巴结无治疗意义,还有可能出现上肢水肿、感觉异常和运动障碍等并发症。
前哨淋巴结活检(sentinel lymph node biopsy,SLNB)技术无疑为乳腺癌患者带来福音,已成为早期乳腺癌腋窝处理的标准术式[3]。前哨淋巴结(sentinel lymph node,SLN)是指接受原发灶引流的首站淋巴结。乳腺和皮肤的淋巴引流较肺、胃、胰腺等内脏器官简单,因此,SLN通常可代表区域淋巴结病理学状态[4,5]。对于SLN阴性的患者可免除淋巴结清扫,减少手术并发症,改善患者生活质量。SLNB的实现基于淋巴网络交通及淋巴液流动理论[5],离不开示踪剂的帮助,目前指南推荐的示踪剂为蓝染料(如亚甲蓝)和核素(如99mTc-硫胶体)[3]。此外,CT淋巴造影(computed tomographic lymphography,CT-LG)、荧光示踪、超声造影以及超顺磁性氧化铁纳米粒子(superparamagnetic iron oxide nanoparticle,SPION)示踪等技术也在SLN示踪方面崭露头角。本文基于示踪技术在乳腺癌中的发展,总结乳腺癌的淋巴引流及SLN分布规律,分析罕见位置SLN的影响因素,旨在为SLNB在乳腺癌中的应用提供参考。
1 腋窝、内乳区域的淋巴引流规律
1.1 腋窝区域的淋巴引流规律
尸检结果显示腋窝淋巴主要分为4个引流链[5]:乳腺外侧链位于腋窝前壁、腋血管的近心端,沿乳腺外侧血管排列,其优势支将淋巴引流至胸上链和腋静脉链;胸上链位于腋窝内壁、胸肌后方,沿胸上血管排列,将淋巴引流至腋静脉链;肩胛下链位于腋静脉水平,主要接受胸廓后壁及少部分前内侧壁的引流,其优势支将淋巴引流至乳腺外侧链及腋静脉链;腋静脉链位于腋窝顶端,接受上肢、胸廓前后壁以及上述淋巴链的引流,最终其输出淋巴管注入胸导管[5]。根据淋巴的逐级引流规律,腋窝前哨淋巴结(axillary sentinel lymph node,A-SLN)最有可能位于乳腺外侧链、胸上链、肩胛下链所在的腋窝前内侧壁、腋静脉水平附近。
淋巴管与SLN的连接方式有4种:A型为单根淋巴管连单个SLN(70.0%),B型为多根淋巴管连单个SLN(8.0%),C型为单根淋巴管末端分叉后连多个SLN(10.2%),D型为多根淋巴管连多个SLN(11.8%),见图1[6]。若手术切口设计较偏且示踪方法单一,分叉及多根淋巴管(即C型和D型)所连接的SLN可能漏检,造成假阴性结果,见图2[7]。
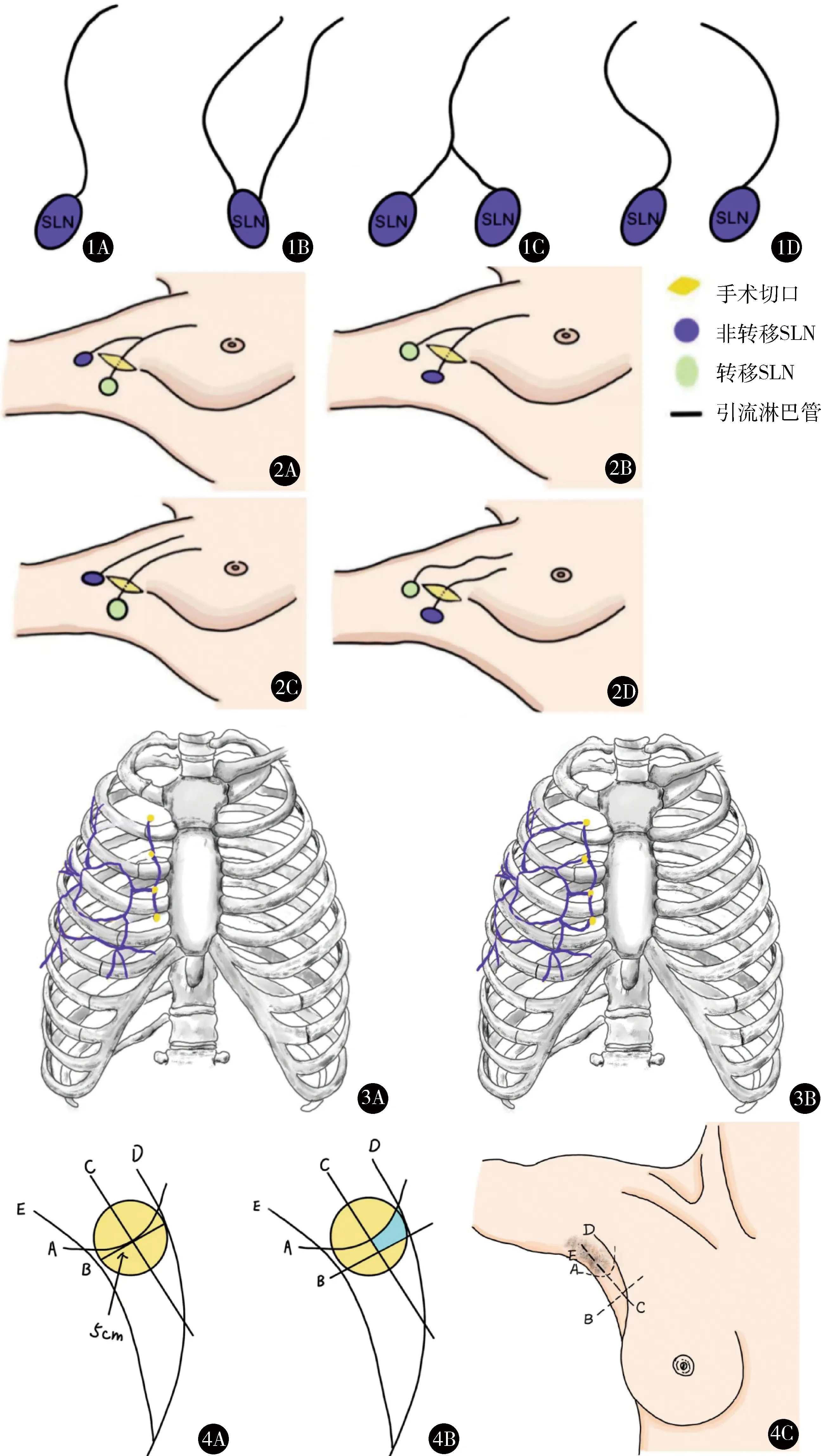
图1 淋巴管与SLN连接方式[6] A.单根淋巴管连单个SLN;B.多根淋巴管连单个SLN;C.单根淋巴管末端分叉后连多个SLN;D.多根淋巴管连多个SLN 图2 仅用亚甲蓝进行示踪可能出现假阴性结果[7] C型连接方式:A.切口中仅发现淋巴管的1个蓝染分支连接转移SLN,另1支连接非转移SLN,漏检SLN但未导致假阴性结果;B.切口中仅发现淋巴管的1个蓝染分支并连接非转移SLN,另1支连接转移SLN,漏检SLN并导致假阴性结果。D型连接方式:C.切口中仅发现1支蓝染的淋巴管连接转移SLN,另一支连接非转移SLN,漏检SLN但未导致假阴性结果;D.切口中仅发现1支蓝染的淋巴管连接非转移SLN,另1支连接转移SLN,漏检SLN并导致假阴性结果 图3 IMLN引流模式的2种假设[13] A.乳腺不同区域淋巴引流至同一肋间同一群IM-SLN,然后再由此群淋巴结逐级向后引流;B.乳腺不同区域淋巴引流至不同肋间各自的IMLN 图4 A-SLN的术前体表定位 A.Cox等[14]划定的区域(黄色);B.Lo等[15]划定的区域(蓝色);C.Lo等[15]用于体表定位A-SLN的辅助线
1.2 内乳区域的淋巴引流规律
胸廓内动静脉在距胸骨外缘1.0~1.5 cm、第1~6肋软骨的后面纵行,IMLN沿胸廓内血管排列,距离胸骨外缘约1.0~3.0 cm[8]。虽然靠近胸骨外缘,但IMLN也接受乳腺所有象限的淋巴引流(内上象限17%、内下象限25%、外上象限10%、外下象限27%、中央区29%),是乳腺癌的重要转移途径之一[9]。两侧内乳淋巴链可在胸骨后形成交通支,这是乳腺癌原发灶向对侧转移的解剖基础[10]。IMLN的输出淋巴管注入纵隔前淋巴结,参与合成支气管纵隔干,后者在左侧注入胸导管,在右侧形成右淋巴导管[10]。
既往针对IMLN引流模式有2种假设[11]:一种是乳腺不同区域淋巴引流至同一群IM-SLN,然后再由此群淋巴结逐级向后引流,相当于腋窝的前哨及前哨后淋巴结[12];另一种是乳腺不同区域淋巴引流至各自的IMLN(图3)。只有IMLN的引流模式为前者时,IM-SLN的病理状态才可以反应整个内乳淋巴链的情况,行IM-SLNB才是有意义的。Cao等[13]将小分子核素示踪剂99mTc-右旋糖酐40注入30例乳腺癌的乳腺实质内,然后行单光子发射型计算机断层扫描(single photon emission computed tomography,SPECT)/CT确定淋巴引流方向及IMLN的位置,注射后(10.5±0.35)min注射点至内乳区域的引流淋巴管显像,随后示踪剂聚集在首站IMLN,然后次级淋巴结接受首站IMLN的引流,淋巴引流在内乳区域逐级进行,从而证实了第一种假设。目前,还没有内乳淋巴引流链的解剖学证据,相关临床试验正在进行当中[11]。
2 乳腺癌腋窝前哨淋巴结的分布规律
2.1 术前体表定位
术前体表定位有助于术者设计手术切口,是准确寻找SLN的第1步。利用γ射线探测仪可以于体表定位A-SLN,探寻其分布规律。患者需于术前3~18 h在肿瘤表面、乳晕区的皮内或皮下注射核素示踪剂[3],然后在切开皮肤前使用手持式γ射线探测仪缓慢、有序扫描腋窝皮肤,标记热点值最高的位置。Cox等[14]研究显示94%的A-SLN位于以腋毛区下缘与腋中线交点为中心、直径5 cm的圆形区域内。Lo等[15]利用腋毛区下缘(A线)、与腋毛区下缘切线相距2 cm的平行线(B线)、腋中线(C线)、胸大肌外侧缘(D线)以及背阔肌前缘(E线)将腋窝分为7个区,A-SLN位于1、2、3区的患者占总体的98.4%(958/974),比Cox划定的区域更小、更精确(图4)。刘皓希等[16]通过术中解剖证实:对于不存在腋弓的患者,A-SLN的常规位置的体表投影点位于腋毛区下缘1~2 cm处, 与Lo等[15]的研究结果相符合。中国早期乳腺癌前哨淋巴结活检手术临床实践指南(2022版)[17]推荐的切口为腋毛区下缘长4~5 cm的顺皮纹切口。
患者注射核素后可进一步行淋巴显像判断是否示踪成功。γ相机虽可实现74.8%~90.6%的A-SLN平面显像[18],但因空间分辨率低、缺乏解剖标志等因素在A-SLN精准定位方面存在局限性。将平面显像和CT相结合的混合成像技术SPECT/CT可以克服上述缺点,对于平面显像未找到SLN或考虑非常规区域淋巴结显影,以及既往行乳腺手术或对侧摄取、体重指数高、怀疑核素污染的患者有重要价值[19]。SPECT可示踪淋巴引流并识别SLN,集成CT可定位其解剖位置。卢承慧等[20]报道对118例乳腺癌行SPECT/CT检查观察到248枚SLN,其中53.6%(133/248)的SLN位于腋窝Ⅰ区,21.4%(53/248)位于腋窝Ⅱ区,18.1%(45/248)位于腋窝Ⅲ区,6.9%(17/248)位于非腋窝区。
此外,CT-LG联合三维重建[21]、荧光成像技术[22]、经皮超声造影[23]以及SPION示踪[24]等方法可以实时、动态、个体化、准确定位A-SLN并标记淋巴管走行,与染料法及核素法相互补充,提高SLNB成功率。
2.2 术中解剖定位
A-SLN常隐匿在腋窝脂肪中不易识别。患者术前10~15 min注射亚甲蓝,术中沿蓝染淋巴管进行解剖,找到并完整切除蓝染淋巴结。通过亚甲蓝单示踪SLNB和腋窝逆向淋巴示踪(axillary reverse mapping,ARM)技术,富泽龙等[25]报道距离腋静脉下缘0~2.0 cm的腋窝区域是上肢淋巴结的集中分布区域,距离腋静脉下缘 2.0~4.0 cm 的区域是A-SLN的集中分布区域,在此集中区域解剖既可保证A-SLN数量,又能保护上肢淋巴结,减少上肢淋巴水肿的发生。另外,上肢淋巴结和A-SLN有约12%重合率,重合淋巴结一般位于腋静脉下缘2 cm左右的位置,二者不可完全区分,这也是SLNB不能完全避免上肢淋巴水肿发生的原因[25,26]。
腋弓(axillary arch,AA)的存在会改变正常腋窝组织结构,从而对A-SLN的分布产生影响。AA是腋窝后壁延伸至前壁的肌性解剖变异,因其形似弓形,故名腋弓,在体表可表现为“索条状”腋窝包块。其通常由背阔肌前缘发出,走行于腋窝血管神经束前方,止于胸大肌外侧缘或邻近结构。AA长7~10 cm,宽5~15 mm,人群变异率约为5.3%[27,28]。AA分为浅弓和深弓,深弓可诱发腋静脉血栓形成,浅弓可干扰A-SLN分布,使SLNB复杂化[27]。刘皓希等[16]研究显示存在AA的患者其A-SLN更有可能位于AA周围致密的脂肪层内,也就是背阔肌与腋静脉相交处。Sang等[29]率先提出“背阔肌旁淋巴结”的概念,即AA外侧区域的淋巴结。沿蓝染淋巴管解剖,A-SLN可位于该区域,且其引流淋巴管也因AA的存在被拉长[30]。此外,A-SLN也可被AA肌束包裹或覆盖[31,32],初学者可能会忽视该类A-SLN的存在导致漏检,从而造成假阴性结果。此时影像科医生的角色便显得尤为重要。影像科医生对AA的了解可提高对该种变异的识别率,与术者沟通后可完善手术预案,提供更精准、安全的医疗方案[28,32]。有学者[31,33]认为当存在以下情况时,离断AA是安全和推荐的方法:①大多数淋巴结被AA包裹或覆盖;②被包裹或覆盖的淋巴结可疑阳性;③AA的存在会使术后上肢水肿风险增高。除此之外应尽可能通过温柔的钝性分离操作保留AA。
3 乳腺癌内乳前哨淋巴结的分布规律
Barros等[8]对29具女性尸体进行解剖显示,IMLN多数位于肋间,而不是肋后;它的位置分布并不均匀:通常在第2肋间位于胸廓内动脉的外侧,在第3、4肋间位于胸廓内动脉的内侧,总体呈由外上向内下走行的趋势;第2、3肋间均至少存在1枚IMLN,其中第3肋间的数量最多。王永胜等[34]使用核素示踪剂对126例乳腺癌行IM-SLNB,观察到位于第1~5肋间的IM-SLN分别为14、84、70、18、2枚,其中第1~3肋间IM-SLN数占总数的89.3%(168/188)。王雪等[35]通过回顾97例初诊乳腺癌的SPECT/CT 图像,结果显示第1~3肋间是IMLN引流的主要区域(94.9%,129/136),从而将该区域作为预防性照射的合理靶区范围。
虽然IMLN直径小(<0.5 cm)、位置深,且肋间隙通常较窄、富含细小血管,但对于熟悉局部解剖结构和操作精细的术者,IM-SLNB是安全的[8,11]。目前各大指南对IM-SLNB的适应证均无明确阐述,Qiu等[36]认为对于临床ALN阳性的患者,常规行IM-SLNB能有较大获益。
4 乳腺癌SLN罕见位置
SLN虽然是接受引流的首站淋巴结,但不一定是最靠近原发部位的淋巴结。Serrano-Vicente等[37]研究内乳淋巴引流时意外发现位于纵膈以及锁骨上、下区域的SLN。Raghoo等[38]报道1例左乳癌保乳术后乳癌再发,该患者二次保乳时接受淋巴显像:平面显像提示对侧腋窝和同侧椎旁区域的淋巴引流,SPECT/CT 随后确认2个区域SLN的存在。Lizarraga等[39]回顾性研究结果显示,示踪剂注射后越过身体中线引流至对侧的现象比较罕见(0.2%,2/988),可能与肿瘤细胞浸润引起的淋巴管阻塞或手术、放疗干预引起的淋巴管损伤,导致出现新的替代淋巴引流途径有关[39~41]。目前指南[3]推荐:对于初次腋窝SLNB,术前淋巴显像并非必需;对于保乳术后同侧复发或再发患者的再次SLNB时,术前淋巴显像有重要临床价值,有助于确定常规区域以外的SLN。
5 小结
掌握乳腺癌的淋巴引流和SLN分布规律有助于术前影像识别、手术切口设计、快速寻找SLN以及放疗靶区规划,从而避免淋巴结过度切除及副损伤,缩短学习曲线,提高活检成功率。腋窝、内乳区域的SLN位置较固定,但要考虑到解剖变异对SLN分布的影响;对于既往接受过乳腺及腋窝治疗的患者,要注意有罕见位置SLN的可能。无论其位置如何,SLN均可能发生转移,未来随着示踪技术的发展和普及,定将实现SLN的个体化、精准定位,对所有真正的SLN进行活检。

