单孔胸腔镜复杂肺段切除术在直径≤2 cm磨玻璃结节中的应用
陆佳昊 谢 骏 唐 佳 韩 松 陈晓春 周开国
(苏州科技城医院胸外科,苏州 215153)
随着低剂量螺旋CT的广泛应用,以磨玻璃结节(ground-glass nodule,GGN)为主要表现的早期肺癌检出增多[1]。传统观点肺癌的标准手术方式为肺叶切除。随着医学的发展,研究的深入,对于早期肺癌,尤其≤2 cm的GGN,解剖性肺段切除成为I类推荐证据,远期生存率与肺叶切除无明显差异[2,3]。解剖性肺段切除可分为简单和复杂肺段切除[4],复杂肺段切除是指除双侧S6、左侧S1+2+3(固有段)和左侧S4+5(舌段)切除术之外的肺段切除,或者切割面是多个平面的肺段切除[5]。单孔胸腔镜下复杂肺段切除难点主要是段间平面无法区分;肺门处的血管、支气管较多,处理时很容易损伤或错断段间血管、支气管等意外,从而出现活动性出血、肺不张、切割面皱褶、肺淤血等严重并发症;以及单孔腔镜手术操作空间小、视野暴露困难等不利因素,导致这种手术方式没有常规开展。2019年1月~2021年12月,我科对58例以直径≤2 cm GGN为主要表现的早期肺癌行单孔胸腔镜复杂肺段切除,术后双微管引流,围术期实施加速康复外科(enhanced recovery after surgery,ERAS)措施,无严重并发症,报道如下。
1 临床资料与方法
1.1 一般资料
本组58例,男30例,女28例。年龄27~76岁,(55.2±12.0)岁。9例干咳,49例无症状体检发现肺部结节。CT显示结节为纯磨玻璃36例,混合磨玻璃22例,均有恶性肿瘤影像学特征(其中血管征51例,空泡征46例,短毛刺样37例,分叶征29例,胸膜牵拉征23例),距脏层胸膜0.1~5.8 cm,(3.3±1.6)cm。结节位于段面之间或较深肺段内,左肺21例,右肺37例,数量1~4个,(1.7±0.8)个;直径0.8~2 cm,(1.2±0.3)cm,其中16例直径<1.0 cm,32例直径1.0~1.4 cm,10例直径≥1.5 cm。术前与呼吸内科、肿瘤科、放射科等多学科会诊,未行穿刺活检。术前行血常规、尿常规、粪常规、生化全套、电解质、凝血常规、胸部CT、肺功能检查,年龄>60岁加做心脏超声检查,均未行头腹部CT、骨扫描等检查[6]。合并慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)17例,其余无心肺疾病等病史。
单孔胸腔镜复杂肺段切除纳入标准:①术前薄层CT显示主病灶最大直径≤2 cm的GGN,实性成分≤50%,同时结节具有至少一种恶性肿瘤影像学特征(血管征、空泡征、短毛刺征、分叶征、胸膜牵拉征),纵隔内无直径≥1 cm淋巴结;②通过Mimics Research 21.0软件行气管和血管三维重建,确定病灶位于复杂肺段;③美国东部肿瘤协作组(ECOG)评分0~2分。
排除标准:①合并严重器质性疾病;②急诊手术;③既往有血液病史、重大外伤史及恶性肿瘤以及抗肿瘤治疗(包括介入化疗栓塞、消融、放疗、化疗以及分子靶向治疗等病史)。
1.2 手术方法
术前气管和血管三维重建定位结节并且明确需切除的靶段[7,8],无需其他术前定位。双腔气管内插管、健侧单肺通气,静吸复合全身麻醉。一般取健侧90°卧位,行下肺基底段特别是S9+10或S10手术时可侧俯卧位。采用30° STORZ高清胸腔镜。第5肋间背阔肌前缘3~4 cm切口,经肋床进胸,使用4~6 cm橡胶切口保护套(芸迪SGQA60/50-50/100,江苏萨格瑞尔医疗科技有限公司),器械均为双关节器械,腔镜直线切割吻合器采用ELC50(苏州朗特斯医疗科技有限公司)或ENDO-GIA(美国Covidien)。有胸腔粘连者先分离粘连。规划靶位切除,以结节为中心,距边缘2 cm以上为安全切除范围,根据术前血管和气管三维重建设计切除肺段范围。肺段切除秉承“以气管为中心,动脉优先,弱化静脉”的原则进行手术,根据术前规划进行靶段气管、血管离断。如肺裂发育好,则采用传统的肺裂入路,在叶间裂间打开胸膜,寻找辨别靶段气管和血管,一般先处理肺动脉,再处理气管、静脉,但在处理一些复杂肺段和联合肺段时,先处理静脉,特别是一些特殊的联合亚段切除,需要先离断段间静脉,如RS2b+3a切除时,需要先进行V2c离断,并将中心静脉牵拉开,才能完全暴露B2b和B3a。如肺裂发育不全,特别是肺裂不发育,手术比较困难,一般使用腔镜直线切割吻合器进行人工分离肺裂。特别是右上叶肺段S2和S3及其亚段切除时,尽量将水平裂和斜裂完全打开,方便明确靶段血管和非靶段血管。采用改良的充气萎陷法进行段间平面判断[9],本组17例合并COPD者此法效果较差,只能通过准确辨别段间静脉,沿段间静脉尽量向肺胸膜面游离,人工分离段间平面。段间平面的游离在段根部使用能量器械电凝钩或超声刀进行,近胸膜面使用腔镜直线切割吻合器进行切割。切除的肺段置入取物袋中经操作孔取出,行术中快速病理检查,明确病理性质及亚型。淋巴结采样的原则:原位腺癌(adenocarcinoma in situ,AIS)不进行纵隔淋巴结采样或清扫;微浸润腺癌(microinvasive adenocarcinoma,MIA)进行区域淋巴结采样(10~12组)及部分纵隔淋巴结采样;浸润性腺癌(invasive adenocarcinoma,IAC)按照NCCN指南进行系统淋巴结清扫。术中试漏气,维持气道压20 cm H2O,出现漏气均使用4-0 Prolene线进行创面缝合,亚段支气管破口2例使用4-0 Prolene线缝合创面,1例主支气管破口使用3-0 Prolene线缝合。4例合并COPD者使用生物蛋白胶(倍绣胶,广州倍绣生物技术有限公司)进行肺创面喷洒。术后使用双微管技术进行胸腔闭式引流:从切口置入10~12F猪尾导管(邦可通,江苏昱邦医械科技有限公司),在肺复张的情况下经胸腔镜引导放置到胸顶,接水封瓶;肩胛下线8~10肋间置入7F猪尾导管(邦可通)或ARROW管(郑州迪奥医学技术有限公司)接引流袋。切口采用罗哌卡因进行皮下浸润麻醉,4-0可吸收线皮内缝合关闭切口。
术后采用ERAS流程[10]:患者清醒后即高坐位,咀嚼口香糖,漱口、刷牙,2小时进流质(多维碳水化合物饮品1瓶),4小时后正常进食半流质,床上骑单车,呼吸训练器进行呼吸训练促进肺复张。
2 结果
全组58例均顺利完成目标靶段切除,包括复杂肺段(21例)、联合肺段(24例)、肺亚段(2例)、联合肺亚段(11例)切除,无结节漏切、切缘阳性及血管损伤出血后被迫肺叶切除等意外情况发生,具体手术方式见表1。3例另加5 mm小切口,以置入电凝钩或超声刀方便分离胸膜粘连,其中2例在第3肋间加切口处理胸顶粘连,1例在第8肋间加切口处理膈肌粘连,均成功。1例全胸腔广泛致密粘连,松解粘连时出血,中转开胸止血并完成手术(本例手术时间、胸管留置时间、住院时间均最长,术中出血及胸腔引流液量均最多,术后积极呼吸道护理、加强营养、输入悬浮红细胞及血浆等,治愈出院)。不全肺裂36例,术中26例肺创面修补,4例合并COPD者使用生物蛋白胶。
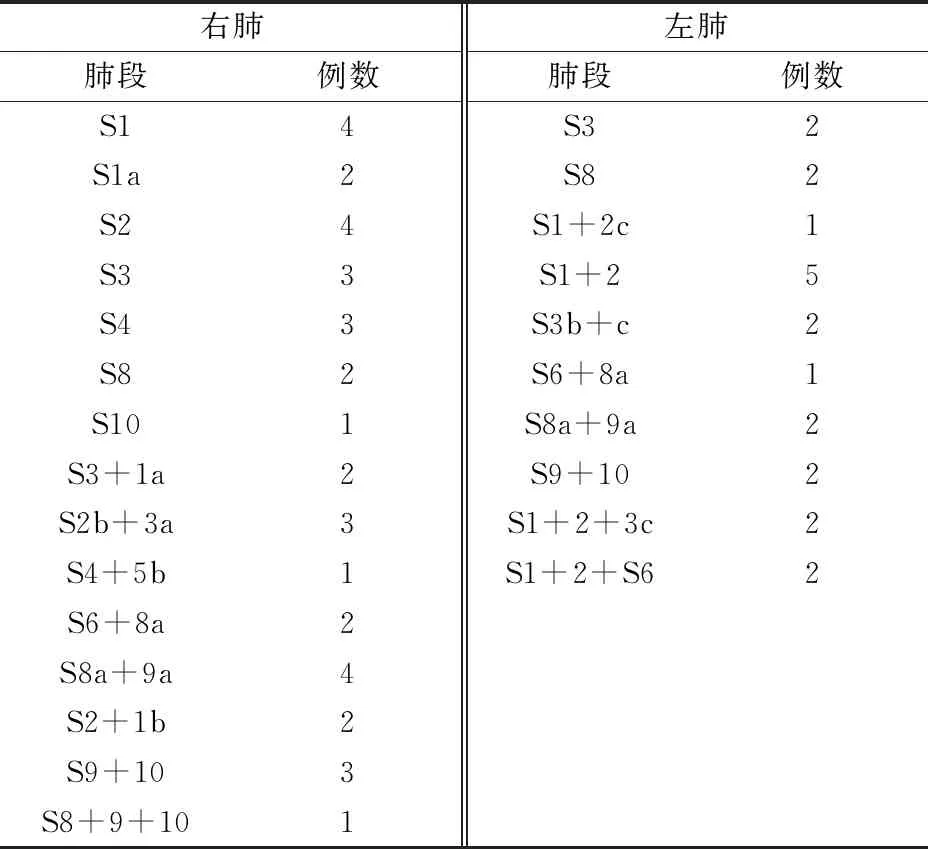
表1 58例复杂肺段切除的部位和例数
手术时间50~286 min,(170.9±44.1)min,其中1例胸腔广泛致密粘连,腔镜下松解时出血,中转开胸,手术时间286 min,1例合并COPD者右肺S10切除,术中需间断性双肺通气维持脉搏氧饱和度,同时S10并不直接面对叶间裂,必须沿S6和S8段间的边界从斜裂切至S10,它们之间无标志性边界,手术时间280 min,1例术中纵隔淋巴结清扫时不慎损伤主支气管,使用3-0 Prolene线修补,手术时间265 min,2例纵隔淋巴结采样时损伤亚段支气管,使用4-0 Prolene线修补,手术时间分别242 min、247 min。术中出血量50~650 ml,(121.2±110.0)ml。清扫淋巴结2~27枚,(5.7±4.7)枚。术后首次下床时间2~24 h,(13.7±6.8)h。胸腔引流液总量72~2100 ml,(660.0±502.4)ml。术后漏气时间1~8 d,(3.3±1.2)d。留置上胸管时间1~10 d,(4.0±1.9)d;留置下胸管时间1~17 d,(5.3±2.6)d。术后住院时间5~23 d,(7.5±2.9)d。术后48 h疼痛视觉模拟评分2~5分,(3.1±0.7)分。
术中快速病理原位腺癌7例,微浸润腺癌34例,浸润性腺癌17例,术后病理以最高级别的病理亚型结果为准,其中4例浸润性腺癌降级为微浸润性腺癌。13例浸润性腺癌术后病理分期均为ⅠA期,病理亚型为贴壁型9例,腺泡型3例,乳头型1例,其中11例行表皮生长因子受体(epidermal growth factor receptor,EGFR)检测[11],10例突变(19位点突变6例,21位点突变4例)。
术后并发症21例(36.2%):1例乳糜胸,术后第1天行胸腔镜胸导管结扎治愈;轻症肺部感染、发热3例,持续漏气>5天3例,肺不张2例,予以抗炎、化痰、加强营养、吹气球、深呼吸等治疗,出院前均恢复;术后干咳12例,其中10例在1个月内、1例在2个月内、1例在4个月内症状消失。无脓胸、出血、喉返神经麻痹、膈神经功能障碍等并发症。
术后均未行放化疗及口服靶向药物治疗。术后1个月复查胸部CT,均提示肺复张良好,未出现纵隔偏移或肺容积明显减少(肺容量3500~4500 ml);术后3个月复查胸部CT,均提示渗出斑片影基本吸收,段面基本呈线样改变。定期随访12~42个月,(26.2±10.0)月,未出现并发症、肿瘤复发及转移。
3 讨论
很多直径≤2 cm的GGN位于段内较深部位或段间,楔形切除可能切缘不够,导致癌细胞残留,或者即使术前定位也会发生漏切,这都需要复杂肺段切除才能保证手术效果。由于复杂肺段切除的切割面是多个平面以及段门处,要处理较多的血管和支气管,对术者有较高的要求,因此很多胸外科医师遇到复杂肺段的结节直接选择肺叶切除,然而肺叶切除在术后恢复等方面差于肺段切除[12,13]。
我们遵照减少手术创伤、促进术后恢复、保证疗效以及提高切口美观等治疗原则[14,15],对于复杂肺段直径≤2 cm、ⅠA期GGN,严格按照2022年国内外指南[16,17],单孔胸腔镜下行复杂肺段切除(联合段切除、肺亚段切除、段切除联合亚段切除、联合亚段切除)。体会如下:①因为肺段血管变异较多,所以一定要精准进行术前规划,完善肺段血管、气管三维重建,根据结节位置确定需要游离和切断的靶段血管、气管以及需切除的靶段,避免漏切结节或切缘不够等严重后果。②手术时间:腔内操作手术时间可以分为几个大的模块,胸腔粘连游离5~60 min,每根段内气管、血管游离5~15 min、切断2~15 min,段间平面游离、切割7~20 min,膨胀萎陷法的等待时间8~20 min,血管性出血的处理或缝合20~90 min,术后试漏气及漏气的缝合5~30 min,寻找标本1~30 min。血管性出血,尤其出现肺血管主干破裂需要腔镜下缝合,血管破口的判断、压迫、缝合时间在20~90 min,是时间跨度最大的,也是对术者心理承受能力和耐心的最大考验。长期高血压、糖尿病患者血管脆性增加,往往压迫效果不佳,如果不能很好地缝合,可能出现缝线撕裂引起更大的出血。而几个模块时间共同延长,会导致手术时间≥300 min(本组没有)。我们严格控制手术麻醉时间,本组术后24 h均可下床活动,未出现严重并发症、死亡,42例(72.4%)术后住院时间≤7 d。③术后持续漏气:术后漏气>5 d为持续性漏气。肺段切除术后持续漏气发生率较高,Suzuki等[18]报道552例GGN行胸腔镜肺段切除,术后持续漏气52例(9.4%)。本组单孔胸腔镜复杂肺段切除术,需要处理多个段间平面,术后持续漏气发生率仅5.2%(3/58)。我们的经验是,靶段气管和动脉切断后,提起支气管残端就可以充分暴露段门,使用能量器械呈扇形向肋面游离,游离到见到下级支气管以上2 cm即可,段门呈扇形,使用腔镜直线切割吻合器沿膨胀萎陷的缺血线或沿段间静脉进行切割,钉砧板放在段门侧,可以放射形切割肺组织,减少术后肺组织皱缩,也可以节省时间并减少出血和术后漏气,手术结束使用20 cm H2O压力膨肺,观察15 s,如果出现Ⅱ度以上漏气,使用4-0 Prolene线缝合,伤口较深时可带脂肪垫或心包垫片缝合。如果出现支气管性漏气,一定要缝合,以避免术后长期漏气。④胸腔粘连:本组22例不同程度胸腔粘连,我们认为,除非胸腔闭锁出现钙化样粘连,一般通过单孔的切口可以进行分离。如果胸顶部大血管周围致密粘连,单孔分离粘连会出现电凝钩和超声刀角度不佳以及多个器械互相干扰的情况,不能勉强,可增加第3肋间5 mm切口置入电凝钩或超声刀,可以很方便地处理粘连。如果出现血管性粘连,使用较小的Hem-o-lok也能通过5 mm切口进行夹闭。处理膈肌表面的粘连,若单孔操作困难,可在腋中线第8肋间做一个5 mm切口以放入超声刀或电凝钩,可以明显加快手术进度,降低手术难度。若实在无法腔镜下分离粘连,则果断中转开胸,切不可盲目强行分解,避免血管破损,被迫肺叶甚至全肺切除等严重后果。⑤血管性出血:由于复杂肺段需要处理的血管均为段血管,如果出现靶段血管损伤,可以压迫后直接使用能量器械或Hem-o-lok于近心端夹闭。如果为非靶段血管,压迫15~30 min基本可以止血。如果肺动脉主干出血,建议进行破口缝合,不建议使用Hem-o-lok以及能量器械止血,因为可能导致致命性大出血。如果单个部位短时间内出血超过800 ml,建议开胸止血。⑥肺裂的处理:如果水平裂和斜裂发育完整,将其完整解剖可以明显降低手术难度,特别是处理上叶S2、S3及其亚段,下叶基底段各段及其亚段的手术,从段间入路可以直接暴露肺动脉,避免误损伤,加快手术进度;如果叶裂不全,特别是水平裂和斜裂后部经常出现发育不良或者未发育的情况,可以将前纵隔胸膜打开,向背侧游离暴露肺动脉,打开动脉鞘,在肺动脉主干游离,后纵隔胸膜打开,直至暴露出主支气管,这样两端操作,基本可以形成一个肺动脉表面贯穿前后纵隔的隧道,沿斜裂或者水平裂方向使用腔镜直线切割吻合器就可以打开肺裂,降低手术难度。⑦肺段血管和气管处理:遇到胸腔狭小的患者,虽然肺段的血管、气管解剖相对比较轻松,但使用腔镜直线切割吻合器闭合切断则较为困难,原因是血管、气管和手术切口距离很近,操作空间小导致腔镜直线切割吻合器关节头很难呈合适角度进入胸腔,特别是下叶各段和上叶前段的血管处理,难度系数很高。此时若将肺组织向远端牵拉,镜头摆放于切口处,将空间让给器械进入,一般均能比较方便地处理血管或气管;如果肺段血管、气管与切口为垂直角度,建议使用带“鹰嘴”的腔镜直线切割吻合器(如ELC50)在胶条的引导下穿过血管;如实在无法顺利置入腔镜直线切割吻合器,血管可采用Hem-o-lok夹闭或者丝线结扎后超声刀凝断,气管可剪断后缝扎,虽然增加手术时间,也能解决问题。本组1例采用肺段血管结扎后切断,气管剪断后缝扎的方法,术后无并发症发生。我们认为,血管的暴露和处理,首先是处理血管和段支气管之间的淋巴结,而不是围绕血管进行解剖,因为完整切除淋巴结后各个血管、气管的解剖位置就非常清晰了,既保证切除的准确性,又加快手术进程。⑧术后快速康复:我们将双微管技术(双猪尾导管,或猪尾导管+ARROW管)应用于单孔胸腔镜术后引流,引流效果满意,疼痛轻,患者耐管程度较好,可以早期下床活动,术后1个月胸部CT肺复张完全,无明显叶间积液和胸腔积液。
总体而言,对于直径≤2 cm的复杂肺段GGN,要严格掌握手术指征,充分围手术期准备和手术规划,单孔胸腔镜复杂肺段切除是安全有效的。

