单孔胸腔镜与开胸纤维板剥脱术治疗慢性结核性脓胸的比较*
蒋钰辉 戴希勇 申 磊
(武汉市肺科医院外科,武汉 430030)
结核性脓胸是由结核菌直接感染胸腔,或结核性胸膜炎慢性迁延而引起的。慢性结核性脓胸是胸腔感染进展至相对局限、稳定的一种慢性感染状态,病程一般超过3个月,典型的临床特征包括胸腔积液包裹、胸膜纤维板形成、肋间隙缩窄等,可导致长期慢性感染、呼吸功能不全等,通常需要在抗结核药物治疗的基础上联合外科手术治疗。胸膜纤维板剥脱术是治疗慢性结核性脓胸的首选术式,可以促进感染控制,恢复胸廓正常结构,促使肺复张,从而改善肺功能[1]。以往主要采用开胸手术。近年来,胸腔镜手术发展迅速,已成功应用于治疗慢性结核性脓胸[2]。2018年1月~2020年12月,我科行胸膜纤维板剥脱术治疗慢性结核性脓胸共256例,其中药物不耐受及其他原因未规范行药物治疗31例,联合行肺切除等复合手术12例,单孔胸腔镜手术中转开胸8例,人类免疫缺陷病毒(HIV)感染2例,长期使用糖皮质激素5例,将上述58例排除后,最终将198例纳入进行回顾性研究,2019年12月前行开胸手术,之后常规开展单孔胸腔镜手术,探讨单孔胸腔镜手术的安全性和治疗效果。
1 临床资料与方法
1.1 一般资料
手术适应证为符合下列所有条件:①有胸闷、胸痛、胸廓塌陷、呼吸功能不全等症状;②胸腔穿刺引流、药物治疗等内科治疗效果不佳,胸部CT显示胸腔积液包裹,胸膜增厚;③确诊为结核性脓胸,抗结核药物规范治疗至少2个月,药物治疗有效(发热、盗汗等结核感染中毒症状缓解,脓腔范围局限,胸膜水肿有消退,合并肺结核者肺部病变好转)。
手术禁忌证为有以下任何一项:①术前评估预计不能耐受麻醉及手术;②结核感染未控制稳定,如有结核感染中毒症状,抗结核治疗后胸腔或肺部结核感染无明显好转;③合并严重的肺器质性病变,如毁损肺、支气管胸膜瘘等,预计术后难以肺复张。
本研究的排除标准:①术前或术后未规范抗结核药物治疗;②单孔胸腔镜手术中转开胸;③联合行肺切除术、胸廓成形术等影响术后恢复的复合手术;④有HIV感染、长期使用免疫抑制药物等影响预后的基础疾病或因素。
共纳入198例,男166例,女32例。中位年龄31(23,52)岁。胸闷或活动后气促等呼吸功能不全症状85例,间断胸痛36例,无症状77例。查体均有不同程度肋间隙缩窄及胸廓塌陷,13例合并脊柱侧弯。128例合并肺结核,术前抗结核治疗2~30个月,结核感染控制稳定,无发热、盗汗等结核感染中毒症状。术前胸部CT提示胸腔包裹性积液并胸膜增厚,患侧肺受压膨胀不全,右侧125例,左侧73例。
2019年12月之前112例行开胸纤维板剥脱术(开胸组),之后86例行单孔胸腔镜胸膜纤维板剥脱术(单孔组)。2组基线数据比较差异无统计学意义(P>0.05),见表1。
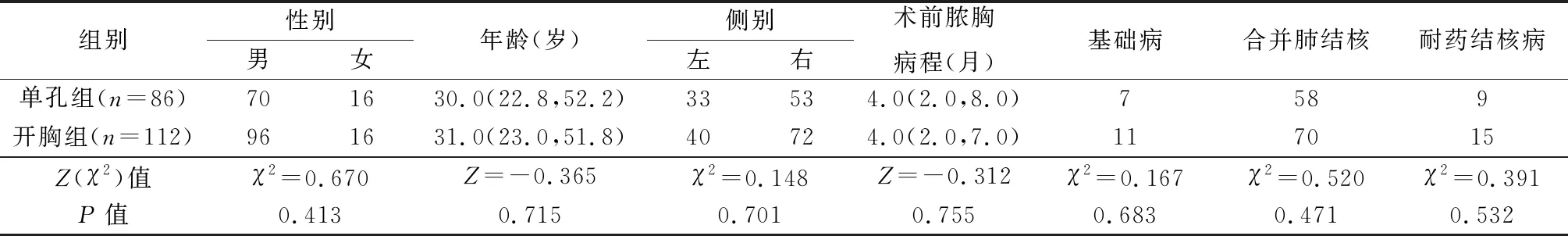
表1 2组基线数据的比较
1.2 手术方法
术前检查和准备同胸外科术前常规流程。2组采用相同的术前评估和围手术期管理方法,手术操作是在同一位主任医师指导下由2名高年资主治医师完成的,麻醉均为双腔气管插管全身麻醉。
开胸纤维板剥脱术:第6或第7肋间做长15~25 cm后外侧切口,切除部分肋骨经肋床进胸。钝性分离切口周边壁层胸膜与纤维之间的间隙,撑开肋间隙显露术野。切除壁层纤维板进入脓腔,清除内容物并取样送检病原学检查。将脏、壁层胸膜以及膈肌表面纤维板逐块切除,游离下肺韧带,松解胸膜粘连。胸腔创面彻底止血,严重肺破损予以修补缝合,于前、后胸腔各置一根引流管引流。
单孔胸腔镜纤维板剥脱术:于脓腔最深处做长4~5 cm肋骨平行切口(通常为第6或第7肋间腋中线处),经肋间或肋床进胸。在切口下找到纤维板与壁层胸膜之间的间隙,沿间隙向周围钝性分离,获得壁层纤维板与胸壁之间的空间,置入切口保护套撑开和保护切口。切除切口周边的壁层纤维板进入脓腔,清除脓腔内脓液及坏死物并取样送检。用电刀或尖刀切开脏层纤维板,沿纤维板与胸膜之间的间隙用吸引器或纱布球钝性分离,粘连致密无法剥离时可将脏层胸膜一并切除。松解下肺与纵隔、膈肌之间粘连,游离下肺韧带,将下肺彻底游离。沿切口向四周钝性剥离壁层纤维板,粘连致密处可用电凝钩锐性切除,切除过程中注意解剖层次,避免游离到胸膜外而损伤肋间动脉、交感神经等重要组织。膈肌表面的纤维板以钝性剥离为主,纤维板应尽可能彻底剥除,粘连致密处可使用电凝钩锐性切除。松解膈角的粘连,恢复膈肌的弹性和活动度。操作过程中,纤维板剥离创面及时用热盐水纱布压迫止血。纤维板彻底剥离完毕后,再次检查胸腔,活动性出血点以电凝棒或氩气刀彻底止血。生理盐水反复冲洗胸腔,检查并修补严重肺破损,前、后胸腔各置一根引流管引流。
1.3 术后治疗和随访
手术标本行病理学和病原学检查,明确诊断并判断是否为耐药结核病。术后第1天开始抗结核药物治疗,疗程6~12个月。确诊为耐药结核病者在结核科医师的指导下按照耐药结核病治疗方案规范治疗。术后维持胸腔引流通畅,肺漏气停止时拔除前胸腔引流管,胸腔引流液<100 ml/d拔除后胸腔引流管。其余术后治疗与护理等与胸外科常规相同。
术后于胸外科及结核科随访。术后第1、2、3个月复查胸部X线片或CT,评估肺复张情况,若肺复张良好,延长至3~6个月复查一次。
1.4 观察指标
围术期指标:手术时间、术中出血量、术后引流时间、术后住院时间和手术并发症,均以病历记录为准。
术后恢复指标:①术后肺复张时间;②治疗效果分级,在药物治疗疗程结束时,按照上海市肺科医院慢性结核性脓胸手术治疗效果评估标准评估治疗效果[3],见表2。

表2 慢性结核性脓胸手术治疗效果评估标准[3]
1.5 统计学方法
2 结果
与开胸组相比,单孔组手术时间较长,但术后引流时间和术后住院时间较短,2组术中出血量差异无统计学意义,见表3。
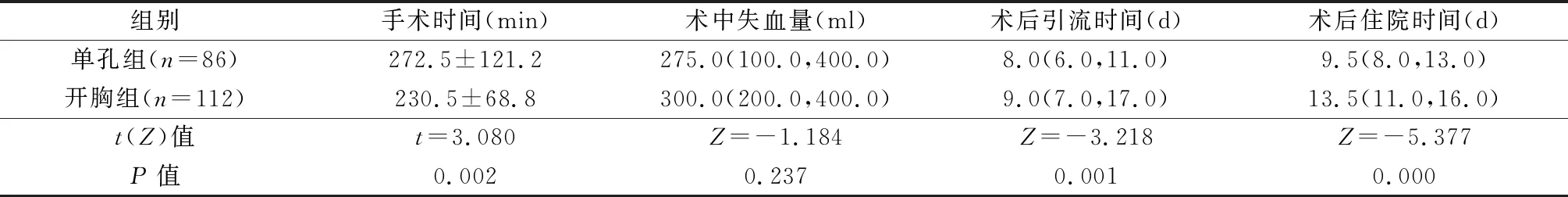
表3 2组围手术期指标的比较
单孔组总的并发症发生率低于开胸组,发生率最高的持续性肺漏气也低于开胸组,其他并发症包括胸腔出血、支气管残端瘘、乳糜胸、切口感染发生率均较低,且2组差异无统计学意义,见表4。2组持续性肺漏气(漏气时间>7 d)99例,引流时间9~267 d,其中9~14 d 55例,15~30 d 26例,>30 d 18例。单孔组1例纤维板钙化结核性脓胸术后支气管胸膜瘘,并反复胸腔感染,胸腔引流效果不佳,术后8个月行胸廓造口术,感染控制,患者拒绝再次手术;开胸组1例支气管胸膜瘘,术后6个月行肺叶切除术。3例术后胸腔活动性出血,予以输血、补液等治疗,形成凝固性血胸,经胸腔引流后血凝块溶解排出,分别于术后第15天、53天、86天拔管。1例左胸手术发生右侧乳糜胸,予低脂饮食并定期胸腔穿刺引流,术后2个月乳糜完全吸收。1例切口感染,行清创引流,术后3个月愈合。无围手术期死亡。
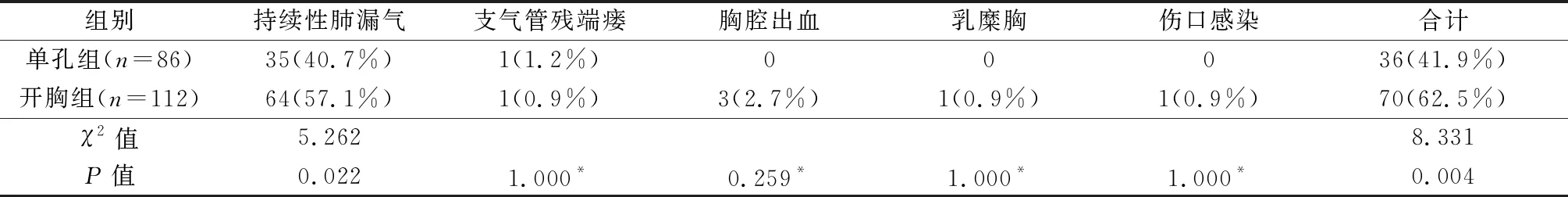
表4 2组手术并发症的比较
2组均完成抗结核药物治疗。22例术前抗结核治疗超过1年,术后抗结核治疗6个月停药;152例术后疗程7~12个月,总疗程大于1年,经评估后停药;24例耐药结核病,遵照指南采用耐药方案治疗,总疗程18~24个月,经耐药结核科、胸外科、影像科等多学科评估后停药。2组术后肺复张时间和抗结核药物治疗结束时治疗效果分级差异无统计学意义,见表5。
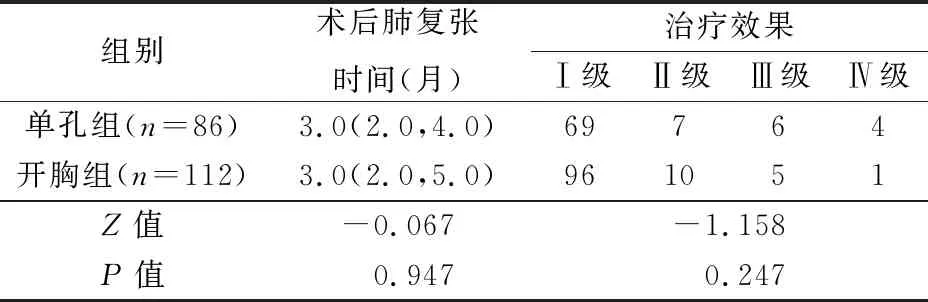
表5 2组术后恢复指标的比较
3 讨论
胸腔镜手术首先是在细菌性脓胸中开始探索和发展的,胸腔镜纤维板剥脱术治疗慢性脓胸的手术时间、术后住院时间、胸管引流时间、并发症发生率和死亡率方面均优于开胸手术[4~6]。慢性结核性脓胸由于伴有严重的炎性粘连、肋间隙狭窄等,手术难度较大,直到近几年才陆续有相关报道,结果显示胸腔镜手术治疗慢性结核性脓胸是可行、安全的,且具有微创优势[7,8],但这些研究的对象多为选择性病例,并发症发生率较高,有一定的局限性。
单孔胸腔镜手术已广泛应用于胸外科领域[9,10],近年来,随着技术的发展与成熟,单孔胸腔镜手术也用于治疗慢性结核性脓胸。周逸鸣等[3,11]的临床研究显示,单孔胸腔镜纤维板剥脱术治疗慢性结核性脓胸(包括肋间隙缩窄者)是安全、有效的。我们采用与之类似的手术方法,也获得满意的临床效果[12]。这些前期研究对手术适应证、操作技巧、临床效果等进行总结和分析,但没有与传统开胸手术进行对照,无法客观评价单孔胸腔镜纤维板剥脱术的优势和不足。
3.1 单孔胸腔镜纤维板剥脱术治疗慢性结核性脓胸的优势
单孔胸腔镜纤维板剥脱术需要术者同时掌握单孔胸腔镜和纤维板剥脱术,并经历一段学习曲线后才能熟练开展[13,14],这可能是本研究中单孔组的手术时间较开胸组长的主要原因。但是,本研究2组术中出血量差异无统计学意义,而且单孔组术后引流时间和术后住院时间较短,并发症少,说明相对于传统开胸手术,单孔胸腔镜纤维板剥脱术能够加速术后康复,与文献报道的结论一致[6,9]。
由于结核性脓胸致密的炎性粘连,剥离脏层纤维板时肺损伤是无法避免的[4,11],这会导致术后持续性肺漏气,是最常见的手术并发症,也是延长术后引流时间和住院时间的主要原因。本研究单孔组总的手术并发症和持续性肺漏气的发生率均较低,原因可能是单孔胸腔镜手术操作较精细、轻柔,术中肺损伤较轻。同时,胸腔镜可以提供开胸手术无法比拟的清晰视野和广阔角度,术中探查和操作更仔细[15]。一旦出现胸腔镜下难以处理的状况,可立即中转开胸手术[16]。这些都进一步降低了单孔胸腔镜纤维板剥脱术的手术风险,使其他手术并发症如胸腔出血、支气管胸膜瘘等的发生率也较低。
纤维板剥脱术治疗慢性结核性脓胸的目的是清除脓腔病变组织,恢复胸腔正常的解剖结构,治愈的根本在于术前手术适应证的合理判断,术中彻底清除病变组织,以及贯穿全程的有效药物治疗[16,17]。本研究2组虽然手术入路不同,但采用同样的围手术期管理方法,手术理念和病灶清除的范围也是一致的,因此远期恢复和预后并无差异,单孔胸腔镜纤维板剥脱术的治疗效果与开胸手术相当。
3.2 单孔胸腔镜纤维板剥脱术尚待解决的问题
本研究排除病例中有8例单孔胸腔镜中转开胸,其中5例纤维板剥离创面渗血严重,3例纤维板钙化剥离困难,为降低手术风险、缩短手术时间而中转开胸。5例渗血严重者中3例术后证实为耐药结核病,另2例术后发现抗结核药物血药浓度不足,我们认为中转开胸的原因主要是耐药、个体差异等,术前药物治疗效果不佳,胸腔感染未控制稳定,胸膜充血水肿,纤维板剥离后创面渗血严重。另外,部分纤维板钙化的结核性脓胸粘连致密,胸腔镜下显露和剥离困难而选择中转开胸。
结核感染控制稳定是单孔胸腔镜纤维板剥脱术实施的基础,也是评估手术时机的重要因素。由于感染严重程度、基础状况、药物治疗效果以及对药物的耐受能力等不尽相同,感染控制程度也没有具体的量化指标,手术时机的判断通常基于术者的主观经验,难以精准判断和标准化评估,因此,临床上迫切需要能够量化评估结核感染控制程度的指标,或者制定统一的、可操作的结核性脓胸手术时机评估标准,降低因术前评估不当而造成的风险。
另外,据临床实践观察,部分特殊类型的结核性脓胸如全脓胸(脓胸范围累及全胸腔)、纤维板钙化、耐药结核病等,行单孔胸腔镜纤维板剥脱术较困难。主要原因是病灶范围大,且多位于胸腔边缘,使用常规胸腔镜手术器械时存在操作盲区;而且,当胸腔炎性粘连致密或者纤维板质地坚韧时,胸腔镜下难以精准解剖和显露纤维板与胸膜之间的间隙,纤维板剥离比较困难。因此,单孔胸腔镜纤维板剥脱术的手术操作方法和配套手术器械仍有改进和发展的空间,一旦有足够的技术和设备支持,单孔胸腔镜纤维板剥脱术的应用范围有望进一步扩大,或可适用于治疗所有类型的结核性脓胸。
综上所述,与传统开胸纤维板剥脱术相比,单孔胸腔镜纤维板剥脱术能够缩短慢性结核性脓胸的术后引流时间和术后住院时间,降低手术并发症发生率,尤其是术后持续性肺漏气的发生率,加速术后康复,治疗效果也与之相当。
单孔胸腔镜纤维板剥脱术目前国内仅有少数医院开展,可供研究的病例较少。作为单孔胸腔镜技术的延伸,随着经验积累和技术推广,相信会有更多的同行认可、接纳和开展这种技术,并使之完善和成熟,让更多的患者受益。

