探讨磷酸肌酸治疗中重度新生儿缺氧缺血脑病中的作用
张 媛,徐晶玉
永城市妇幼保健院,河南 商丘 476600
新生儿缺氧缺血脑病(HIE)多由围生期缺氧导致血供异常所引起的,除围生期窒息外,羊水过少、胎盘功能下降、心脏病变、肺部疾病和贫血等影响机体氧合状态的病变也可诱发此病[1-2]。患儿部分或完全缺氧,脑血流量减少或是暂停,发病后有意识障碍和肌张力异常表现,神经系统症状可持续24 h以上,中重度患者可出现嗜睡、惊厥、瞳孔缩小症状,予以脑电图检查,可有痫样放电,甚至出现昏迷、原始反射消失、持续性惊厥、中枢性呼吸衰竭、对光反射迟钝等脑干损伤组织,经脑电图检查可见抑制,呈现为等电位。若不及时干预,约有20%的患儿可能死亡,即便予以救治,也会存在神经系统后遗症,影响新生儿健康成长。该疾病以缺氧为发病核心,因此临床工作者治疗此病时,多以维持内环境稳定性和脏器功能正常为原则。疾病常规治疗以监测生命体征(血压、心率、呼吸频率和血氧饱和度等)、维持通气功能、血糖水平为主,但对受损神经功能改善作用不明显。药物方案在该疾病的治疗中应用普遍,可减少疾病发作,改善新生儿患者神经功能状态[3-4]。磷酸肌酸(CP)可为腺苷三磷酸提供能量储备,促进其水平的恢复,也可拮抗二磷酸腺苷对磷酸核糖焦磷酸合成酶抑制作用,机体处于缺血状态时,予以外源性CP,可保护细胞结构。此外,该物质对磷脂酶有抑制作用,可稳定肌纤维膜,维持缺血心肌细胞生理状态[5-6]。在此背景下,样本医院ICU 在中重度新生儿HIE治疗中使用CP,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2017年5月—2020年8月永城市妇幼保健院收治的60例中重度新生儿HIE患儿,随机分成两组,每组各30例。对照组男17 例,女13 例,胎龄32~40 周,平均胎龄(36.18±2.24)周,观察组男15 例,女15 例,胎龄33~39周,平均胎龄(36.21±2.27)周。两组患儿一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准。
1.2 方法
对照组采用常规治疗,患儿存在面部青紫、呼吸困难症状时予以氧疗;予以代谢性酸中毒患儿硫酸氢钠;及时纠正酸碱失衡和水电解质紊乱;予以地塞米松注射以降低颅内压,4~6 h后再次给药,静脉注射甘露醇,连用3次,共治疗1周。观察组联合使用注射用CP(生产厂家:吉林英联生物制药股份有限公司,批准文号:国药准字H20045399,规格:1 g×2支/盒),将本品与50 mL浓度为5%的葡萄糖溶液混合后以静脉滴注,每天给药1次,连续用药1周。
1.3 观察指标
1.3.1 两组患儿神经体征情况 对比两组患儿意识、肌张力、原始反射恢复时间、惊厥与脑干症状消失时间。
1.3.2 两组患儿治疗前后血气指标和阴离子间隙情况 两组患儿治疗前后使用血气分析仪测定动脉氧分压、动脉二氧化碳分压和血氧饱和度,阴离子间隙检测:取2 mL 肝素抗凝动脉血,阴离子总数和阳离子总数之差为阴离子间隙,按照公式:AG=Na+-(Cl-+HCO3-)计算[7]。
1.3.3 炎症因子 治疗前后抽取两组患儿空腹静脉血,离心处理(3 000 r/min,5 min),采集上层清晰待测,使用全自动生化分析仪测定核因子kB、白细胞介素-6 和肿瘤坏死因子-α水平,各项指标经酶联免疫吸附试验测得。
1.3.4 氧化应激指标 按照上述方式采集患儿空腹静脉血并行离心处理,经硝酸还原酶法测定一氧化氮,活性氧和烟酰胺腺嘌呤二核苷酸磷酸氧化酶水平经蛋白印迹法检测,收集血清,加入磷酸盐缓冲液稀释,蛋白浓度经蛋白质定量法检测,行电泳、转膜、一抗、二抗和洗膜处理后,予以化学发光反应和凝胶成像处理,实验内参为β-action,灰度值经软件Image J分析,其中烟酰胺腺嘌呤二核苷酸磷酸氧化酶表达量经该指标与实验内参灰度值比值表示。
1.4 统计学方法
采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿神经体征情况
观察组意识恢复时间、肌张力恢复时间、原始反射恢复时间、惊厥消失时间与脑干症状消失时间均短于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患儿神经体征情况(±s) h
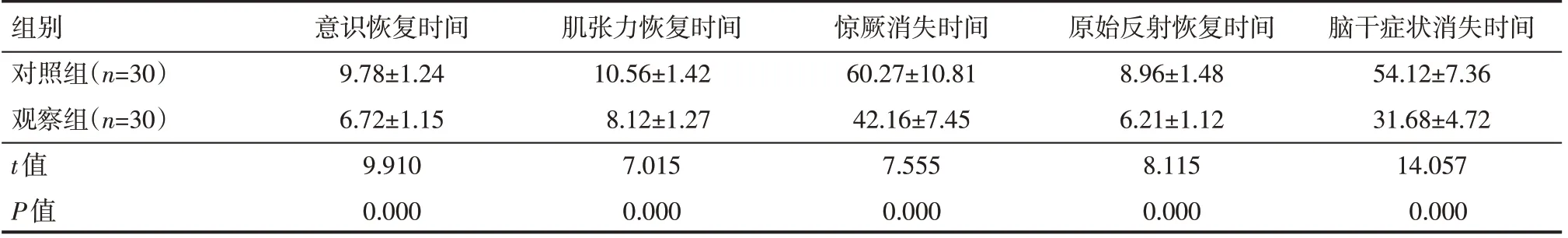
表1 两组患儿神经体征情况(±s) h
组别对照组(n=30)观察组(n=30)t值P值意识恢复时间9.78±1.24 6.72±1.15 9.910 0.000肌张力恢复时间10.56±1.42 8.12±1.27 7.015 0.000惊厥消失时间60.27±10.81 42.16±7.45 7.555 0.000原始反射恢复时间8.96±1.48 6.21±1.12 8.115 0.000脑干症状消失时间54.12±7.36 31.68±4.72 14.057 0.000
2.2 两组患儿治疗前后炎症因子水平情况
治疗前,两组患儿血清炎症因子水平对比,差异无统计学意义(P>0.05),治疗后,两组患儿核因子kB、白细胞介素-6 和肿瘤坏死因子-α水平均下降,且观察组各指标低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患儿治疗前后炎症因子水平情况(±s)
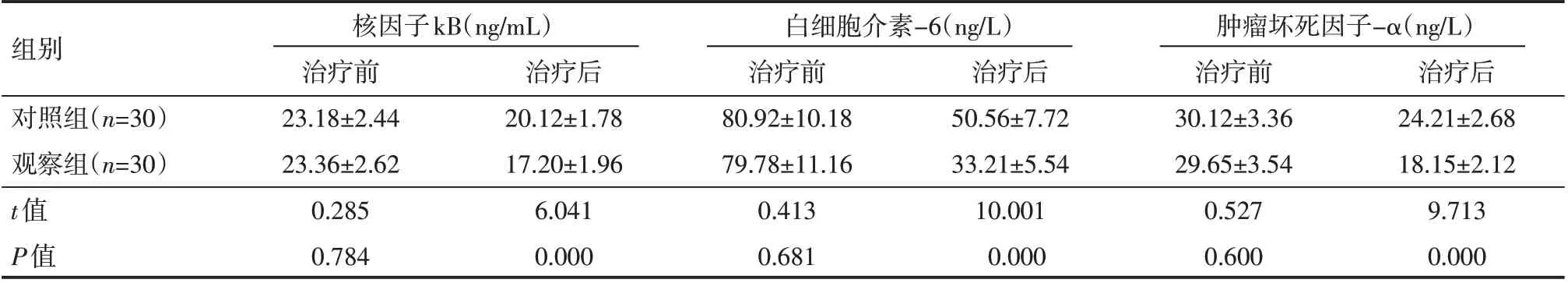
表2 两组患儿治疗前后炎症因子水平情况(±s)
组别对照组(n=30)观察组(n=30)t值P值核因子kB(ng/mL)治疗前23.18±2.44 23.36±2.62 0.285 0.784治疗后20.12±1.78 17.20±1.96 6.041 0.000白细胞介素-6(ng/L)治疗前80.92±10.18 79.78±11.16 0.413 0.681治疗后50.56±7.72 33.21±5.54 10.001 0.000肿瘤坏死因子-α(ng/L)治疗前30.12±3.36 29.65±3.54 0.527 0.600治疗后24.21±2.68 18.15±2.12 9.713 0.000
2.3 两组患儿治疗前后氧化应激指标情况
治疗前,各指标组间对比,差异无统计学意义(P>0.05),观察组治疗后一氧化氮,活性氧和烟酰胺腺嘌呤二核苷酸磷酸氧化酶水平明显低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患儿治疗前后氧化应激指标情况(±s)
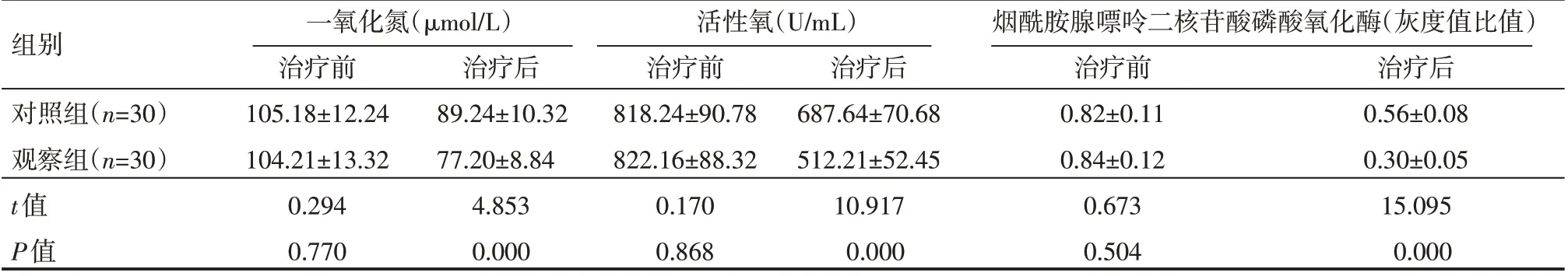
表3 两组患儿治疗前后氧化应激指标情况(±s)
组别对照组(n=30)观察组(n=30)t值P值一氧化氮(μmol/L)治疗前105.18±12.24 104.21±13.32 0.294 0.770治疗后89.24±10.32 77.20±8.84 4.853 0.000活性氧(U/mL)治疗前818.24±90.78 822.16±88.32 0.170 0.868治疗后687.64±70.68 512.21±52.45 10.917 0.000烟酰胺腺嘌呤二核苷酸磷酸氧化酶(灰度值比值)治疗前0.82±0.11 0.84±0.12 0.673 0.504治疗后0.56±0.08 0.30±0.05 15.095 0.000
2.4 两组患儿治疗前后血气指标和阴离子间隙情况
患儿治疗前血气指标和阴离子间隙比较,差异无统计学意义(P>0.05)。两组患儿治疗后动脉氧分压和血氧饱和度上升,差异有统计学意义(P<0.05),见表4。
表4 两组患儿治疗前后血气指标和阴离子间隙情况(±s)

表4 两组患儿治疗前后血气指标和阴离子间隙情况(±s)
组别对照组(n=30)观察组(n=30)t值P值动脉氧分压(mmHg)治疗前72.48±8.15 72.54±8.21 0.028 0.977治疗后83.16±6.32 90.12±5.78 4.451 0.000动脉二氧化碳分压(mmHg)治疗前52.27±4.68 52.72±4.75 0.370 0.713治疗后44.16±3.56 35.18±4.32 8.786 0.000血氧饱和度(%)治疗前88.92±6.54 88.96±8.48 0.020 0.984治疗后93.78±3.42 96.12±2.27 3.122 0.003阴离子间隙(mmol/L)治疗前24.78±4.32 25.12±4.18 0.310 0.758治疗后19.56±2.78 15.27±1.78 7.118 0.000
3 讨论
新生儿HIE可导致新生儿病残,严重影响新生儿生命安全。患儿病情随日龄、严重性和持续时间的变化而不同[8]。发病后以意识障碍、原始反射和肌张力异常、脑干症状为主要表现,严重时可导致患儿意识不清,呈昏迷状态,12 h内频繁惊厥,即便予以相应的治疗,仍有不同程度后遗症,影响新生儿健康成长[9-10]。为此,需探讨一种更为安全有效的治疗方式,以控制病情发展,改善预后。
CP 中含有氨基磷酸键,能量高,经细胞可水解,可产生12 000 kal/mol 以上的能量,为细胞增殖提供能量[11]。CP产生能量的途径主要有[12]:经肌酸磷酸激酶催化,CP 可与二磷酸腺苷结合,转化为肌酸和三磷酸腺苷,此反应主要在线粒体膜间隙、胞浆膜、肌浆网和肌原纤维出现,可承载细胞能量,为钙离子通透和通道提供所需能量,也可促进肌动蛋白—肌球蛋白丝滑行。CP 在脑组织中含量较高,通过研究该物质在不同组织中的分布,可见CP 主要分布在心脏、脑、肾脏和骨骼肌等处,肝、肺内蓄积量相对较少,这一特性使其被用来保护心肌、脑、肾脏和骨骼肌[13]。CP 进入细胞后,可维持高能磷苷水平,其含有的酶可对5’-核苷酸合成予以抑制,内源性CP不足时,可补充外源性CP,提供能量。
疾病发展过程中可引起氧化应激反应,氧自由基大量释放,氧化和抗氧化平衡紊乱,可引起中性粒细胞浸润,增加蛋白质分泌量,加重原有疾病[14]。烟酰胺腺嘌呤二核苷酸磷酸氧化酶为复合酶,其水平在氧化应激状态下迅速上升,也可增加机体活性氧释放量。心肌细胞缺血缺氧时,可导致烟酰胺腺嘌呤二核苷酸磷酸氧化酶水平提高,使得心肌细胞凋亡,予以抑制剂可有效保护。活性氧是机体代谢有害产物,机体内分泌紊乱、代谢异常时,该物质于体内大量堆积,对蛋白质和不饱和脂肪酸予以氧化,损伤机体组织。一氧化氮存在于多种细胞,其水平较低时,可保护神经细胞,增强其活性,浓度较高时,可产生神经毒性作用。上述对比显示,观察组各项氧化应激指标水平更低,主要是因为CP 对患者相关桐庐信号传导有抑制作用,可减少氧自由基大量释放对机体组织的损伤,改善氧化应激状态。
核因子kB 途径经活性氧激活,在多条信号通路作用下,白细胞介素-6炎性因子大量分泌。在微血管系统上发挥作用,刺激细胞因子和黏附因子释放,激活凝血系统,引起机体微循环障碍,导致血栓,影响脑血管功能。上述对比显示。两组患儿药物治疗后,血清炎症因子水平下降,观察组核因子kB、白细胞介素-6 和肿瘤坏死因子-α水平更低,分析其原因可能是CP 对相关信号通路有抑制作用,降低炎性因子水平,缓解炎症反应所致机体损伤。刘利利[15]研究发现,予以新生儿缺血缺氧性脑病患者磷酸肌酸钠,患儿白细胞介素-6 和肿瘤坏死因子-α水平更低,与本研究观点基本一致。
综上所述,在中重度新生儿HIE治疗中使用CP,可缓解神经功能症状,降低炎症因子和氧化应激指标水平,改善血气指标和阴离子水平作用明显。

