木犀草素通过TLR4/NF-κB途径对哮喘模型幼鼠炎症的影响
刘克新,龚本新,何飞雪,黎胜年,郑 英,雷华凤
1.中国科学院大学深圳医院(光明)东院区儿科,广东 深圳 518000;2.中国科学院大学深圳医院(光明)妇幼保健部,广东 深圳 518000
哮喘是一种常见的气道炎症性疾病,以反复阻塞气道为特征,与黏液分泌过多和气道炎症细胞浸润有关。目前,全球哮喘患者超过3亿多人,且数量逐年上升[1]。目前治疗哮喘的方法主要是使用吸入皮质类固醇、长效β2抑制剂等药物。但目前关于哮喘的治疗过程中,部分治疗的疗效不确定,且因药物的副作用,患者依从性比较差[2]。因此有必要探究新的药物控制哮喘的症状。
Toll 样受体(Toll-like receptors 4,TLR4)是一种模式识别受体,研究报道OVA激活Toll样受体通路及其下游靶点核因子κB 蛋白(Nuclear Factor Kappa-B,NF-κB),引起Th2相关哮喘炎症反应的加重和炎症细胞因子基因表达,NF-κB是一种多细胞转录因子,在调节炎症和免疫反应中也起着重要作用[3]。抑制NF-κB 可以减轻卵清蛋白(OVA)诱导的过敏性哮喘[4]。
木犀草素(Luteolin,LT)以糖苷的形式存在于多种植物中,这些植物以全叶青兰、辣椒、野菊花、金银花、紫苏含量较高,具有镇咳和祛痰作用。据最新研究,呼吸道症状咳嗽、咳痰、喘息,均与气道慢性炎症有关,如支气管哮喘、慢性阻塞性肺疾病、慢性咽炎、变应性鼻炎等引起咳嗽、咳痰、喘息,均被认为与局部的炎症浸润有关。炎症的存在使得气道的免疫应答混乱,患者常出现气道反应性增高,治疗的手段首先应该消除气道的慢性炎症浸润。目前常用糖皮质激素消除气道炎症,但糖皮质激素的副作用较多,不宜长期应用。研究表明,LT抑制巨噬细胞磷酸化,抑制转录因子NF-kB的活性,能够抑制脂多糖(LPS)诱导的巨噬细胞产生细胞因子IL-6,TNF-α。后两种细胞因子在炎症机制中扮演非常重要的角色,是反映炎症程度的敏感指标。LT 还能提高IFN-γ,降低特异性IgE,减少嗜酸性粒细胞的浸润。另外,LT 除了抗炎、抗过敏作用以外,还具有抑制PDE、抗SARS、HIV 病毒特性,其原因为抑制SARS 病毒前S 蛋白的活性,从而阻止其进入宿主细胞。LT用于治疗COPD、支气管哮喘、慢性咽炎以及变应性鼻炎等引起的慢性咳嗽。LT是一种具有抗炎作用的天然黄酮类化合物,具有抗炎和自由基清除作用[5],目前研究发现LT 能减轻过敏性小鼠支气管收缩和气道高反应性调节,但对LT通过TLR4相关途径的哮喘尚无研究。因此,本研究探讨木犀草素是否可以通过抑制TLR4/NF-κB 途径诱导抑制哮喘模型的炎症。
1 实验材料
1.1 实验动物
选择SPF 级SD 雌性幼年小鼠40 只,4 周龄,体重(100±20)g。广东省实验动物中心提供,饲养深圳大学SPF动物房。
1.2 主要试剂和仪器
木犀草素(中国MCE公司), 卵清蛋白(哈尔滨百杰斯生物公司),大鼠血清IL-2、IL-4 ELISA 试剂盒(南京建成生物工程研究所),RevertAid First Strand Cdna[美国赛默飞世尔科技(中国)有限公司],PowerUp SYBRTM Green Master MIX[美国赛默飞世尔科技(中国)有限公司],兔抗大鼠TLR4 抗体(美国abcam 公司),兔抗大鼠NF-κB p65 抗体(美国abcam 公司),兔抗大鼠GAPDH 抗体(美国abcam公司),HRP-羊抗兔IgG抗体(美国abcam公司),超声雾化器(江苏鱼跃医疗设备有限公司)。
2 实验方法
2.1 哮喘造模
将幼年小鼠适应性饲养3 d 之后,除去正常组幼鼠10只,剩余30只幼鼠在第1 d、7 d腹腔注射卵清蛋白和氢氧化铝预混制备的乳化液共1 mL(100 mg 氢氧化铝和1 mg卵清蛋白)。第15 d、16 d、17 d、18 d、19 d分别给予雾化吸入含3% OVA的生理盐水20 min,正常组以及生理盐水代替卵清蛋白进行腹腔注射及雾化吸入。
2.2 药物干预
OVA干预造模小鼠组随机分为3组,分别是哮喘模型组、LT低浓度组、LT高浓度组,每组10只小鼠。LT低浓度组、LT高浓度组均从第1次哮喘激发开始(造模第15 d),每只每天分别予1 mg/kg,2 mg/kg 腹腔注射,以上各组连续给药14 d后,然后把小鼠处死进行实验研究。
2.3 实验标本采集
第30 d,进行幼鼠眼眶取血,静置15 min 后,4 ℃,3 000 r/min,离心10 min,取上层血清,保存于-80 ℃冰箱中;开胸取出左上肺组织,冷冻于液氮中;取出右上肺组织,放入4%多聚甲醛固定。
2.4 小鼠气道高反应检测
采用小鼠无创肺功能仪检测小鼠气道高反应情况,按照肺功能仪检测步骤,使用不同剂量(0 μg /mL、6.25 μg /mL、12.50 μg /mL、25.00 μg /mL、50.00 μg /mL、100.00 μg /mL)乙酰甲胆碱激发后,检测各组小鼠气道高反应。
2.5 血清IL-2、IL-4含量测定
取冻存的血清,采用ELISA 方法检测各组大鼠血清IL-2、IL-4的浓度,具体实验方法根据ELISA试剂盒说明书操作,绘制标准曲线,计算IL-2、L-4浓度。
2.6 肺组织病理切片炎症观察
将右上肺从4%多聚甲醛中取出,进行常规脱水,石蜡包埋,切片,苏木精—伊红染色,封片,显微镜下观察肺组织炎症情况。
2.7 肺组织TLR4、NF-κb pP65的RNA表达
从NCBI库查找大鼠TLR4、NF-κB 基因,根据基因设计TLR4、NF-κB,取每组左上肺组织,放入液氮中充分研磨,按照RNA 提取试剂盒说明书,提取RNA。测量RNA浓度,根据RevertAid First Strand cDNA试剂盒,转录成CDNA;根据PowerUp SYBRTM Green Master MIX 试剂盒操作步骤,上机检测TLR4、NF-κB的RNA表达。
2.8 肺组织TLR4、NF-κB pP65的蛋白表达
取出肺组织,放入液氮中充分研磨,加入生理盐水100 μL及1 μL蛋白酶抑制剂,14 000 r/min,离心后,取上清液,测蛋白浓度,根据蛋白浓度加入1×loading buffer,100 ℃水中煮10 min,取30 μL 每孔上样,进行SDS-PAGE 电泳,转膜后,3%脱脂奶粉封闭2 h,分别加入兔抗大鼠TLR4 抗体(美国abcam 公司),兔抗小鼠NF-κB pP65 抗体,兔抗大鼠GAPDH 抗体等一抗,4 ℃孵育过夜,TBST 洗涤5 次,加入HRP-羊抗兔IgG 抗室温孵育2 h,TBST 洗涤5 次,加ECL 发光液,置于仪器中发光显色,imagJ计算灰度值,
2.9 统计学方法
采用SPSS 10.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间采用单因素方差分析的方法进行统计分析。以P<0.05为差异有统计学意义。
3 实验结果
3.1 小鼠气道高反应检测
通过大鼠气道高反应检测,模型组在乙酰甲胆碱浓度为50.00 μg /mL、100.00 μg /mL时,气道高反应明显高于正常组,差异有统计学意义(P<0.01);LT 低浓度、LT高浓度组在乙酰甲胆碱浓度为50.00 μg/mL、100.00μg/mL时,气道高反应低于模型组,差异有统计学意义(P<0.01),见表1。
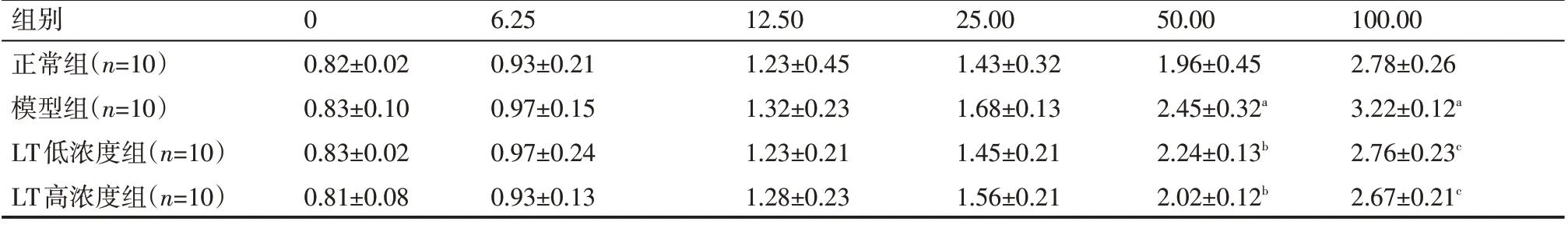
表1 小鼠气道高反应检测 μg/mL
3.2 各组大鼠血清IL-4、IL-2含量
ELISA检测血清IL-4、IL-2浓度,模型组血清IL-4浓度明显高于正常组,差异有统计学意义(P<0.01),模型组血清IL-2 浓度明显低于正常组,差异有统计学意义(P<0.01);LT低浓度组、LT高浓度组血清IL-4浓度低于模型组,差异有统计学意义(P<0.05),LT低浓度组、LT高浓度组血清IL-2 浓度高于模型组,差异有统计学意义(P<0.05),见表2。
表2 各组大鼠血清IL-4、IL-2含量(±s) pg/mL

表2 各组大鼠血清IL-4、IL-2含量(±s) pg/mL
a 表示与模型组比较,P<0.01;b 表示与模型组比较,P<0.05。
组别正常组(n=10)模型组(n=10)LT低浓度组(n=10)LT高浓度组(n=10)IL-4 54±2.5 127±4.5a 80±3.4b 67±2.1b IL-2 154±6.3 56±5.6b 134±3.4b 123±3.5b
3.3 各组肺组织炎症病理观察情况
正常组:小鼠肺组织支气管内及周围无明显炎性细胞浸润,组织黏膜未见充血水肿,肺泡间隔狭窄,肺泡腔清亮宽敞。模型组:支气管壁、管腔内及血管、支气管周围有炎性细胞浸润,支气管黏膜水肿、增厚、上皮脱落、微血管渗漏、管腔内分泌物增多,基层细胞增生、平滑肌增厚,组织黏膜充血水肿,肺泡间隔变宽,肺泡腔变狭窄。LT低浓度组:肺组织嗜酸性粒细胞及其他炎性细胞浸润减少,管壁和平滑肌厚度减少,组织充血水肿现象减轻,肺泡腔变宽,肺泡间隔变窄。LT高浓度组:大鼠肺组织支气管内及周围炎性细胞浸润明显减少,管壁完整,组织黏膜充血水肿减少,肺泡间隔狭窄,肺泡腔清亮宽敞。
3.4 肺组织TLR4、NF-KB的mRNA表达
PCR 检测肺组织TLR4、NF-κB 的RNA 表达,模型组TLR4、NF-κB 的RNA 表达明显高于正常组,差异有统计学意义(P<0.01);LT 低浓度组、LT 高浓度组TLR4、NF-κB 的RNA 表达表达低于模型组,差异有统计学意义(P<0.01),见图1。
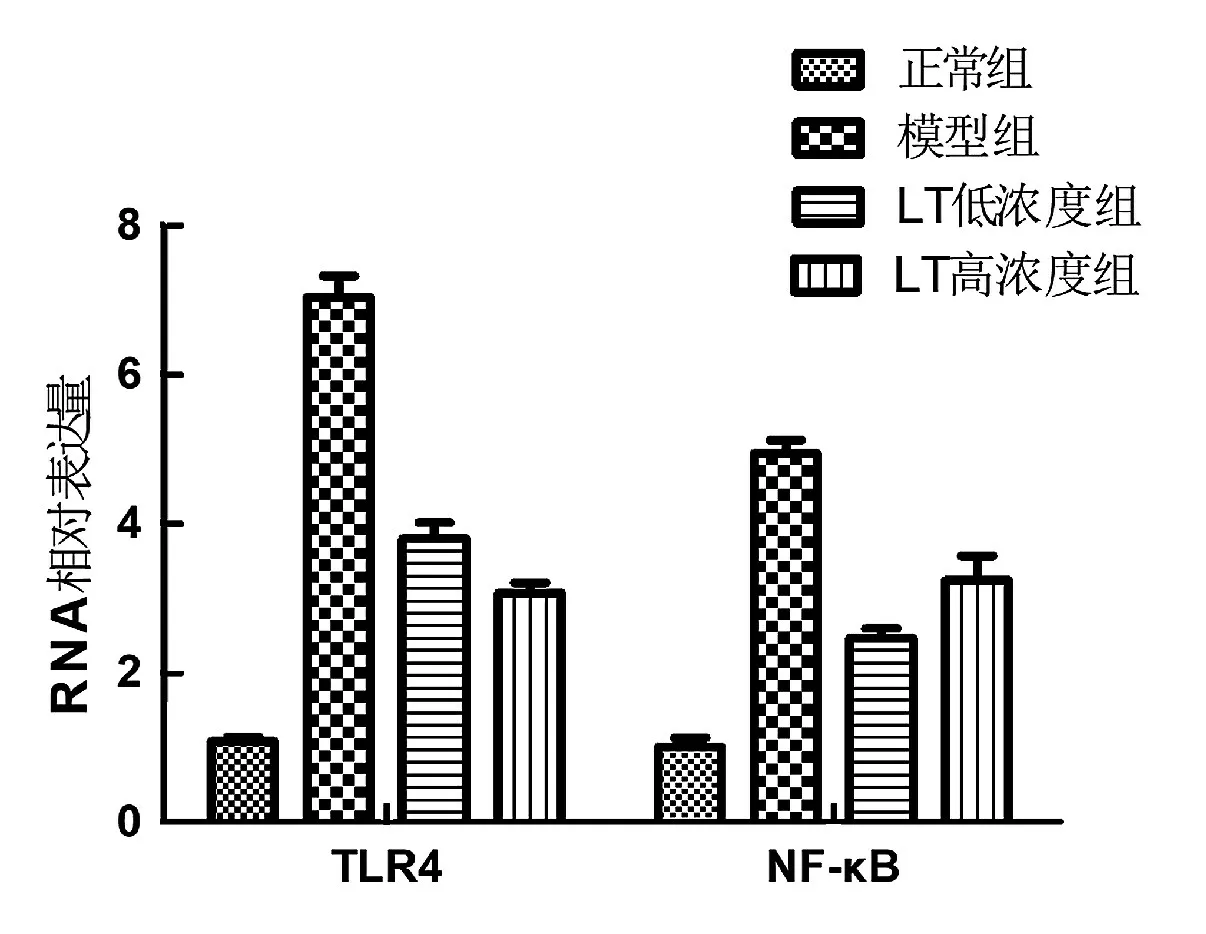
图1 肺组织TLR4、NF-KB的mRNA表达
3.5 肺组织TLR4、NF-κB pP65的蛋白表达
WB 检测肺组织TLR4、NF-κB pP65 的蛋白表达,模型组TLR4、NF-κB pP65蛋白表达明显高于正常组,差异有统计学意义(P<0.05);LT 低浓度组、LT 高浓度组TLR4、NF-κB pP65 蛋白表达低于模型组,差异有统计学意义(P<0.05),见图2。
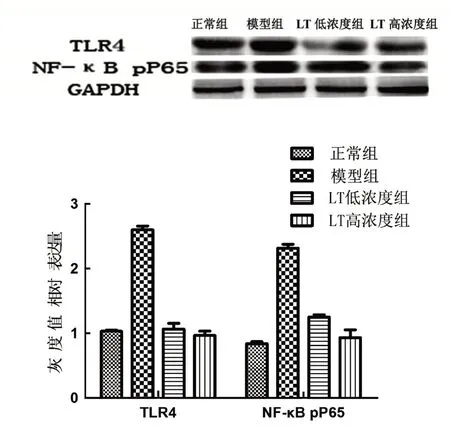
图2 肺组织TLR4、NF-κB pP65的蛋白的表达
4 结论
哮喘是儿童常见的慢性呼吸道炎症性疾病,其特征是气道高反应性、间歇性气道阻塞和肺功能降低,其主要是以Th2 细胞为主介导的自身免疫性疾病[6]。研究发现,OVA 能明显诱导小鼠哮喘的气道高反应,而LT 能有效改善OVA 诱导哮喘模型的气道高反应。IL-4 主要由活化的Th2细胞产生,能增强B 细胞作用,促进IgE 介导的免疫应答,诱导气道的炎症[7]。IL-2 主要由活化的Th1细胞产生的促进T 细胞增殖、分化的细胞因子,抑制Th2 的表达,减少促炎细胞因子和趋化因子的表达[8]。研究者发现OVA 能诱导小鼠哮喘模型IL-4 的产生、抑制IL-2 的形成,而LT能抑制细胞因子IL-4 的表达,而促进IL-2 的表达,说明其可能够调节哮喘模型Th1/Th2平衡,而LT组肺部病理炎症明显改善,LT具有抑制哮喘炎症的作用。
哮喘是一种以气道炎症为特征的过敏性疾病,暴露的过敏原会引发与Th2反应相关的气道炎症,诱导嗜酸性粒细胞、中性粒细胞和巨噬细胞浸润,从而促进各种炎症介质和细胞因子的释放[9]。TLR4 是一种重要的免疫模式识别受体,调控先天性和适应性免疫反应,促进细胞因子的合成和释放,促进炎症反应的产生[10]。研究发现,脂多糖加重肥大细胞过敏性气道炎症是通过激活肥大细胞中的TLR4 介导的,而TLR4 又反过来刺激Th2 反应[10]。TLR4/NF-κB下游通路能调节脂多糖刺激的肥大细胞产生Th2细胞因子[11]。TLR4信号启动NF-κB的激活,诱导基因转录和多种炎症介质的表达。NF-κB是参与所有类型细胞过程的必需转录因子复合物,包括细胞代谢、趋化性等,NF-κB在调节免疫应答以及细胞增殖和分化方面也有重要作用[12]。因此,TLR4/NF-κB信号通路对哮喘的免疫调节过程至关重要,是哮喘的重要病理机制。NF-κB pP65 是NF-κB 家族中的主要活性蛋白。本研究发现OVA 能诱导哮喘哮喘TLR4/NF-κB 相关蛋白的表达,与文献报道一致。 本研究发现木犀草素治疗组能抑制TLR4、NF-κBpP65 蛋白的表达,说明木犀草素可能通过TLR4/NF-κB途径抑制哮喘的炎症反应。
综上所述,LT 对哮喘具有抗炎作用,很可能与调控TLR4/NF-κB途径有关。

