eIF4E与肿瘤治疗耐受
孙佳佳,王晓露,吴爽,沐超,胡新荣,姚运红
近年来,恶性肿瘤的发病率和死亡率逐渐升高并呈现年轻化趋势,人类的健康受到严重威胁。虽然治疗水平在逐渐提高,但是仍然面临肿瘤治疗耐药这一严峻问题。真核细胞翻译起始因子 4E(eukaryotic initiation factor 4E,eIF4E)是真核生物蛋白质合成的翻译起始限速因子,eIF4E 通过磷酸化增加与 5' mRNA 帽子结构的亲和力,形成更加稳定的翻译起始复合物,促进蛋白质的合成,在肿瘤的生成、恶化及转移中起重要的作用。许多学者相继在宫颈癌、子宫内膜癌、卵巢癌、乳腺癌、胃癌、食管癌、结肠癌、肺癌、白血病等多系统肿瘤中发现 eIF4E 的表达量及磷酸化程度与肿瘤增殖、分化、侵袭、转移、预后相关。恶性肿瘤治疗需符合多学科综合治疗原则,包括外科手术、放疗、化疗及新兴的生物治疗,其中以 eIF4E 为靶点的治疗方法和药物是近年来的研究热点。解决与 eIF4E 相关的肿瘤耐受,增加肿瘤对治疗的敏感性,对改善患者的预后至关重要。
1 eIF4E 的结构和生物学功能
eIF4E 是真核细胞翻译起始因子 eIFs 家族的一员,定位于4q21 ~ 4q25 染色体,在与 mRNA 5' 端 m7GpppN 帽子结构特异性地结合后,与家族成员真核细胞翻译起始因子4G(eIF4G)、真核细胞翻译起始因子 4A(eIF4A)共同构成真核细胞翻译起始因子 4F(eIF4F)复合物,参与调控翻译的启动位点和定位过程[1]。
在哺乳动物中,eIF4E 存在 3 种同源异构体,分别是eIF4E1、eIF4E2(4EHP)和 eIF4E3[2]。人 eIF4E(主要指eIF4E1)基因是真核生物蛋白质合成过程中翻译起始复合物的关键因子,可编码分子质量为 25 kD 的多肽,以游离或复合物的形式分布于所有真核细胞细胞质,部分位于细胞核[3]。分布在细胞质内的 eIF4E 主要参与 mRNA 翻译过程,而分布在细胞核内的 eIF4E 则参与 mRNA 的转运过程。
eIF4E 在细胞核内通过与具有 eIF4E 敏感单元(eIF4E sensitivity element,4E-SE)结构的 mRNA 结合,将其转运至细胞质,从而提高 eIF4E 在细胞质中的浓度,随着 eIF4E表达进一步增多使细胞进入异常有丝分裂和(或)凋亡,导致基因突变,最终使细胞癌变,eIF4E 高表达促进了致癌蛋白合成,从而影响肿瘤形成的相关过程,如细胞凋亡、转化、血管生成、侵袭及转移等[4]。
2 eIF4E 的调控通路
大多数肿瘤的发生发展过程伴随多条信号传导通路的异常激活,eIF4E 作为细胞恶性转化的关键调控因子,是多条信号传导通路的下游因子,其调控通路十分复杂。
在哺乳动物细胞中,eIF4E 活性主要受到磷脂酰肌醇 3-激酶/蛋白激酶 B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)和丝裂原激活的蛋白激酶/丝裂原激活的蛋白激酶作用激酶(mitogen-activated protein kinase/mitogen activated protein kinase interacting kinase,MAPK/MNK)两条信号通路的调控,eIF4E 是这两条调控通路的交汇点。有研究表明,PI3K/Akt/mTOR 途径与 MAPK/MNK 途径之间存在补偿性反馈机制,其中一种途径的下调与另一种途径的激活相关,而激活的通路支持细胞的增殖和癌症的存活[5](图1)。
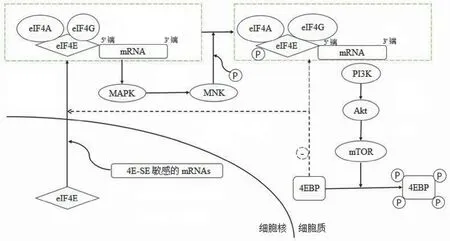
图1 eIF4E 在肿瘤细胞中调控通路概要图(PI3K:磷脂酰肌醇 3-激酶;Akt:蛋白激酶 B;mTOR:哺乳动物雷帕霉素靶蛋白;eIF4E:真核细胞翻译起始因子 4E;4EBP:eIF4E 结合蛋白; 4E-SE:eIF4E 敏感单元;eIF4A:真核细胞翻译起始因子 4A;eIF4G:真核细胞翻译起始因子 4G;MAPK:丝裂原激活的蛋白激酶;MNK:丝裂原激活的蛋白激酶作用激酶;:磷酸化;:抑制效应)
2.1 PI3K/Akt/mTOR 调控通路
eIF4E 结合蛋白(eIF4E-binding protein,4EBP)广泛分布在胞核和胞浆中,具有抑制 eIF4E 介导的 mRNA 转运和抑制 eIF4E 介导的帽依赖翻译过程的作用。4EBP 可被 PI3K/Akt/mTOR 信号传导系统下游的 mTOR 分子磷酸化,磷酸化的 4EBP 无法与 eIF4E 结合,从而失去对eIF4E 的抑制[2]。而去磷酸化的 4EBP 通过与 eIF4G 竞争eIF4E 的结合进而抑制 eIF4E 形成 eIF4F 复合物,因为eIF4E 是在形成复合物后发生的磷酸化,所以 4EBP 间接抑制了 eIF4E 的磷酸化水平。
2.2 MAPK/MNK 调控通路
eIF4E 能通过细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)和 p38 MAPK 信号转导通路激活 MNK1 和 MNK2 而磷酸化,作用位点主要是磷酸化eIF4E(p-eIF4E)的丝氨酸 209 位点(Ser209)、丝氨酸53 位点(Ser53)和苏氨酸 21 位点(Thr21)(主要的磷酸化位点是 Ser53)[6]。eIF4E 的 Ser209 位点磷酸化与第159 号赖氨酸残基形成盐键,增强 eIF4E 与 mRNA 结合的亲和力,稳固了翻译起始复合物的形成,提高了细胞增殖速率[7]。eIF4E 的 Ser209 位点磷酸化是其发挥癌基因功能所必需的,其磷酸化的程度越高,可以增加与肿瘤发生发展过程中相关的多种蛋白质的翻译,影响预后。
3 eIF4E 与肿瘤治疗耐药
目前,恶性肿瘤的治疗方式以根治性手术为主,放疗、化疗及生物治疗为辅。放疗、化疗及生物治疗能进一步改善肿瘤患者近期和远期疗效、转归恢复或进展程度。eIF4E 已被证实在多种恶性肿瘤中呈现过表达,且其与肿瘤放疗、化疗及生物治疗疗效相关。下面简述宫颈癌、乳腺癌、胃癌、肺癌中 eIF4E 与其治疗耐受的相关调控机制。
3.1 宫颈癌
宫颈癌是女性常见的恶性肿瘤之一,2020年,据世界卫生组织国际癌症研究机构(IARC)公布,宫颈癌占全球女性癌症新发病例和死亡人数的第4 位。
有研究发现,与正常宫颈组织相比,eIF4E mRNA 在宫颈癌组织中过表达 7 倍[8]。另一项研究显示 eIF4E 染色强度随着宫颈病理的增加而逐渐升高,而 eIF4E 染色强度与肿瘤类型或肿瘤分级无差异[9]。
目前宫颈癌的治疗方法主要有手术、放疗和化疗,其中放疗是中晚期患者常用的治疗方法[10]。但在临床应用中,少数患者对放疗产生耐药性,导致放疗效果不理想,甚至导致肿瘤复发转移[11]。有相关研究验证,eIF4E 是 miR-499a-5p的靶基因且受 miR-499a-5p 的负调控。miR-499a-5p 通过直接靶向 eIF4E 促进宫颈癌细胞的凋亡和放射敏感性,抑制增殖、侵袭、迁移和 EMT[12]。但是 miR-499a-5p 在宫颈癌细胞中却显著下调,使 eIF4E 在宫颈癌组织中表达量上调,进一步表明 eIF4E 的表达量与宫颈癌放疗的敏感性呈反比,eIF4E 过表达是宫颈癌患者放疗不敏感的靶基因之一。此外,Liang 等[13]发现,eIF4E 表达降低提示术前近距离放射治疗有良好的反应。这表明 eIF4E 的表达量与宫颈癌放疗的敏感性相关。
近年来,大量的研究提供了强有力的证据,表明下调eIF4E 可显著提高宫颈癌细胞对化疗的敏感性[14-15]。抗凋亡蛋白的过度表达、DNA 修复的增加以及上皮-间质转化的增强似乎有助于宫颈癌细胞对化疗的耐药性[16-18]。目前,许多研究学者发现 MAPK/MNK-eIF4E-Wnt/β-catenin 信号通路在宫颈癌细胞化疗耐药中发挥重要作用。Xu 等[14]研究发现,宫颈癌细胞化疗后显著增加 eIF4E 的磷酸化水平。p-eIF4E 水平的上调也出现在顺铂耐药的 HeLa 细胞中,化疗药物以 eIF4E 依赖的方式激活 Wnt/β-catenin 信号通路。通过 siRNA 敲除 eIF4E 或使用 Wnt 抑制剂 pyrvinium抑制 Wnt/β-catenin,可有效增强顺铂在体外和体内宫颈癌细胞的抗增殖和促凋亡作用。Zhang 等[19]发现 MNK 激酶抑制剂与紫杉醇联合对宫颈癌细胞的疗效优于单用紫杉醇。Zhu 等[20]研究发现靶向 MNK/eIF4E 轴的药物抑制剂黑孢酰胺通过消除化疗诱导的 eIF4E 激活增强了阿霉素或顺铂的疗效,显示出对化疗耐药宫颈癌细胞的有效抑制作用。因此,MAPK/MNK-eIF4E-Wnt/β-catenin 信号通路在宫颈癌细胞化疗耐药中发挥正向调控作用,是提高宫颈癌化疗疗效或逆转化疗耐药的一个有希望的靶点。
3.2 乳腺癌
2020年,全球最新癌症负担数据中一个最明显的变化是乳腺癌新发病例数的快速增长,取代了肺癌成为全球第一大癌症,是全球女性与癌症相关死亡的首要原因。
既往研究表明,eIF4E 在乳腺癌细胞中的表达高于正常组织,eIF4E 表达升高的乳腺癌患者生存较差,累积复发率较高[21-22]。大多数乳腺癌细胞表达雌激素受体(ER+),并接受他莫昔芬的抗雌激素治疗。然而,他莫昔芬耐药性是导致大部分乳腺癌死亡的原因。Geter 等[23]研究发现,三苯氧胺耐药的翻译重编程是通过增加 eIF4E 的表达和过度活跃的 mTOR 来介导的,只有通过降低 eIF4E 表达或 mTOR活性并阻断 eIF4E 的 MNK1 磷酸化,才能恢复对他莫昔芬的再敏感性。Gong 等[24]通过全基因组转录组和翻译组分析,发现 eIF4E 过表达可以促进 ERα 和 FOXM1 信号通路介导的细胞活性,而正是 FOXM1 的高水平赋予了他莫昔芬耐药性,有助于 ER+乳腺癌抗雌激素不敏感。Tsoi等[25]发现 c-MYC 的过表达可通过促进核糖体的生物发生,诱导 eIF4E 的高表达,从而促进 ER+ve 乳腺癌的发生,并赋予他莫昔芬耐药性,提示抑制核糖体的生物发生可能有助于降低乳腺癌的侵袭性和逆转他莫昔芬耐药。
对乳腺癌患者的治疗来说,对经典化疗药物的耐药仍然是一个巨大的挑战。到目前为止,对化疗药物耐药获得的潜在机制仍然知之甚少。因此,提高治疗水平,避免耐药,更好地预测化疗疗效,将有助于改善乳腺癌患者的临床结局[21]。Li 等[26]研究发现,与化疗前相比,乳腺癌患者化疗后磷酸化(Ser209)eIF4E 水平增加了 3 ~ 11 倍,提示 eIF4E 磷酸化是乳腺癌患者化疗反应的共同特征,与不良临床结局显著相关,并且 eIF4E 磷酸化主要在乳腺癌细胞对化疗的反应中发挥作用,而不是在疾病的发展中发挥作用。除此之外,还发现 eIF4E 的缺失增强了乳腺癌细胞中化疗药物的抗增殖和促凋亡作用,证明了 MNK-eIF4E-β-catenin 是乳腺癌细胞对化疗反应的激活剂,并强调了抑制 MNK 以克服乳腺癌化疗耐药的治疗价值。此外,有学者发现 miR-141 通过直接靶向 eIF4E mRNA,作用于药物诱导凋亡所需的基因,使乳腺癌细胞对化疗药物多西他赛产生耐药性[27]。
3.3 胃癌
胃癌是消化系统常见的恶性肿瘤之一,其发病率和死亡率呈逐年上升趋势。eIF4E 在胃癌组织中表达明显高于在正常胃黏膜表达,eIF4E 的表达水平对胃癌的恶性程度的判断和临床进展有一定的意义[28]。显著的 eIF4E 过表达有助于胃癌的进展,并与血管侵犯和不良预后相关[29-30]。
目前,手术仍然是胃癌患者首选的治疗策略,但大多数患者明确诊断为晚期,不适合进行手术切除。虽然以铂为基础的化疗方案已成为胃癌晚期患者的标准治疗方法,但完全缓解率相对较低[31]。
对铂类药物如顺铂的耐药是胃癌治疗中的一个严峻挑战。Wang 等[32]发现抑制或敲除光激酶 A(AURKA)可降低顺铂耐药胃癌细胞模型中 p-eIF4E(S209)、HDM2 和c-MYC 的蛋白表达,表明 AURKA 可能是克服难治性胃癌和其他癌症中顺铂耐药的有效治疗方法。Wu 等[33]研究发现,与正常胃组织相比,FOXD1-AS1 在胃癌细胞中高表达,并且 FOXD1-AS1 可以从磷酸化的 4E-BP1 中释放eIF4E,后者通过激活 PI3K/Akt/mTOR 通路加强 eIF4E 与eIF4G 的相互作用,进而加重胃癌进程和顺铂化疗耐药。这为顺铂化疗耐药的胃癌患者提供了一个新的治疗靶点。
3.4 肺癌
肺癌是世界上癌症相关死亡的主要原因,可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。NSCLC 占肺癌病例的 85% ~ 90%,包括肺腺癌、肺鳞状细胞癌和大细胞癌[34]。已有多项研究报道 eIF4E 过表达和磷酸化与非小细胞或小细胞肺癌患者的不良预后显著相关[35-37]。
临床上,大多数 NSCLC 患者对目前的化疗/放射治疗方案反应不佳,5年生存率为 15%[38]。尽管近期的靶向治疗和免疫治疗提高了一小部分肺癌患者的平均生存期,但初始无应答、获得性耐药、复发仍是大多数 NSCLC 患者面临的严重问题。为了抑制 5' mRNA 帽介导的翻译,一种高度有效的 5' mRNA 帽和 eIF4E 复合物之间相互作用的抑制剂已经被开发出来。4Ei 是 ProTide 类化合物,具有较高的膜通透性,是 eIF4E 的强活性化学拮抗剂。许多相关研究发现,用 4Ei-1 或 4Ei-10 治疗 NSCLC 细胞会导致一组对维持恶性表型和抵抗凋亡至关重要的细胞蛋白的翻译抑制和表达减少,eIF4E 的表达水平显著降低,对目前用于NSCLC 治疗的吉西他滨抗肿瘤治疗更敏感[39-40]。
依维莫司是一种哺乳动物靶向 mTOR 抑制剂,用其治疗可使肿瘤抑制因子 miR-7-5p 降低,而细胞内 miR-7-5p缺失可诱导 MNK/eIF4E 轴的磷酸化,但补充外泌体miR-7-5p 可逆转这一过程[41]。因此,miR-7-5p 联合依维莫司均可通过靶向 MNK/eIF4E 轴和 mTOR 增强其抗癌疗效。此外,Thumma 等[42]研究发现,在 NSCLC 中,eIF4E水平显著升高。使用反义寡核苷酸可抑制 NSCLC 细胞系中 eIF4E 的表达,降低细胞增殖,增加对吉西他滨的敏感性。然而,Wang 等[43]报道 miR-141 抑制 eIF4E 增加了NSCLC 细胞对多西他赛的耐药,eIF4E 在多西他赛化疗耐药 NSCLC 患者中的表达明显低于多西他赛敏感 NSCLC患者。
SCLC 是一种神经内分泌肿瘤,是最具侵袭性的癌症之一,通常在晚期才被诊断出来。化疗在晚期 SCLC 患者的治疗中发挥着重要作用。相关研究表明,MYC 通过不依赖mTOR 的旁路途径直接激活 eIF4E,MYC 和 eIF4E 的升高降低了 SCLC 细胞对依维莫司的敏感性,参与 SCLC 细胞对依维莫司的耐药[44]。这些研究结果表明,评估 eIF4E 表达水平有助于评估 mTOR 抑制剂的耐药性,而控制MYC-eIF4E 轴是 SCLC 中mTOR 抑制的一种有前途的治疗策略。
4 eIF4E 的靶向治疗策略
鉴于许多学者研究发现 eIF4E 在多种肿瘤细胞中表达上调及活性异常增高,且 eIF4E 是许多关键通路的汇合点,对肿瘤的发生、发展、预后等起重要作用,因此,eIF4E 是肿瘤靶向治疗的关键靶点。但是,目前针对 eIF4E 的靶向治疗仍处于早期阶段,需要更多学者通过 eIF4E 的不同作用机制,研发出更具针对性的靶向药物。
4.1 抑制 PI3K/Akt/mTOR 调控通路
4EBP 可通过与 eIF4G 竞争性结合 eIF4E 结合位点,从而阻断 eIF4F 的组装,进而限制了帽依赖的翻译起始过程。当 4EBP 被磷酸化后,其与 eIF4E 的结合力大大减弱,释放 eIF4E,进而促进 eIF4F 的组装和翻译起始[45-46]。4EBP 通过 PI3K/Akt/mTOR 调控通路使其发生磷酸化,因此可利用 mTOR 抑制剂来阻断 4EBP 磷酸化。
mTOR 的机制靶点是一种高度进化保守的丝氨酸苏氨酸激酶,它控制着数量惊人的关键细胞过程,包括蛋白质合成、细胞生长和增殖、脂质代谢、线粒体功能、自噬和细胞骨架组织[47-49]。mTOR 抑制剂如雷帕霉素等能有效抑制肿瘤细胞的生长[50]。雷帕霉素作用肾癌细胞不同时间后,mTOR、p-4EBP 表达明显降低(P< 0.05),而磷酸化 eIF4E和 Akt 表达明显升高(P< 0.05),说明作为 mTOR 抑制剂的雷帕霉素可以促进 eIF4E 的磷酸化[51]。
4.2 抑制 eIF4E 的磷酸化
eIF4E 通过 MAPK/MNK 调控通路使其活化成为p-eIF4E,促进细胞增殖和恶性转化。因此,MNK 抑制剂是肿瘤靶向治疗的有效方法之一。其中包括 CGP57380[52]、尾孢霉胺[53]和 5-(2-(苯氨基)嘧啶-4-基)噻唑-2(3H)-酮衍生物[54]。
相关研究发现,CGP57380 在多发性骨髓瘤动物模型具有较好的抗肿瘤活性[55]。CGP57380 联合 mTOR 抑制剂在神经胶质母细胞瘤[56]和非小细胞肺癌[57]中能够显著抑制肿瘤细胞的生长,对肿瘤的治疗效果更好,能有效减弱 mTOR抑制剂导致的 eIF4E 磷酸化。用有效的 MNK1/2 降解剂VNLG-152R 靶向 MNK-eIF4E/mTORC1 信号传导是一种新的治疗策略,可用于治疗原发性/转移性三阴性乳腺癌(TNBC)患者[58]。
4.3 抑制 eIF4E 的表达
许多临床前研究表明,使用 RNA 干扰或反义技术下调eIF4E 可在癌细胞中产生抗肿瘤作用,使细胞毒性和抗侵袭活性以及对化疗药物的敏感性增加[59-62]。
Graff 等[63]首次尝试开发了一种针对 eIF4E 的反义寡核苷酸(ASO),该寡核苷酸优先抑制 eIF4E-敏感 mRNAs编码蛋白(如 VEGF、cyclin D1、survivin、c-Myc 和Bcl2)在培养细胞中的翻译。更重要的是,静脉注射 ASO 选择性地降低了人类肿瘤异种移植物中 eIF4E 的表达,并显著抑制了肿瘤生长。
4.4 抑制 eIF4E 与 mRNA 的 5' 端 m7GpppN 帽子结合
eIF4E 与 mRNA 的 5' 端 m7GpppN 帽子结合是控制翻译起始的限速步骤,因此是药物发现的一个有吸引力的靶点。
相关学者研究发现,7-苄基鸟苷一磷酸(7Bn-GMP)是eIF4E 帽结合的有效拮抗剂[64]。但是,7Bn-GMP 不具有细胞渗透性。而后发现 4Ei-1 是细胞可渗透的,并且可转化为 7Bn-GMP,从而拮抗 eIF4E 帽结合和启动 eIF4E 蛋白酶体降解来抑制 eIF4E-帽结合引起的翻译启动,并对肺癌和乳腺癌细胞进行化学增敏。在间皮瘤中,4Ei-1 有效地减少了集落形成,抑制了体外 cap 介导的复合物形成,减少了细胞增殖,并使细胞对培美曲塞敏感[65]。
4.5 抑制 eIF4F 的组装
上文已述,eIF4E 在与 mRNA 5′ 端 m7GpppN 帽子结构特异性地结合后,与 eIF4G、eIF4A 共同构成 eIF4F 复合物,参与调控翻译的启动位点和定位过程。因此,另一类有前途的抑制剂包括阻止 eIF4E-eIF4G 相互作用的化合物。
Papadopoulos 等[66]研究发现,4EGI-1 与 eIF4E 的一个远离 eIF4E-eIF4G 界面的区域结合,并诱导两个亚单位之间的相互作用的变构抑制。除了防止 eIF4G-eIF4E 相互作用外,4EGI-1 还稳定了 4EBP 与 eIF4E 的结合,从而加剧了 4E-SE mRNA 的翻译抑制。目前开发了新的 4EGI-1类似物,其与 eIF4E 的结合亲和力提高,对 eIF4E-eIF4G相互作用的抑制作用更强,未来的研究将确定这些类似物是否也具有更强的抗肿瘤活性和选择性[67]。
5 小结
目前普遍认为肿瘤的发生是一个多因素、多阶段、多基因变异积累及作用的复杂过程。继 1990年首次发现 eIF4E在肿瘤中的作用后,许多学者相继发现 eIF4E 作为肿瘤的癌基因在肿瘤治疗耐受的分子机制中发挥着至关重要的作用。未来希望在以 eIF4E 为靶点的肿瘤治疗耐受的研究领域有进一步发展,有助于改善患者的临床结局。

