实时荧光定量PCR 法检测外源性DNA在重组III 型人源化胶原蛋白冻干纤维中的残留
梁凯歌,孙丹丹
重组 III 型人源化胶原蛋白冻干纤维作为国内首个采用新型生物材料——重组人源化胶原蛋白制成的医疗器械,它的功能区具有 164.88° 柔性三螺旋结构,其氨基酸序列的重复单元与人类胶原的氨基酸序列特异性功能区一致,且生物相容性较好,其细胞的黏附性能优于人类 I、III 型胶原蛋白,与自然胶原有相似的性能和稳定性。与动物源性胶原相比,重组人源化胶原蛋白无病毒隐患、水溶性好、无排异反应,具有良好的修复性能,主要用于面部真皮组织填充以纠正额部动力性皱纹(包括眉间纹、额头纹和鱼尾纹),预计在血管内皮、子宫内膜、创面、口腔黏膜修复及骨科等领域具有更广阔的临床应用。
外源性 DNA 残留具有潜在的致癌风险,可能传递肿瘤或病毒相关基因,并导致癌变或其他病理变化,药品监督管理部门对外源性 DNA 残留量的要求非常严格[1]。重组 III 型人源化胶原蛋白冻干纤维在研发生产过程中可能会产生自身相关或工艺相关杂质以及外源污染物,因其广泛应用于人体,而外源性 DNA 进入人体后可能会导致基因突变,突变绝大多数会导致疾病,危害人体健康。因此,必须建立标准化外源性 DNA 残留检测方法,以满足对生物医药产品质量控制的要求。
本研究利用实时荧光定量 PCR 技术对重组III 型人源化胶原蛋白冻干纤维中的外源性 DNA残留量进行测定,并对该方法的线性、重复性和回收率进行验证。
1 材料与方法
1.1 材料
1.1.1 样本 重组 III 型人源化胶原蛋白冻干纤维(批号:20201102、20201201、20201202、20210802、20210803、20210901、20210902、20210904,规格:4 mg/瓶),由山西锦波生物医药股份有限公司提供。
1.1.2 试剂 宿主细胞残留 DNA 样本前处理试剂盒 I、II(磁珠法)、E.coli残留 DNA 检测试剂盒(PCR 荧光探针法)及相应引物和探针均为天津科佰迪生物医药科技有限公司产品,引物和探针序列如下:正向引物:5' CGCTGTAAGAGGACCGTAG 3',反向引物:5' GACCTCACGCAATCTTCTGA 3';探针:5' FAM-ACCGCTGCCTCCTCCTGCAGGMGB 3'。
1.1.3 仪器 BQHERO-32 Host rDNA 前处理系统为天津科佰迪生物医药科技有限公司产品;XK-400 型离心机、XK80-A 型快速混匀仪均为江苏新康医疗器械有限公司产品;SYG-1210 恒温水浴锅为美国精骐有限公司产品;Archimed X 系列实时荧光定量 PCR 仪为鲲鹏(徐州)科学仪器有限公司产品。
1.2 方法
1.2.1 样本制备
1.2.1.1 待测样本的制备 利用样本前处理试剂盒中的样本稀释液将重组 III 型人源化胶原蛋白冻干纤维溶解成 4 mg/ml 原液,即为待测样本。
1.2.1.2 加标回收质控样本的制备 取待测样本100 μl,加至 1.5 ml 干净的离心管中,加入 21 pg的E.colicontrol DNA 标准品,混匀。
1.2.2 标准曲线建立 用试剂盒中提供的 DNA稀释缓冲液将E.colicontrol DNA 进行梯度稀释,稀释浓度依次为 300、30、3、0.3 和 0.03 pg/μl。
1.2.3 测定方法
1.2.3.1 DNA 提取 按照宿主细胞残留 DNA样本前处理试剂盒进行处理,在 1.2.1 制备的样本中加入 10 μl 5 mol/L NaCl 溶液,用涡旋振荡器充分振荡 10 s;加入 15 μl 蛋白酶 K,在涡旋振荡器上充分振荡 10 s;配制新鲜的裂解液,其组成为:130 μl 裂解液/100 μl 样本,9 μl 肝糖原/100 μl 样本,0.2 μl tRNA/100 μl 样本,充分混匀;将 139 μl新鲜配制的裂解液加入到样本管中,然后用涡旋振荡器充分振荡 10 s,取出短暂快速离心 5 s,然后放置在 56 ℃ 孵育 30 min;孵育完成后的样品在 BOHERO-32 Host rDNA 前处理系统中进行核酸提取。
1.2.3.2 实时荧光定量 PCR 检测 参照E.coli残留 DNA 检测试剂盒(PCR-荧光探针法)方法,通过 Archimed X 系列实时荧光定量 PCR 仪,分别取不同浓度的 DNA 标准品、待测样本和加标回收样本 10 μl,pre-mix(2 × Taqman master 15 μl,10 ×E.coliqPCR 3 μl,RNase-free H2O 2 μl)20 μl进行 qPCR 扩增。扩增条件:50 ℃ 10 min,95 ℃10 min;95 ℃ 10 s,58 ℃ 1 min,45 个循环。每个样品做 3 个复孔。
1.2.4 方法确认 按照 1.2.3 对 3 批重组 III型人源化胶原蛋白冻干纤维(批号:20201102、20201201、20201202)进行准确性实验和回收率实验。加标回收样本测定值减去样本测定值后除以加入的 DNA 标准品的浓度即为回收率,回收率应在50% ~ 150% 之间。
1.2.5 方法学验证
1.2.5.1 重复性实验 按照 1.2.3 对 5 批重组III 型人源化胶原蛋白冻干纤维(批号:20210802、20210803、20210901、20210902、20210904)进行实验,确定方法的重复性。
1.2.5.2 中间精密度实验 由 3 名实验员独立检测重组 III 型人源化胶原蛋白冻干纤维的外源性 DNA 残留量,每个待测样本和加标回收质控样本做 3 个重复。
2 结果
2.1 标准曲线建立
2.1.1 qPCR 引物特异性 用 DNA 稀释缓冲液将E.colicontrol DNA 进行梯度稀释,以稀释浓度依次为 300、30、3、0.3、0.03 pg/μl 的 DNA 标准品为模板进行 qPCR 扩增,扩增曲线见图1。由图1 可知,扩增的各个时期曲线良好,呈“S”形,且线条光滑平稳,扩增效率高,符合定量检测的要求,引物具有特异性。
2.1.2 qPCR 定量检测标准曲线 以各质量浓度(300、30、3、0.3、0.03 pg/μl)的E.colicontrol DNA标准品为模板进行 qPCR 扩增反应,利用标准品测得 Ct 值作为纵坐标 y,标准品浓度(pg/μl)取对数作为横坐标 x,绘制标准曲线为 y = -3.3275x +26.921(R2= 0.9998),DNA 质量浓度在 0.03 ~300 pg/μl 内呈良好的线性关系,相关系数 > 0.99(图2),说明本方法适用于 pg 级别的微量 DNA残留检测。
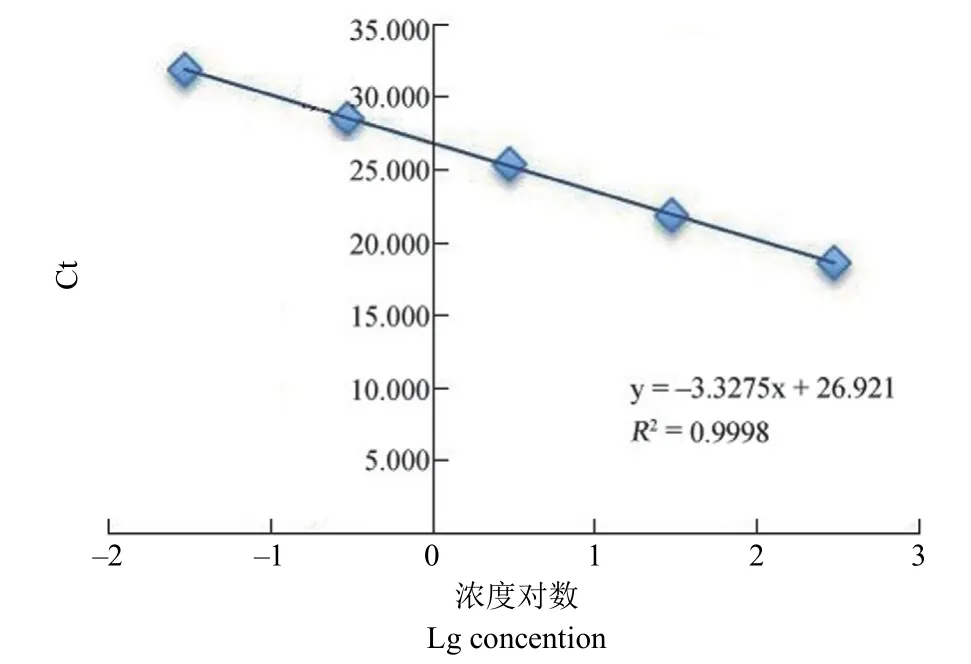
图2 E.coli control DNA 标准曲线图Figure 2 Standard curve of E.coli control DNA
2.2 方法确认
取重组 III 型人源化胶原蛋白冻干纤维 3 批(批号:20201102、20201201、20201202),按照1.2.3 进行准确性实验和回收率实验,实验结果(表1)显示 3 批样品 DNA 残留量均为 pg 级别,且回收率均在 50% ~ 150% 之间,符合质量控制要求。

表1 样品 DNA 残留量和回收率实验结果Table 1 Experimental results of sample DNA residue and recovery
2.3 方法学验证
2.3.1 重复性实验
2.3.1.1 标准曲线定量测定 为进一步确定上述方法对重组 III 型人源化胶原蛋白冻干纤维的适用性,以各质量浓度(300、30、3、0.3、0.03 pg/μl)的 DNA 为模板再次进行 qPCR 扩增反应,利用标准品测得 Ct 值作为纵坐标 y,标准品浓度(pg/μl)取对数作为横坐标 x,绘制标准曲线为y = -3.3592x + 27.05(R2= 0.9999), DNA 质量浓度在 0.03 ~ 300 pg/μl 内呈良好的线性关系,相关系数 > 0.99,确定引物具有特异性,E.colicontrol DNA 标准品适用于重组 III 型人源化胶原蛋白冻干纤维。
2.3.1.2 qPCR 定量检测样品 取重组 III 型人源化胶原蛋白冻干纤维5 批(批号:20210802、20210803、20210901、20210902、20210904),按照 1.2.3 进行实验,实验结果(表2)显示 5 批样品外源性 DNA 残留量除 1 批未检出外,其余批次均为 pg 级别,回收率和回收率 RSD 均符合《中国药典》2020年版 3407 外源性 DNA 残留量测定法第三法的要求,方法具有可重复性,qPCR法可用于重组 III 型人源化胶原蛋白冻干纤维外源性 DNA 残留量检测。
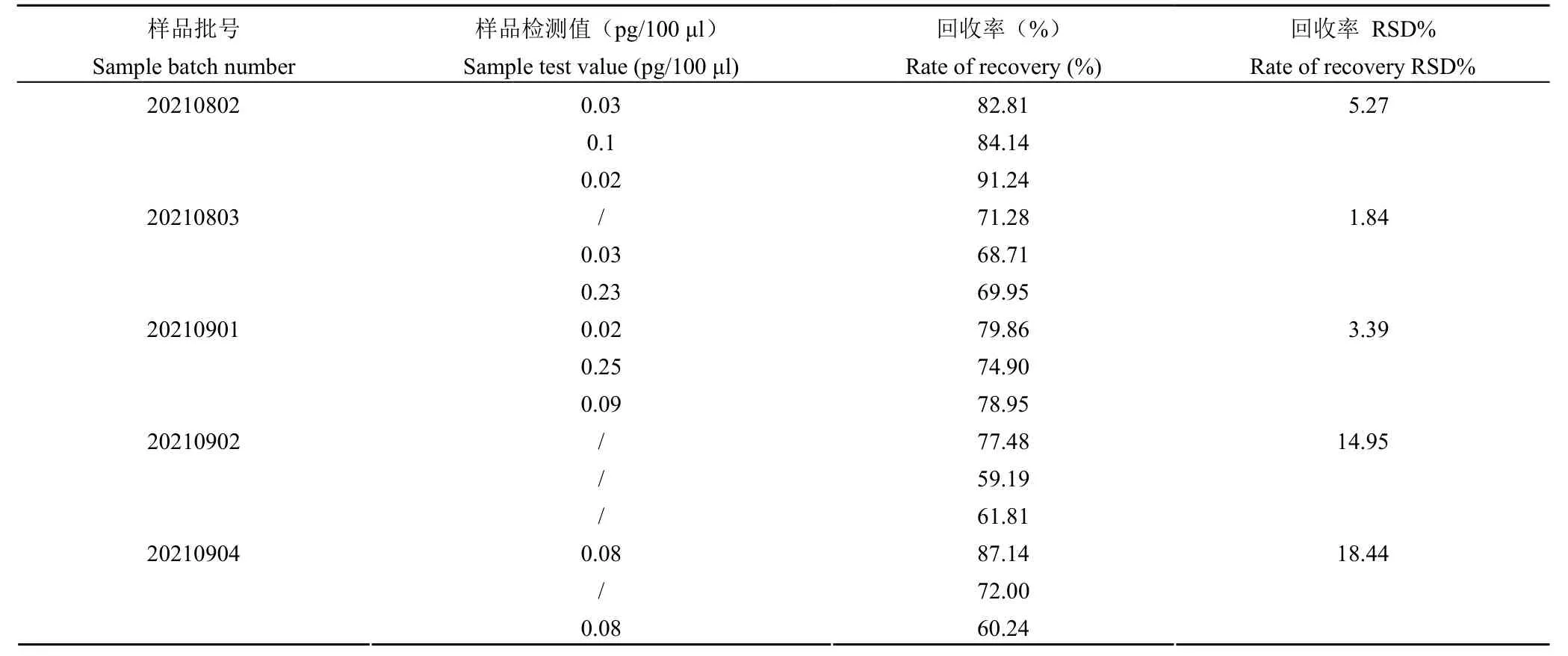
表2 重复性验证结果Table 2 Repeatability verification results
2.3.2 中间精密度实验 由 3 名实验员独立检测重组 III 型人源化胶原蛋白冻干纤维的外源性DNA 残留量,每个待测样本和加标回收质控样本做 3 个重复,根据实验结果(表3)可看出,3 名实验员测定结果标准曲线均具有良好线性,样本外源性 DNA 残留量均为 pg 级别,测得加标质控样本中回收率均在 75% 以上,3 名实验员外源性DNA 残留量的 RSD 为 11.59%,结果稳定性好,中间精密度良好。
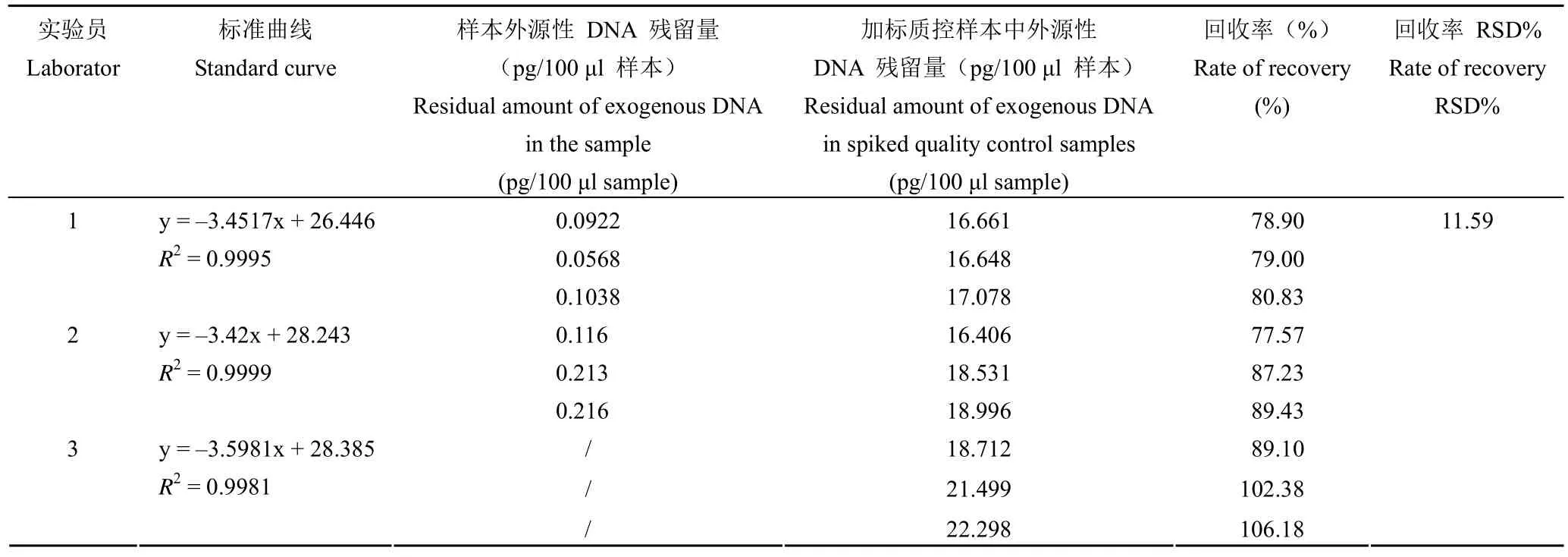
表3 中间精密度验证结果Table 3 Intermediate precision verification results
3 讨论
重组人源化胶原蛋白研发过程中,生产工艺除杂后仍有潜在的残留 DNA 片段,这些残留 DNA片段的大小和组成成分不明确,存在传染性、致瘤性、免疫原性增加或致突变等潜在风险,因此,外源性 DNA 残留也是各国药品监管部门监督管理的关键,基于安全质量控制,必须对产品中外源性DNA 残留量进行检测[2]。目前,已有多种检测方法被用于重组蛋白产品中外源性 DNA 残留的质量控制。《中国药典》2020年版中关于外源性 DNA残留量的检测方法有 3 种,DNA 探针杂交法、荧光染色法和定量 PCR 法。DNA 探针杂交法灵敏度高,但操作繁琐且不能对 DNA 进行定量;荧光染色法虽可对 DNA 进行定量,但其灵敏度低,检出限高,不适用于重组蛋白中微量 DNA 的检测。近年来,已有多篇文章研究 qPCR 技术在外源性DNA 残留量测定上的应用,并都取得了较好的结果[3-4]。qPCR 法的技术优势在于序列特异性高、灵敏度高、重现性好、人为干扰因素少,可以为生物制药行业在工艺研究和成品质量控制方面提供可靠的检测手段。
外源性 DNA 残留属于微量杂质,测定时受干扰因素较多,很难实现灵敏、准确、快速的检测。确保产品中残留 DNA 在提取过程中能被有效地提取,是采用 qPCR 对其进行准确定量的前提。本实验通过 BQHERO-32 Host rDNA 前处理系统,采用磁珠法提取 DNA,相较于传统的 DNA 提取方法(离心柱法、介质辅助离心法等),结合核酸自动提取仪的磁珠法在很大程度上减少了人为误差,提高了检测效率和检测准确性[5-6]。
根据《中国药典》2020 版,外源性 DNA 残留量应不超过每剂 10 ng。检测结果显示,重组III 型人源化胶原蛋白冻干纤维残留 DNA 处于pg 级别,远低于每剂 10 ng。本实验所建立的外源性 DNA 残留量检测方法,经过验证发现,qPCR法的线性、回收率、准确性均符合要求,且BQHERO-32 Host rDNA 前处理系统可实现微量DNA 的快速有效提取,该方法可有效用于重组胶原蛋白产品中外源性 DNA 残留量的特异性检测,为产品的质量控制奠定了基础。

