Secoemestrin C抑制肺腺癌细胞增殖和诱导凋亡的作用机制研究
李杨,赵午莉,司书毅,陈明华,邵荣光
恶性肿瘤是威胁人类生命健康的重大慢性疾病,在所有恶性肿瘤中肺癌发病率和死亡率均居首位[1]。近年来,我国男性和女性肺癌发病率均呈快速上升趋势,而与大多数国家相比,中国的肺癌死亡率相对较高,占所有癌症死亡人数的近 20%[2]。预计 2015 - 2030年间,中国的肺癌死亡率可能增加约 40%[3]。肺癌的发病通常十分隐匿,临床确诊时往往已经进展至中晚期,患者生存期短。目前,对于肺癌的治疗多采用放疗、化疗、手术和分子靶向治疗等手段,但常伴有复发转移和耐药性等问题[4]。因此迫切需要寻找毒性小,疗效好的治疗药物。
Secoemestrin C(Sec C)是从微生物发酵液中分离出来的具有抗肿瘤活性的多硫代二酮哌嗪类化合物。已有研究表明,Sec C 对胰腺癌及胰腺癌耐药细胞均具有明显的增殖抑制作用,可以通过内质网应激使内质网半胱氨酸残基硫酸化并降解Yes 相关蛋白(YAP),引起胰腺癌细胞的凋亡[5]。但 Sec C 的抗肺腺癌活性还未被报道。本研究进一步探讨 Sec C 对于肺腺癌的增殖抑制作用及其作用机制。
1 材料和方法
1.1 材料
1.1.1 细胞 人肺腺癌细胞 A549、H1299 细胞由本实验室保存。
1.1.2 实验试剂 细胞培养用 1640 培养基、胎牛血清均购自美国 Gibco 公司;10000 U/ml 青霉素、10000 μg/ml 链霉素、PBS 均购自中科迈晨科技有限公司;四甲基偶氮唑蓝(MTT)购自美国Sigma-Aldrich 公司;4% 多聚甲醛固定液、结晶紫染液、SDS-PAGE 蛋白上样缓冲液(5 ×)、细胞总蛋白的提取及定量所用的 RIPA 裂解液和 BCA试剂购自上海碧云天生物技术研究所;无水甲醇、DMSO 购自北京化工厂;Western blot 所用一抗购自美国 Cell Signaling Technology 公司;辣根过氧化物酶标记的二抗购自北京中杉金桥生物技术有限公司;发光液购自美国 Millipore 公司;5-乙炔基-2' 脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒购自广州锐博生物科技有限公司;N-乙酰半胱氨酸(NAC)购自美国 Selleck Chemical 公司;DAPI购自美国 Invitrogen 公司。
1.1.3 实验仪器 倒置显微镜为日本 Olympus公司产品;酶标仪为美国BioTek 公司产品;化学发光检测仪为美国 SpectraMax 产品。
1.2 方法
1.2.1 MTT 法检测 Sec C 对 A549 和 H1299细胞的杀伤活性 取对数生长期的 A549 和 H1299细胞,消化离心后,计数。按照每孔 5 × 103个/200 μl的密度接种于 96 孔板中,孔板边缘用无菌 PBS缓冲液填充,以单加培养基的孔为空白对照。将孔板转移至 37 ℃、5% CO2的培养箱中培养。24 h后,各孔分别加入 Sec C 200 μl,对倍稀释至 10、5、2.5、1.25、0.625、0.3125、0.15625 μmol/L,每组设 3 个复孔,同时设阴性对照孔。药物作用 48 h后加入 5 mg/ml MTT 溶液 40 μl,继续培养 3 h后,小心吸去上清,加入 DMSO 150 μl,振荡 5 min。用酶标仪测定其在 490 nm 处的光密度值(OD490)。计算 Sec C 对 A549 和 H1299 的半数抑制率(IC50)。
1.2.2 EdU 掺入试验 A549 和 H12199 细胞分别用 0.5 μmol/L Sec C 处理24 h 后加入适量 EdU工作液孵育 3 h,进行 EdU 细胞增殖检测实验,根据试剂盒操作说明书进行 4% 多聚甲醛固定、清洗、EdU 反应、DAPI 染色等步骤完成实验,使用荧光显微镜拍照。
1.2.3 克隆形成实验 取对数生长期的A549 和H1299 细胞消化离心后,计数。按照每孔 1000 个细胞接种于六孔板中,24 h 后待细胞贴壁后换液,并用不同浓度的 Sec C 处理 7 d。用 PBS 清洗细胞后,加甲醇室温固定 15 min,加结晶紫染色15 min,吸去染色液,PBS 漂洗至背景透明,风干拍照。以大于 50 个细胞/集落为标准计算克隆形成率,克隆形成率(%)=(细胞集落数/初始接种细胞数)× 100%。
1.2.4 Western blot 检测 将细胞以 3 × 105个/孔的密度接种于六孔板,用不同浓度的 Sec C 处理24 h,同时设置不含 Sec C 的对照组,随后收集细胞用 RIPA 裂解液提取细胞中的总蛋白,冰上裂解30 min,4 ℃、12 000 r/min 离心 15 min 后取上清,并用 BCA 试剂进行蛋白定量。各取 25 μg 总蛋白进行 SDS-PAGE 电泳,电泳完成后,将凝胶中的蛋白转印至 PVDF 膜上,5% 脱脂奶粉封闭;一抗(1∶1000)4 ℃ 过夜孵育,次日使用 1∶5000 稀释的 HRP 标记的二抗,室温孵育 2 h,化学发光液显色,凝胶成像仪扫描拍照。
1.2.5 NAC 部分逆转 Sec C 引起的增殖抑制、内质网应激和细胞凋亡 将细胞以适宜数量接种于平板中,用 25 μmol/L NAC 与不同浓度的 Sec C共同作用。EdU 掺入实验、克隆形成实验和Western blot 检测 NAC 对 Sec C 引起的增殖抑制、内质网应激和细胞凋亡的逆转作用。
1.3 统计学处理
实验数据以±s表示,组间比较采用t检验,P< 0.05 为差异具有统计学意义。
2 结果
2.1 Sec C 能够有效杀伤肺腺癌细胞
Sec C 与肺腺癌 A549 和 H1299 细胞共同孵育 3 h 后,光镜下可见细胞开始聚集并逐渐变圆;处理 6 h 后,细胞形态学特征发生明显变化;至24 h,可观察到细胞膜局部破损、细胞内容物泄出等现象(图1A)。结果表明 Sec C 能够在短时间内迅速杀伤肺腺癌细胞。
MTT 实验结果显示,Sec C 对 A549 细胞和H1299 细胞的 IC50分别为(2.164 ± 0.583)μmol/L和(2.341 ± 0.098)μmol/L(图1B),具有较强的增殖抑制作用。
采用 EdU 掺入法检测 Sec C 对 DNA 复制的影响。与对照组相比,0.5 μmol/L Sec C 处理 24 h后,EdU 阳性细胞率明显降低,约为对照细胞的33.2%(图1C),表明 Sec C 对 DNA 复制具有明显的抑制作用。
进一步,采用平板克隆形成法验证 Sec C 对增殖的抑制作用。A549 细胞和 H1299 细胞用不同浓度的 Sec C 孵育 7 d,结果显示 Sec C 以剂量依赖的方式抑制肺腺癌细胞的克隆形成(图1D)。当浓度为 0.8 μmol/L 时,处理细胞克隆形成率约为对照细胞的 42.3%。
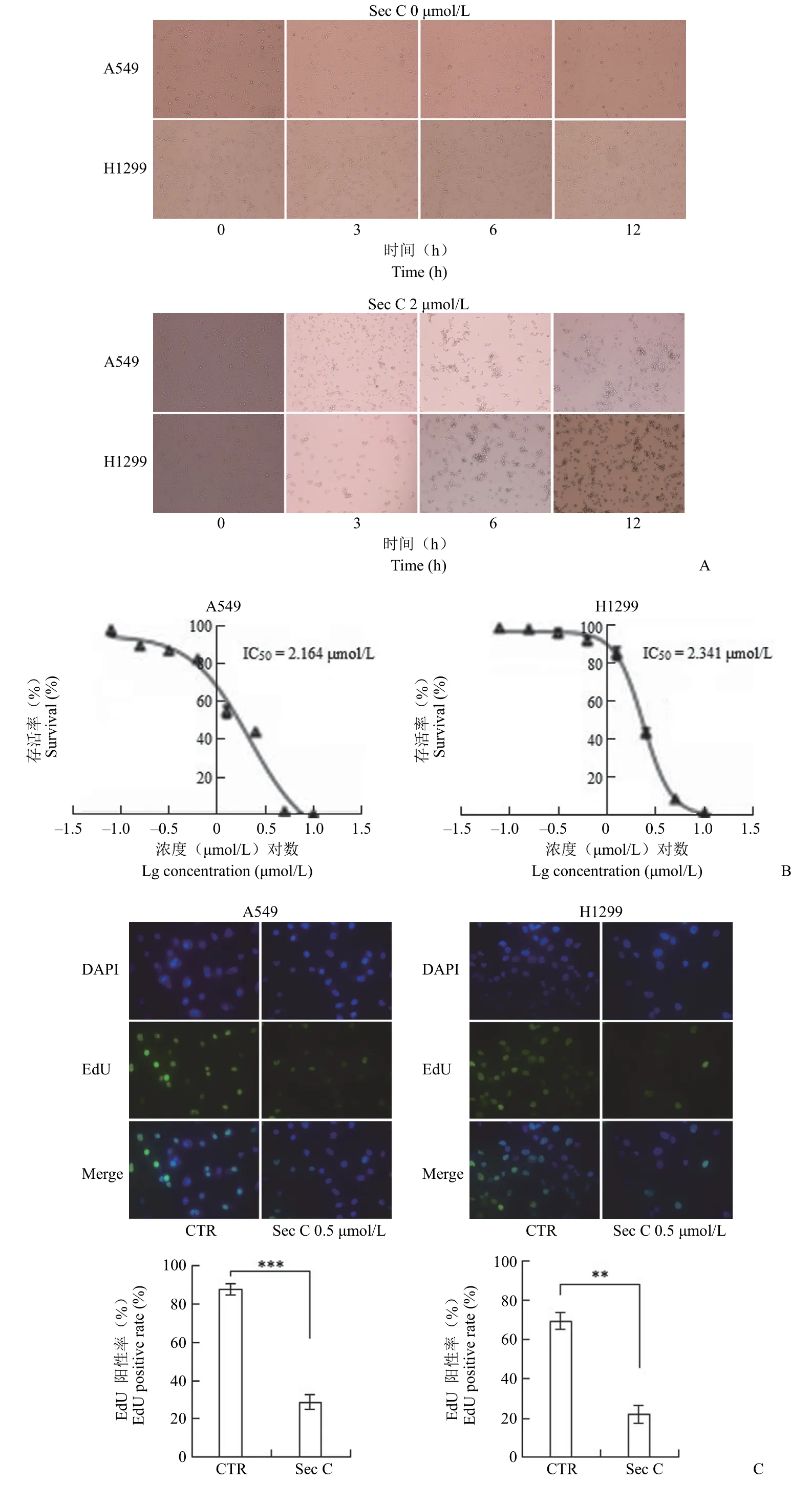

图1 Sec C 能够有效杀伤肺腺癌细胞(A:A549 和 H1299 细胞经 2 μmol/L Sec C 作用不同时间点后观察细胞形态;B:MTT 法检测不同浓度的 Sec C 作用于 A549 和 H1299 48 h 后的细胞存活率;C:EdU 掺入法检测经 0.5 μmol/L Sec C作用 24 h 后 A549 和 H1299 的细胞增殖;D:A549 和 H1299 细胞经不同浓度的 Sec C 作用 7 d 后的克隆形成能力;*P < 0.05,**P < 0.01,***P < 0.001)Figure 1 Sec C was effective in killing lung adenocarcinoma cells (A: Cell morphology of A549 and H1299 cells after 2 μmol/L Sec C at different time points; B: Cell survival rate of A549 and H1299 after 48 h of Sec C at different concentrations by MTT; C: Cell proliferation of A549 and H1299 after 24 h of 0.5 μmol/L Sec C by EdU assay; D: Colony ability of A549 and H1299 cells after 7 d of Sec C at different concentrations; *P < 0.05, **P < 0.01, ***P < 0.001)
2.2 Sec C 诱导肺腺癌细胞内质网应激并促进细胞凋亡
有报道,Sec C 可以诱导细胞发生内质网应激[5],而异常内质网应激可引起细胞凋亡[6]。Western blot 结果表明,与对照组相比,Sec C 能够促使内质网应激相关蛋白 BiP、p-eIF2α、IRE1α、ATF4 的表达增多,激活 IRE1α/eIF2α/ATF4 信号通路以抑制整体蛋白质的合成,且呈时间依赖和浓度依赖(图2);同时,与对照组相比,Sec C 也使得PARP、caspase3 和 caspase7 蛋白水平降低,cleaved-PARP、cleaved-caspase3 和 cleaved-caspase7蛋白水平升高(图3),提示激活了 caspase 凋亡通路。

图2 Sec C 诱导肺腺癌细胞内质网应激相关蛋白的表达(A:A549 细胞;B:H1299 细胞;C:A549 细胞经 8 μmol/L Sec C 作用;D:H1299 细胞经 1 μmol/L Sec C 作用)Figure 2 Sec C induced expression of endoplasmic reticulum stress-related proteins in lung adenocarcinoma cells (A: A549 cells;B: H1299 cells; C: A549 cells treated with 8 μmol/L Sec C; D: H1299 cells treated with 1 μmol/L Sec C)

图3 Sec C 诱导肺腺癌细胞中凋亡相关蛋白的表达(A:A549 细胞;B:H1299 细胞;C:A549 细胞经 8 μmol/L Sec C 作用;D:H1299 细胞经 1 μmol/L Sec C 作用)Figure 3 Sec C induced expression of apoptosis-related proteins in lung adenocarcinoma cells (A: A549 cells; B: H1299 cells;C: A549 cells treated with 8 μmol/L Sec C; D: H1299 cells treated with 1 μmol/L Sec C)
2.3 NAC 部分逆转 Sec C 引起的增殖抑制、内质网应激和细胞凋亡
前期研究证明,Sec C 可与内质网上丰富的半胱氨酸残基硫化形成二硫键,从而阻断硫醇蛋白平衡并诱导未折叠蛋白效应[5]。我们加入半胱氨酸衍生物 NAC 断裂二硫键或取代蛋白质中的半胱氨酸残基来发挥其还原活性[7]。EdU 掺入法和克隆形成实验证明,在 Sec C 处理的细胞中加入 NAC后,NAC 可以部分逆转 Sec C 引起的增殖抑制(图4);Western blot 结果表明,NAC 可抑制Sec C 诱导的内质网应激及 caspase 凋亡通路相关蛋白的激活(图5)。

图4 NAC 部分逆转 Sec C 引起的增殖抑制(A:EdU 掺入法检测 A549 和 H1299 细胞经 0.5 μmol/L Sec C 与 25 μmol/L NAC 共同作用 24 h 后的细胞增殖;B:A549 和 H1299 细胞分别经 0.6、0.1 μmol/L Sec C 与 25 μmol/L NAC 共同作用7 d,检测细胞的克隆形成能力; **P < 0.01,***P < 0.001)Figure 4 NAC partially reversed Sec C-induced proliferation inhibition (A: EdU assay to detect cell proliferation of A549 and H1299 cells after 0.5 μmol/L Sec C co-administered with 25 μmol/L NAC for 24 h; B: A549 and H1299 cells were subjected to 0.6 and 0.1 μmol/L Sec C co-administered with 25 μmol/L NAC for 7 d, respectively, to detect the colony ability of the cells; **P < 0.01,***P < 0.001)

图5 NAC 部分逆转 Sec C 引起的内质网应激和细胞凋亡(A:A549 细胞经 8 μmol/L Sec C 与 25 μmol/L NAC 共同作用 24 h 后,细胞中内质网应激相关蛋白的表达;B:H1299 细胞经 1 μmol/L Sec C 与 25 μmol/L NAC 共同作用 24 h 后,细胞中内质网应激相关蛋白的表达;C:A549 细胞经 8 μmol/L Sec C 与 25 μmol/L NAC 共同作用 24 h 后,细胞中凋亡相关蛋白的表达;D:H1299 细胞经 1 μmol/L Sec C 与 25 μmol/L NAC 共同作用 24 h 后,细胞中凋亡相关蛋白的表达)Figure 5 NAC partially reversed Sec C-induced endoplasmic reticulum stress and apoptosis (A: Expression of endoplasmic reticulum stress-related proteins in A549 cells after 8 μmol/L Sec C co-administered with 25 μmol/L NAC for 24 h; B: Expression of endoplasmic reticulum stress-related proteins in H1299 cells after 1 μmol/L Sec C co-administered with 25 μmol/L NAC for 24 h;C: Expression of apoptosis-related proteins in A549 cells after 8 μmol/L Sec C co-administered with 25 μmol/L NAC for 24 h;D: Expression of apoptosis-related proteins in H1299 cells after 1 μmol/L Sec C co-administered with 25 μmol/L NAC for 24 h)
3 讨论
天然药物资源丰富,已经成为了抗癌药物的重要来源[8]。源自天然来源的化合物由于其药效团的多样性和新的作用机制表现出更好的生物活性和低毒性,已成为开发新药及先导化合物的宝藏[9]。Sec C 是从真菌 1454 大米发酵产物中分离提取出的一种多硫代二酮哌嗪类化合物,能够有效抑制肿瘤生长。
自 1997年发现以来,Sec C 对多种癌症均表现出良好的抑制作用。本研究首次评估了 Sec C 对肺腺癌细胞的影响,并初步阐明了其发挥抗肺腺癌作用的潜在机制。我们发现 Sec C 能够有效抑制肺腺癌细胞增殖,促进肺癌细胞发生内质网压力应激,进一步引起细胞凋亡。
内质网是细胞内蛋白质合成和加工的重要场所[10]。当其受到外界刺激时内质网稳态失衡,引起未折叠或错误折叠蛋白在内质网腔中积累,持续的内质网应激反应可以诱导细胞凋亡,以维持细胞内的稳态[11]。在未折叠蛋白反应过程中,内质网分子伴侣 BiP 可结合未折叠蛋白,避免其在内质网内聚集,BiP 的过表达被认为是内质网应激反应发生的标志性事件之一[12]。内质网发生功能紊乱后,激活 eIF2α 引起 eIF2α 上的 N 端第51 位丝氨酸磷酸化,从而减少内质网错误蛋白的折叠与聚集[13]。IRE1α 是内质网上的跨膜蛋白,在内质网发生功能紊乱初期,IRE1α 通过促进转录因子 XBP1 的生成[14],使细胞内环境恢复稳态。当内质网应激持续发生,eIF2α 持续磷酸化,IRE1α 持续激活,诱导ATF4 产生,导致多种 mRNA 降解,蛋白质合成受阻,发生细胞凋亡。细胞凋亡是细胞在受到一系列信号刺激后发生的主动性细胞死亡过程[15]。半胱氨酸蛋白酶(caspase)家族是直接导致凋亡细胞解体的蛋白酶系统,在诱导细胞凋亡的分子机制中起着关键作用。在凋亡因子的作用下,caspase 酶原受到切割形成有活性的蛋白水解酶,对维持细胞结构及生命活动所必需的蛋白进行裂解,最终导致细胞死亡[16]。caspase3 在细胞凋亡过程中发挥重要作用,PARP 作为 caspase3 下游的信号分子,当大量氧化剂或自由基存在时,PARP 被过度激活,引起ATP 的过度消耗,促进细胞凋亡[17]。
本研究结果显示,与对照组相比,Sec C 处理后细胞内质网应激相关蛋白 BiP、ATF4、IRE1α、p-eIF2α 蛋白表达水平显著升高,凋亡相关蛋白caspase3、caspase7、PARP 蛋白表达水平显著降低。加入半胱氨酸衍生物 NAC 后,与 Sec C 组相比,细胞的增殖抑制作用得到部分逆转,内质网应激相关和凋亡相关蛋白表达水平显著回降。提示 Sec C通过持续的内质网应激激活 IRE1α-p-eIF2α-ATF4通路,进而导致细胞凋亡。
综上所述,Sec C 可抑制肺腺癌 A549 和H1299 细胞的增殖,引起细胞凋亡,其机制可能与使 IRE1α、p-eIF2α 蛋白激活,ATF4 表达增多,引起细胞内质网应激有关。Sec C 作为一种新型的抗肿瘤化合物表现出良好的抗肺腺癌活性,有望成为治疗肺腺癌的候选化合物。

