术前白蛋白与碱性磷酸酶比值对肝切除术后肝细胞癌患者临床预后的评估价值
陈 石,周 元,马春阳
(南通市肿瘤医院肝胆胰外科,江苏 南通 226006)
肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最为多见的一种病理类型,具有发病隐匿、恶性程度高和预后差的特点,临床上主要采用根治性切除手术治疗[1]。尽管手术治疗HCC可帮助患者改善临床症状和生活质量,但部分患者术后仍易出现复发,且死亡率较高[2]。因此,早期采取有效指标评估HCC肝切除术患者预后情况对尽早调整治疗方案和延长患者生存期具有重要意义。癌症的发生、发展与机体免疫炎症反应密不可分,白蛋白与碱性磷酸酶比值(AAPR)是新近出现的一项与肿瘤预后有关的实验室指标,能较好地反映肿瘤相关性炎症及免疫、营养状态,其比值大小与肾癌患者的不良预后有关[3],但其在HCC肝切除术患者预后中的预测价值尚不明确。鉴于目前,关于AAPR与HCC肝切除术患者预后相关性方面的研究报道较少,因此,本研究旨在探讨HCC肝切除术患者术前AAPR水平与临床预后的关系,以期为临床HCC肝切除术患者预后的评估提供一些参考依据,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2019年7月至2020年6月期间于南通市肿瘤医院就诊的行肝切除术的132例HCC患者的临床资料,其中男性85例,女性47例;年龄37~81岁,平均(58.57±10.24)岁;TNM分期[4]:Ⅰ期21例,Ⅱ期36例,Ⅲ期58例,Ⅳ期17例。纳入标准:均符合《原发性肝癌诊疗规范(2017年版)》[5]中关于HCC的诊断标准,并首次行肝切除术治疗者;肝功能Child-Pugh分级[6]为A~B级者;术前未接受放、化疗,射频消融术者;临床及随访资料完整者等。排除标准:合并其他严重器质性疾病、感染性疾病者;存在全身免疫性疾病或血液系统疾病者;肝外转移者;存在精神疾病者等。本研究经院内医学伦理委员会审核批准。
1.2 研究方法
1.2.1 资料收集 收集所有患者的临床一般资料,包括性别、年龄、肿瘤直径、肿瘤数目、肿瘤TNM分期、有无微血管癌栓、有无肝硬化、术前AAPR、肝功能Child-Pugh分级、乙肝表面抗原等情况。采集所有患者入院后空腹静脉血5 mL,经3 500 r/min离心10 min后,提取血清,采用全自动生化分析仪(重庆润康生物科技有限公司,渝械注准20192220170,型号:RC-480)检测患者血清中的白蛋白、碱性磷酸酶水平,并计算AAPR=血清白蛋白/碱性磷酸酶。
1.2.2 手术方法 所有患者均行肝切除术治疗,患者取仰卧位,全身麻醉后,建立二氧化碳气腹,于腹腔镜下检测肿瘤大小、形态、位置等,游离肝脏,解剖并分离肝十二指肠韧带血管,切除肿瘤组织后,行血管、胆管结扎及肝门阻断,止血后,冲洗腹腔,并放置引流管。
1.2.3 随访方法 术后对所有患者均进行随访追踪,随访结束至死亡日期或术后2年,随访方式为电话和门诊,记录患者术后的肿瘤复发及转移情况。复发及转移根据病理组织学证据或影像学、血清学检查结果进行确认。
1.3 观察指标①根据随访记录,统计132例HCC患者行肝切除术后2年的预后情况,并根据影像学检查将存在肿瘤复发、淋巴结转移、肝内转移、肺转移等患者纳入预后不良组,将无转移、复发、死亡的患者纳入预后良好组。②分析不同预后患者白蛋白、碱性磷酸酶及AAPR水平变化。③采用受试者工作特性(ROC)曲线分析AAPR对132例HCC患者肝切除术后预后的预测效能。④统计预后不良组和预后良好组患者的一般资料,并进行单因素分析。⑤将单因素分析中差异有统计学意义的指标纳入多因素Logistic回归模型中,分析影响肝切除术后患者预后的独立危险因素。
1.4 统计学方法采用SPSS 20.0统计学软件分析数据,计数资料以[ 例(%)]表示,行χ2检验;计量资料经K-S法检验符合正态分布,以()表示,行t检验;通过ROC曲线分析术前AAPR对HCC患者肝切除术后预后的预测价值;采用多因素Logistic回归模型分析影响肝切除术后患者预后的独立危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 132例HCC肝切除术患者预后情况132例行肝切除术HCC患者在随访期间发生肿瘤复发51例,淋巴结转移9例,肝内转移4例,肺转移4例,出现预后不良共68例(预后不良组),占51.52%;预后良好患者64例(预后良好组),占48.48%。
2.2 不同预后HCC肝切除术患者的术前AAPR水平比较经比较,预后不良组患者术前白蛋白、AAPR水平均显著低于预后良好组,碱性磷酸酶水平显著高于预后良好组,差异均有统计学意义(均P<0.05),见表1。
表1 不同预后HCC肝切除术患者术前AAPR水平比较( )
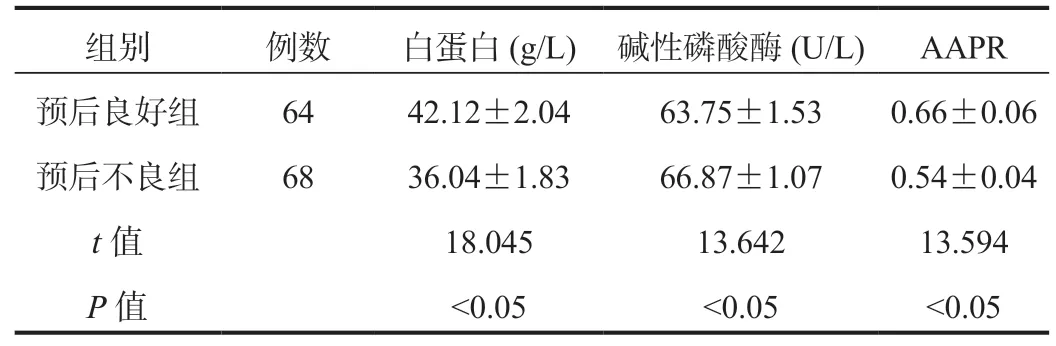
表1 不同预后HCC肝切除术患者术前AAPR水平比较( )
注:HCC:肝细胞癌;AAPR:白蛋白与碱性磷酸酶比值。
组别 例数 白蛋白(g/L) 碱性磷酸酶(U/L) AAPR预后良好组 64 42.12±2.04 63.75±1.53 0.66±0.06预后不良组 68 36.04±1.83 66.87±1.07 0.54±0.04 t值 18.045 13.642 13.594 P值 <0.05 <0.05 <0.05
2.3 术前AAPR对132例HCC肝切除术患者预后的预测效能经ROC曲线分析,结果显示,白蛋白、碱性磷酸酶、AAPR预测HCC肝切除术患者预后的曲线下面积(AUC)分别为0.717、0.724、0.770,灵敏度分别为48.53%、57.35%、83.82%,特异度分别为92.19%、81.25%、65.62%,AAPR预测的AUC、灵敏度均高于白蛋白、碱性磷酸酶,差异均有统计学意义(均P<0.05),见图1、表2。

表2 HCC肝切除术患者预后的ROC曲线分析

图1 术前AAPR预测HCC肝切除术患者预后的ROC曲线
2.4 影响HCC肝切除术患者预后的单因素分析经单因素分析,结果显示,预后不良组肿瘤直径≥ 5 cm、有微血管癌栓、术前AAPR<0.59的患者占比均显著高于预后良好组,差异均有统计学意义(均P<0.05),见表3。
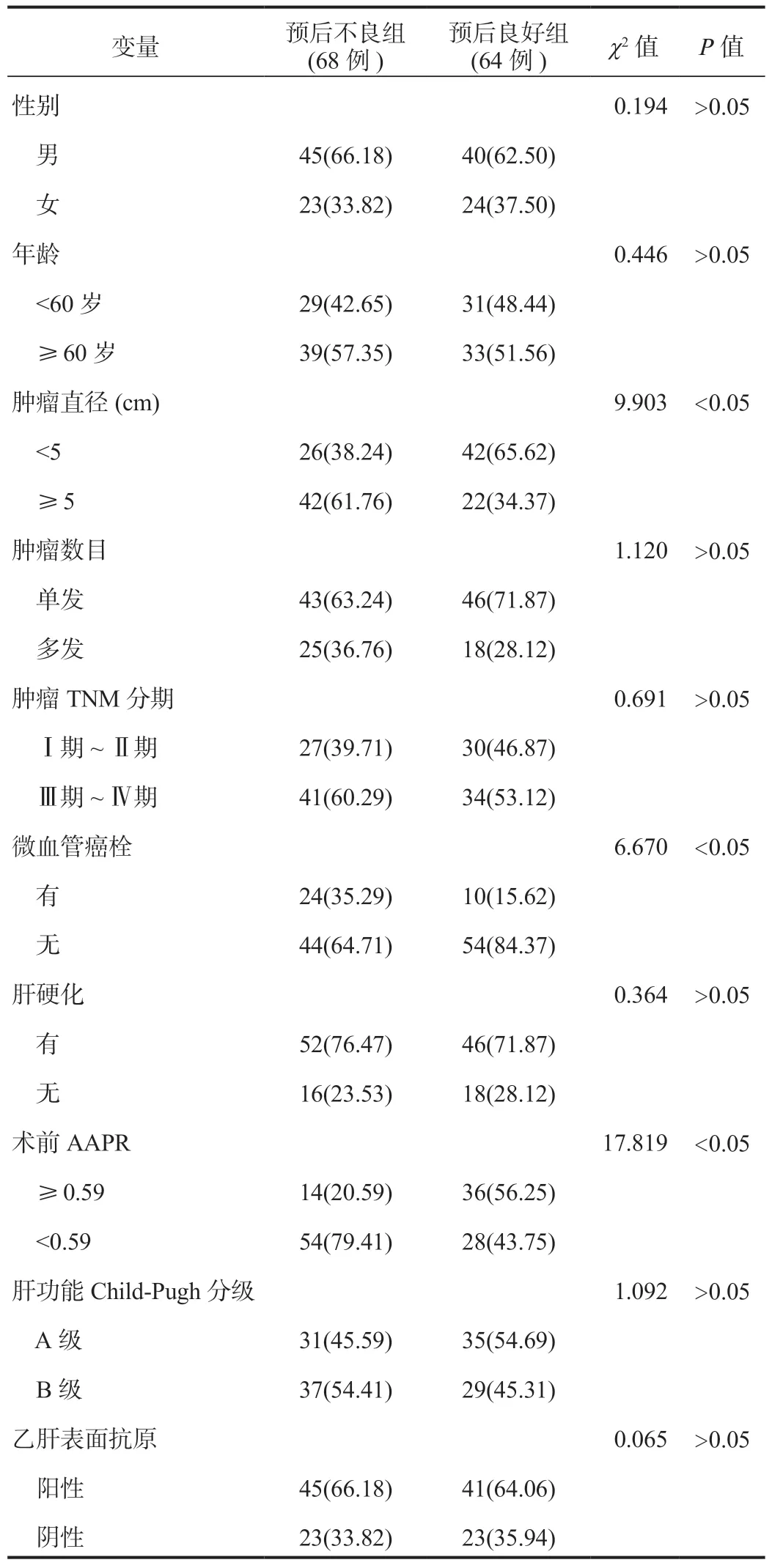
表3 影响HCC患者肝切除术后预后不良的单因素分析[ 例(%)]
2.5 影响HCC肝切除术患者预后的多因素Logistic回归模型分析以HCC肝切除术患者术后是否出现预后不良作为因变量,以单因素分析中差异有统计学意义的因素作为自变量并进行赋值,其中肿瘤直径(<5 cm=0,≥ 5 cm=1)、是否存在微血管癌栓(无=0,有=1)、术前AAPR水平(≥ 0.59=0,<0.59=1),将其引入Logistic回归模型中进行多因素分析,结果显示,肿瘤直径≥ 5 cm、有微血管癌栓、术前AAPR<0.59均是HCC肝切除术患者术后预后不良的危险因素,差异均有统计学意义(OR=2.344、2.477、2.743,均P<0.05),见表 4。

表4 影响HCC肝切除术患者预后的多因素Logistic回归模型分析
3 讨论
HCC是临床上比较常见的消化系统恶性肿瘤,死亡率较高,且有近70%的HCC患者可在术后5年内出现肝癌的转移和复发[7],而本研究观察了术后2年的患者随访情况发现,预后不良患者可占51.52%,偏高于熊亮霞等[8]研究的46.93%,这可能是与本研究仅纳入了本单位患者,且纳入患者的病情程度不一所导致的。而临床常见评估肝癌预后的指标有甲胎蛋白、癌胚抗原等,但其诊断敏感性不高,且易受多种混杂因素干扰[9]。因此,临床仍旧致力于寻找能够有效地对肝癌预后进行预测的标志物。
白蛋白由585个氨基酸残基组成,是评估机体营养状态的重要指标,也可反映患者机体的炎症反应,在维持血浆胶体渗透压、运输营养物质等微环境系统方面起着重要作用[10];此外,有研究显示,白蛋白还具有稳定细胞生长和DNA复制、缓冲生化改变及对致癌物的抗氧化作用等多种抗癌能力,与肿瘤进展、转移密切相关[11]。碱性磷酸酶作为一种水解酶,主要在肝、骨骼、肾等组织中分布,目前有研究发现,其可参与机体肿瘤的发生发展与免疫微环境的塑造,影响肾癌患者的预后[12]。而AAPR是白蛋白与碱性磷酸酶的比值,能综合反映机体炎症和营养状态,陈智良等[13]学者将其用于预测胃癌患者的预后中发现,其对预测胃癌预后的AUC值可达0.637,且对于AAPR<0.586的患者,其5年累积生存率仅41.7%,显著低于AAPR>0.586患者的86.7%,进而表明其对预测胃癌患者的预后具有较高的效能;另外,张志昱等[14]研究中得出,AAPR水平与前列腺癌根治术患者术后的生化复发和生存时间有关,且随着AAPR的降低,其生化复发的发生率上升,无生化复发生存时间缩短。而目前关于AAPR在HCC肝切除术患者预后评估中的应用研究报道不多,推测其可能与HCC患者预后具有一定联系,故而开展本研究。
本研究通过回顾分析不同预后患者的术前AAPR水平发现,预后不良组患者术前白蛋白、AAPR水平均显著低于预后良好组,碱性磷酸酶水平显著高于预后良好组,提示白蛋白、碱性磷酸酶、AAPR水平均与患者预后存在显著关系。另外,本研究经ROC曲线分析,其结果显示,AAPR对预后预测的AUC、灵敏度和特异度均高于白蛋白、碱性磷酸酶,从而证明了AAPR对HCC肝切除术患者预后具有较高的预测价值。因此,本研究对HCC肝切除术患者预后进行单因素和多因素分析,结果发现,肿瘤直径≥ 5 cm、有微血管癌栓、术前AAPR<0.59均是HCC肝切除术患者预后不良的危险因素,究其原因,肿瘤直径越大的患者,其肿瘤负荷就越大,恶性程度越高,因此,其发生转移的可能性就越大[15-16]。因此,对于此类患者,临床可在患者肝切除术后根据患者情况选择是否进行放化疗辅助治疗,同时嘱患者定期复查,必要时给予相应的营养支持与护肝治疗,以最大程度改善患者预后。微血管癌栓是癌细胞在血循环中播散的一种标志,也是肿瘤转移的早期,其可通过促进血管形成、诱导癌细胞增殖、抑制细胞凋亡等,影响患者预后[17-18]。故针对此类患者,可于术前给予患者相应分子靶向药物来阻断新生血管的形成,间接地抑制肿瘤细胞的生长,进而延长患者的生存期。而低水平AAPR的患者机体自身可能存在较强的炎症反应、营养不良和免疫力低下的情况,更利于肿瘤的发生发展,从而加大患者术后预后不良的风险[19-20]。而针对该类患者,临床应注意予以患者补充营养,以清淡、高热量、优质蛋白为主,必要时予以患者静脉补充白蛋白,以增加血容量,为机体组织提供营养,从而增强患者的免疫力。
综上,术前AAPR的水平与HCC肝切除术患者的临床预后密切相关,其对HCC肝切除术患者预后具有较高的预测价值,且肿瘤直径≥ 5 cm、有微血管癌栓、术前AAPR<0.59均是影响患者肝切除术后预后不良的重要危险因素,临床应对存在以上危险因素的患者予以相应的对症处理,以最大程度改善HCC肝切除术患者的预后,延长其生存期限。

