KRAS、NRAS 及BRAF 基因突变与结直肠癌肝转移的关系
苟海梅 ,方 莉 ,钟晓武
(1)川北医学院附属医院检验科,四川 南充 637000;2)川北医学院检验系;3)转化医学研究中心,四川 南充 637007)
结直肠癌(colorectal cancer,CRC)是常见的消化道系统恶性肿瘤,在全球范围内其发病率和病死率位居所有恶性肿瘤的第3 位和第2 位[1],目前其发病率和死亡率均呈上升趋势[2]。CRC 较易发生远处转移,肝脏是其远处转移最主要的靶器官,约15%~25%的CRC 患者在确诊时出现肝转移,既同时性结直肠癌肝转移(synchronous colorectal liver metastasis,synCRLM),约15%~25%的患者在CRC 原发灶根治术后发生肝转移,既异时性结直肠癌肝转移(metachronous colorectal liver metastasis,metCRLM)[3]。结直肠癌肝转移(colorectal liver metastases,CRLM)是CRC 患者最主要的死亡原因,不经任何治疗的肝转移患者中位生存期仅仅约为7 个月,无法手术切除的患者5 a 生存率小于5%[3]。
随着对肿瘤发生发展的分子机制的深入研究,与CRC 发病和治疗相关的基因也越来越多被发现,一些针对特定基因靶点的分子靶向药物不断问世,CRC 治疗也进入了靶向个体化治疗时代。KRAS、NRAS 和BRAF 基因是表皮生长因子受体(epidermal growth factor receptor,EGFR)所介导信号通路下游的重要调控分子,参与调控细胞生长、分化及增殖,其突变状态与CRC 能否从靶向药物抗EGFR 的单克隆抗体获益密切相关。KRAS、NRAS 和BRAF 基因突变后会引起EGFR 依赖的RAS-RAF-MAPK 信号通路持续激活,引起不依赖于表皮生长因子刺激的细胞异常增殖和肿瘤产生,导致抗EGFR 单抗治疗无效[4]。此外,KRAS、NRAS 和BRAF 基因突变状态与CRC 预后密切相关,是CRC 预后不良独立预测指标[5-7]。
目前国内外多项临床指南推荐原发性或转移性CRC 患者均应进行KRAS、NRAS 和BRAF 基因突变检测,对预后进行分层,指导临床用药[3,8-10]。但KRAS、NRAS 和BRAF 基因与CRLM的关系尚不清楚,且鲜有报道,因此本研究旨在分析KRAS、NRAS 和BRAF 基因突变与CRLM的关系,为CRC 患者精准诊治提供理论基础。
1 资料与方法
1.1 病理资料
选取川北医学院附属医院2019 年1 月至2021 年10 月间经手术切除后确诊CRC 的组织标本246 例,进行KRAS、NRAS 和BRAF 基因联合检测,并收集每例患者临床资料包括对应的肝转移情况、肿瘤部位、组织学类型、大体类型、分化程度、肿瘤大小直径、TNM 分期、乙肝感染情况等。其中男148 例,女98 例;年龄22~85 岁,中位年龄57 岁。
1.2 检测方法
采用离心柱法应用FFPE-DNA 样品核酸提取试剂盒(艾德,厦门)提取组织基因组DNA,采用紫外分光光度计检测DNA 的浓度和纯度,并将提取好的DNA 稀释至1 ng/µL 备用。基于ARMS 法和荧光PCR 技术,采用KRAS/NRAS/BRAF 基因突变联合检测试剂盒(艾德,厦门),应用SLAN-96P 全自动荧光定量PCR 仪(宏石,上海)进行KRAS、NRAS 和BRAF 基因突变检测。基因检测位点,见表1。
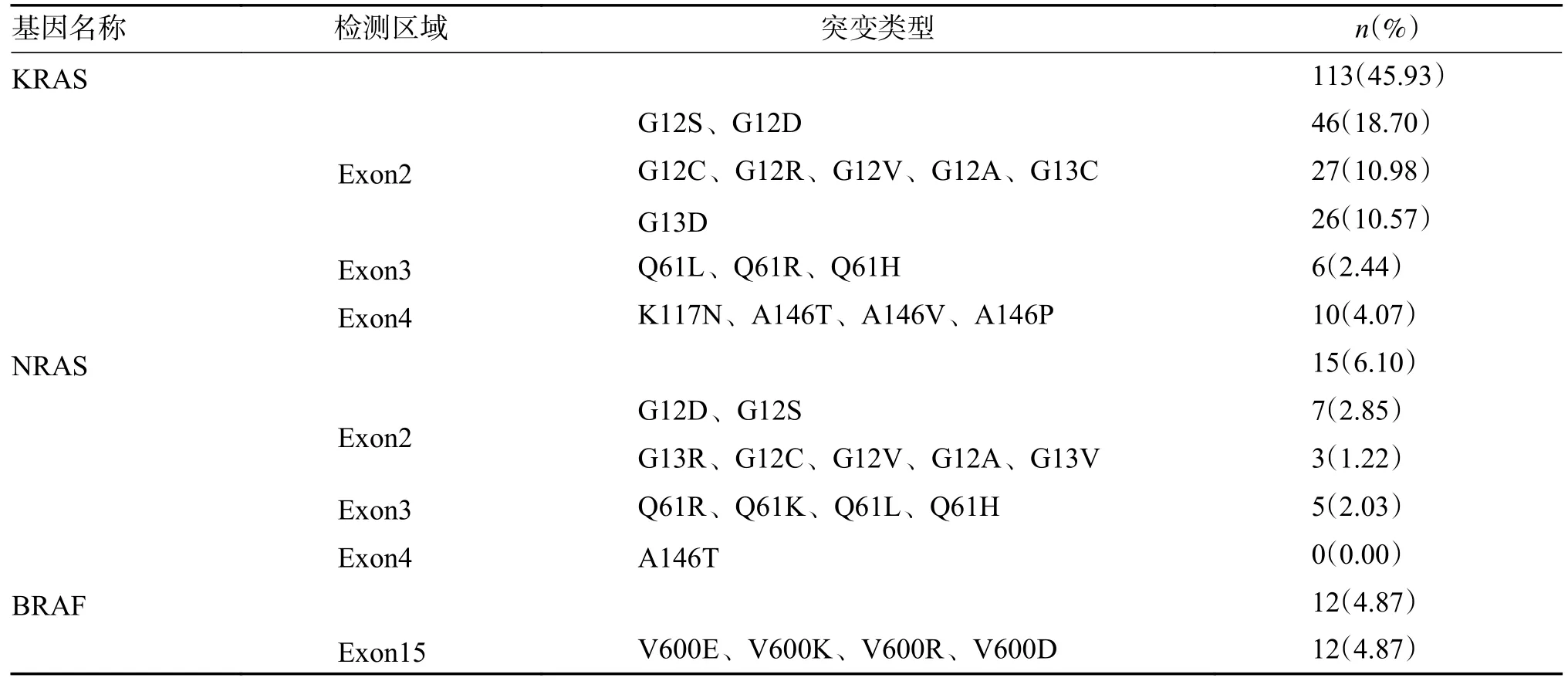
表1 246 例结直肠癌患者 KRAS、NRAS 和BRAF 基因突变分析Tab.1 Analysis of KRAS,NRAS and BRAF gene mutations in 246 CRC patients
1.3 统计学处理
采用SPSS17.0 软件进行统计分析,计数资料以百分率(%)表示,采用χ2检验进行组间数据比较,采用二元Logistic 回归分析与CRLM 有关联的因素,以P< 0.05 为差异有统计学意义。
2 结果
2.1 KRAS、NRAS 和BRAF 基因突变分析
246 例CRC 患者中,KRAS 突变率最高,突变率为45.93%(113/246);其次为NRAS,突变率为6.10%(15/246);BRAF 突变率最低,突变率为4.87%(12/246)。在所有突变类型中,以KRAS 基因G12S、G12D 突变类型最为常见。KRAS 和NRAS 检测区域均包含了2 号外显子、3 号外显子和4 号外显子,其中均以2 号外显子的检出率最高,2 号外显子在KRAS 总突变中占86.72%(98/113),在NRAS 总突变中占66.67%(10/15)。此外,共发现双基因突变3 例,分别为KRAS 和NRAS 共同突变、KRAS 和BRAF 共同突变,以及NRAS 和BRAF 共同突变。有2 例存在KRAS双位点突变,分别为G12C、G12R、G12V、G12A、G13C 突变合并Q61L、Q61R、Q61H 突变,G12S、G12D 突变合并G13D 突变。
2.2 KRAS、NRAS 和BRAF 基因与结直肠癌TNM 分期相关性分析
为了探讨KRAS、NRAS 和BRAF 基因与结直肠癌转移的关系,本研究分析KRAS、NRAS 和BRAF 基因突变状态与结直肠癌初诊时TNM 分期的相关性(表2),结果显示NRAS 基因在Ⅳ期的突变率显著高于Ⅰ~Ⅲ期(P=0.004),且有远处转移患者的突变率显著高于没有远处转移的患者(P=0.001),提示NRAS 突变状态与初诊时结直肠癌远处转移密切相关。未发现KRAS 和BRAF基因与TNM 分期具有相关性(P> 0.05)。

表2 KRAS、NRAS 和BRAF 基因突变与结直肠癌TNM 分期的关系[n(%)]Tab.2 Relationship between TNM staging and KRAS,NRAS and BRAF gene mutations in CRC [n(%)]
2.3 KRAS、NRAS 和BRAF 基因与结直肠癌肝转移相关性分析
本研究246 例CRC 患者中,26.02%(64/246)的CRC 患者在确诊时发生了肝转移,既synCRLM。对研究病例进行随访,分析CRC 患者从确诊到病程至1 a 的肝转移情况,共计200 例CRC 患者获得随访资料,其中1 a 内发生肝转移的比率为46.00%(92/200)。
KRAS、NRAS 和BRAF 基因突变与CRLM 分析结果显示,NRAS 突变与synCRLM 相关,在NRAS 突变组发生synCRLM 频率高于NRAS 野生组(P=0.005),见表3,但随着病程时间延长,1 a 内发生CRLM 在NRAS 突变组和野生组未见明显差异(P=0.155)。KRAS 和BRAF 突变与CRLM无明显相关性(P> 0.05)。

表3 结直肠癌肝转移相关影响因素[n(%)]Tab.3 Related influencing factors of colorectal liver metastases [n(%)]
为了进一步明确CRLM 的影响因素,本研究分析了性别、年龄、CRC 病理特征及乙肝感染状况与CRLM 的相关性,研究结果显示,CRLM 与CRC 大体类型具有相关性,浸润型CRC 患者发生synCRLM 频率高于溃疡型及隆起型患者(P=0.011),但随着病程时间延长,不同大体类型组1a 内发生CRLM 未见明显差异(P> 0.05),见表3。CRLM 与性别、年龄、肿瘤位置、乙肝感染、分化程度、组织学类型及肿瘤直径大小均无明显相关性(P> 0.05)。
将NRAS 突变状态和大体类型纳入二元Logistic 回归模型,结果显示NRAS 突变是synCRLM 的独立危险因素(OR=9.974,95%CI=1.838~54.130,P=0.008);溃疡型(OR=0.253,95%CI=0.085~0.754,P=0.014)和隆起型(OR=0.167,95%CI=0.039~0.709,P=0.015)较浸润型CRC 发生synCRLM 的风险低。
3 讨论
CRC 的发生发展是环境因素及遗传因素等共同作用的多阶段、多步骤的复杂生物学过程,受多种基因突变、基因表达紊乱及表观遗传改变等的影响。KRAS、NRAS 和BRAF 作为EGFR 信号通路的关键调控基因,在CRC 患者的靶向治疗中具有重要的指导作用,并可作为CRC 预后的标志物[5-10]。
本研究结果显示KRAS、NRAS 和BRAF 的突变率分别为45.93%(113/246)、6.10%(15/246)和4.87%(12/246),其突变频率与国内外研究报道相似[11-13],且均以KRAS 基因的突变频率最高。目前一些相关研究认为KRAS/NRAS 与BRAF 突变是互斥的[14],但本研究检出KRAS/BRAF 双突变以及NRAS/BRAF 双突变各1 例,此外,Guo[7]等和白杨等[11]也检出KRAS/BRAF 双突变或NRAS/BRAF 双突变,提示KRAS 及NRAS 与BRAF 突变并非完全互斥,其共同突变可存在于少数病例中。
肝脏是结直肠癌血行转移最主要的靶器官,CRLM 是CRC 预后不良和死亡的主要原因,如何尽早确诊或预测CRLM,仍面临重要挑战,KRAS、NRAS 和BRAF 能否作为CRLM 诊断指标目前鲜有相关研究报道。本研究结果显示NRAS 基因突变与synCRLM 相关,synCRLM 在NRAS 突变组发生频率较高(P=0.005),但随着病程时间延长,1 a 内发生CRLM 在NRAS 突变组和野生组未见明显差异(P=0.155)。二元Logistic 回归模型结果显示NRAS 突变是synCRLM 的独立危险因素,提示NRAS 基因突变患者早期较易出现CRLM。在与CRC 确诊时TNM 分期分析中,NRAS 基因突变与远处转移具有相关性,其突变更易出现在有远处转移或Ⅳ期的CRC 患者,进一步提示NRAS基因可能参与CRC 的早期转移。RAS 基因是机体肿瘤中常发生差异突变的主要驱动致癌基因,其致瘤潜能主要归因于自主促进肿瘤细胞增殖和存活,但最近的证据表明RAS 原癌基因通过向内皮细胞和髓细胞发出的不同趋化因子集信号介导肿瘤转移[15-16]。尤其是NRAS 基因,其突变在高度转移性癌症中较为常见,如原发部位不明的转移性肿瘤和黑色素瘤。Adler 等[17]报道NRAS 突变的皮肤黑色素瘤患者肝转移、中枢神经体统、肺转移的几率增加。Giannou 等[16]研究发现突变或过表达NRAS 通过调节白细胞介素-8 相关趋化因子的表达促进多种肿瘤细胞肺定植,并认为白细胞介素-8 相关趋化因子可能是对抗其他器官癌症肺转移的重要治疗靶点。因此笔者推测,NRAS基因可能通过调节趋化因子的表达促进CRC 的早期肝转移或其他远处转移。
尽管KRAS 与NRAS 同属RAS 基因,但本研究结果显示KRAS 突变与CRLM 无明显相关性(P均 > 0.05)。可能与其在CRC 中涉及的转移机制不同相关。Tie 等[18]研究发现CRC 肝转移率在KRAS 突变型与KRAS 野生型组无显著差别,与本研究相符,但该团队发现KRAS 突变的晚期CRC 患者肺转移率及脑转移率更高。此外,本研究结果显示BRAF 突变与CRLM 不具有相关性;CRC 大体类型与早期CRLM 相关,浸润型CRC患者发生synCRLM 频率相对较高。
综上所述,NRAS 突变与synCRLM 相关,NRAS 突变的CRC 患者早期较易出现CRLM,且NRAS 突变是synCRLM 的独立危险因素。KRAS和BRAF 突变与CRLM 不具有相关性。对NRAS进行检测不仅在靶向治疗中具有重要的指导作用,在早期CRLM 评估中也具有重要的临床指导价值。

