异钩藤碱对抑郁小鼠海马神经细胞凋亡和氧化应激的影响及其作用机制
张 学,黄红英,赵顺程,李 欣
抑郁症是一种常见的情感异常类疾病,以持久的情绪低落为主要特征,严重者可导致自杀[1],并且其患病率逐年增加,严重威胁人类健康和生活质量[2]。药物治疗、物理治疗和心理治疗是目前抑郁症治疗的重要方式,但存在一定的局限性,导致治疗效果欠佳[3]。抑郁症的发病机制十分复杂,与海马神经元异常凋亡、氧化应激和炎症损伤等密切相关[4-7]。异钩藤碱是从传统中药钩藤中提取的一种四环羟吲哚生物碱,具有抗心血管疾病和保护神经系统的作用[8]。近年来,有研究发现,异钩藤碱可通过减轻神经炎症和增加神经营养素发挥抗抑郁作用[9],但其对神经细胞凋亡和氧化应激的影响并不清楚。为此本研究通过观察异钩藤碱对抑郁小鼠海马神经细胞凋亡和氧化应激的影响,并探讨其可能的分子机制,旨在为异钩藤碱抗抑郁的应用提供新的实验依据。
1 材料与方法
1.1 材料 体重20~25 g的24只清洁级SD雄性小鼠,购于哈尔滨医科大学实验动物中心,许可证号:SCXK(黑)2017-007。异钩藤碱(上海源叶生物公司生产,纯度≥98%,批号:B21526),盐酸氟西汀分散片(礼来公司生产,规格:每片20 mg,批号:J20160029),含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)、B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)和β-actin抗体购自Abcam公司,c-Jun氨基末端激酶(JNK)、磷酸化JNK(p-JNK)购自美国Santa Cruz公司,超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所,放射免疫沉淀试验(RIPA)裂解液和二喹啉甲酸(BCA)蛋白定量试剂盒和末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(terminal dexynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 实验分组、抑郁模型制备和给药 将24只小鼠随机分为异钩藤碱组、阳性对照组、模型组和对照组(正常饲养),每组6只;异钩藤碱组、阳性对照组、模型组小鼠采用慢性轻度不可预见性温和应激法[7]制备抑郁小鼠模型,具体刺激方法为每天随机给予一种应激,包括禁食24 h、禁水24 h、昼夜颠倒24 h、鼠笼45 ℃倾斜24 h、夹尾1 min、4 ℃冰水游泳5 min、45 ℃ 热水游泳5 min,持续28 d,并且每3天的应激不重复。造模完成后,异钩藤碱组小鼠给予40 mg/kg异钩藤碱[9]灌胃,阳性对照组小鼠给予20 mg/kg氟西汀灌胃,而模型组和对照组小鼠给予等量生理盐水灌胃,每日1次,连续干预21 d。对照组正常饲养。通过小鼠糖水偏好实验和强迫游泳实验确定建模情况。
1.3 糖水偏好实验 干预结束后,4组大鼠给予1%糖水适应训练:放置2瓶1%糖水在笼子内,24 h后将其中1瓶更换为纯水,继续放置24 h。适应完成后,断水24 h,而后开始实验:放置1瓶1%糖水和1瓶纯水在笼子内,24 h后称取糖水和纯水的消耗量,并计算糖水偏好百分比,糖水偏好百分比=糖水消耗量/(纯水消耗量+糖水消耗量)×100%。
1.4 强迫游泳实验 在实验前1 d,将小鼠放入规格为20 cm×70 cm且盛有25 ℃温水的透明水缸中,使其适应性游泳6 min;次日,将小鼠放入水中,适应2 min后,记录后4 min内小鼠游泳不动时间。
1.5 氧化应激指标检测 上述实验结束后处死小鼠收集海马组织,取30 mg海马组织,加入磷酸缓冲液研磨成浆后,采用BCA法检测匀浆中总蛋白浓度。参照GSH-Px、MDA和SOD试剂盒说明书检测4组小鼠海马中GSH-Px、MDA和SOD水平。
1.6 TUNEL法检测海马神经细胞凋亡 将海马组织以4%多聚甲醛固定2 h后,常规石蜡包埋制成4 μm的石蜡切片,经二甲苯脱蜡和乙醇脱水后,参照TUNEL试剂盒说明书检测4组小鼠海马神经细胞的凋亡情况。
1.7 免疫印迹法检测海马组织中Bcl-2、Bax、Cleaved Caspase-3、JNK和p-JNK蛋白表达 取海马组织30 mg,加入适量RIPA裂解液,冰上裂解,离心抽提总蛋白,采用BCA法对总蛋白定量测定。取50 μg蛋白进行加样,行12%电泳分离蛋白样品。结束后采用半干法电转到硝酸纤维素膜上。封膜2 h,以Bcl-2、Bax、Cleaved Caspase-3、JNK和p-JNK抗体4 ℃下孵育12 h;次日,以辣根过氧化酶标记的二抗室温杂交2 h,显影,曝光,以β-actin标定,获取图像后分析4组小鼠海马组织中Bcl-2、Bax、Cleaved Caspase-3、JNK和p-JNK蛋白的表达水平。

2 结 果
2.1 4组小鼠糖水偏好百分比和强迫游泳不动时间比较 与对照组比较,模型组小鼠糖水偏好百分比明显降低(P<0.05),强迫游泳不动时间明显延长(P<0.05);与模型组比较,异钩藤碱组和阳性对照组小鼠糖水偏好百分比明显升高(P<0.05),而强迫游泳不动时间明显缩短(P<0.05);异钩藤碱组糖水偏好百分比、强迫游泳不动时间与阳性对照组比较差异均无统计学意义(P>0.05)。详见表1。

表1 4组小鼠糖水偏好百分比和强迫游泳不动时间比较(±s)
2.2 4组小鼠海马中SOD、MDA和GSH-Px水平比较 与对照组比较,模型组小鼠海马中SOD和GSH-Px水平明显降低(P<0.05),MDA水平明显升高(P<0.05);与模型组比较,异钩藤碱组和阳性对照组小鼠海马中SOD和GSH-Px水平明显升高(P<0.05),而MDA水平明显降低(P<0.05);与阳性对照组比较,异钩藤碱组小鼠海马中SOD、MDA和GSH-Px水平差异均无统计学意义(P>0.05)。详见表2。

表2 4组小鼠海马中SOD、MDA和GSH-Px水平比较(±s)
2.3 4组小鼠海马神经元细胞凋亡数比较 与对照组比较,模型组小鼠海马神经元细胞凋亡数明显增多(P<0.05);与模型组比较,异钩藤碱组和阳性对照组神经元细胞凋亡数明显减少(P<0.05),与阳性对照组比较,异钩藤碱组神经元细胞凋亡数差异无统计学意义(P>0.05)。详见表3。

表3 4组小鼠海马神经元细胞凋亡数比较(±s)
2.4 4组小鼠海马中Bcl-2、Bax和Cleaved Caspase-3蛋白表达水平比较 模型组与对照组比较,模型组小鼠海马组织中Cleaved Caspase-3和Bax 蛋白表达水平明显升高(P<0.05),Bcl-2表达水平明显降低(P<0.05);与模型组比较,异钩藤碱组和阳性对照组Bax和Cleaved Caspase-3的表达明显降低(P<0.05),而Bcl-2的表达水平明显升高(P<0.05);与阳性对照组比较,异钩藤碱组中Bax、Bcl-2和Cleaved Caspase-3的表达水平差异均无统计学意义(P>0.05)。详见图1、表4。
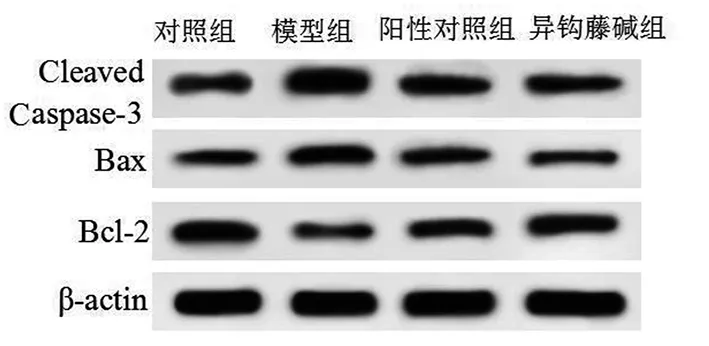
图1 免疫印迹法检测海马中Bcl-2、Bax和Cleaved Caspase-3蛋白的表达

表4 4组小鼠海马中Bcl-2、Bax和Cleaved Caspase-3蛋白表达水平比较(±s)
2.5 4组小鼠海马中JNK和p-JNK蛋白表达水平比较 对照组、模型组、阳性对照组和异钩藤碱组海马组织中JNK蛋白表达水平比较差异均无统计学意义(P>0.05);与对照组比较,模型组中p-JNK表达水平明显升高(P<0.05),阳性对照组和异钩藤碱组p-JNK蛋白表达水平明显低于模型组(P<0.05),阳性对照组p-JNK蛋白表达水平与异钩藤碱组比较差异无统计学意义(P>0.05)。详见图2、表5。

图2 免疫印迹法检测海马中JNK和p-JNK蛋白的表达

表5 4组小鼠海马中JNK和p-JNK蛋白表达水平比较(±s)
3 讨 论
慢性轻度不可预见性温和应激法是构建抑郁模型的常用方法[10-12],本研究采用该法建模后发现,模型组小鼠糖水偏好百分比明显降低,然而强迫游泳不动时间明显延长;实验结果表明小鼠出现了明显的抑郁行为,抑郁模型构建成功。在建模基础上,给予异钩藤碱治疗后,小鼠的抑郁行为明显得到改善。这与Xian等[13]研究所得出的异钩藤碱具有抗抑郁的实验结果相吻合。本研究进一步证实了异钩藤碱的抗抑郁作用。
氧化应激与抑郁症的发生密切相关,其可引起神经细胞损伤,影响神经递质5-羟色胺的表达,造成抑郁行为的产生[7]。MDA是一种脂质过氧化产物,其水平可反映脂质过氧化损伤的程度;SOD和GSH-Px是重要的抗氧化酶,能够有效清除机体自由基[14-15]。有研究报道,异钩藤碱可通过调控细胞外信号调节激酶(extracellular signal reguluated kinase,ERK)1/2和糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)途径抑制1-甲基-4-苯基吡啶诱导的SH-SY5Y细胞氧化应激损伤而发挥神经保护作用[16]。本研究发现,模型组小鼠海马中SOD和GSH-Px水平明显降低,而MDA水平明显升高;给予异钩藤碱后SOD和GSH-Px水平明显升高,而MDA水平明显降低。这表明异钩藤碱可抑制抑郁小鼠海马神经细胞的氧化应激反应。提示异钩藤碱抗抑郁作用可能与其抑制海马神经细胞的氧化应激有关。
海马是中枢神经系统中的重要组织,在情感、记忆和内分泌整合等过程中起着重要作用;海马神经元丢失可引起海马脑区萎缩,进而影响神经可塑性,导致抑郁发生[17]。神经细胞凋亡是导致神经元丢失的重要方式之一,因此,减少海马神经细胞的过度凋亡对改善抑郁具有重要意义。Bcl-2和Bax是Bcl-2基因家族成员,前者是凋亡抑制基因,后者为促凋亡基因,两者均在细胞凋亡过程中发挥着重要作用;Caspase-3是重要的凋亡执行因子,Caspase-3切割(cleaved)活化后,在细胞凋亡中起着不可替代的作用[18-19]。有研究指出,在阿尔茨海默病中,异钩藤碱不仅可通过减少MDA水平和增加SOD、GSH-Px水平发挥抗神经PC12细胞氧化应激反应外,还可通过增强Bcl-2表达和抑制Bax、Caspase-3表达发挥抑制神经PC12细胞凋亡的作用[20]。本研究发现,抑郁模型小鼠海马神经元细胞凋亡增多,且海马组织中Bcl-2蛋白表达减少,而Cleaved Caspase-3和Bax蛋白表达明显增多;给予异钩藤碱治疗后,神经元细胞凋亡明显减少;同时,Cleaved Caspase-3和Bax蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高。结果表明,异钩藤碱可通过调控Bcl-2、Bax和Cleaved Caspase-3表达发挥抑制神经元细胞凋亡的作用。提示异钩藤抗抑郁作用可能与其抑制海马神经元细胞凋亡有关。
JNK是丝裂原激活的蛋白激酶家族成员,有研究显示,JNK信号转导通路参与多种疾病(包括抑郁症)的发生和进展[21-22]。有研究表明,在抑郁症中,JNK信号通路异常激活不仅通过调控Bcl-2和Bax等表达促进神经细胞凋亡;还能够促进活性氧以及与氧化应激反应密切相关的环氧化酶-2和诱导型一氧化氮合酶的产生,加重氧化应激损伤;干预JNK信号通路被认为是抑郁症研究和治疗的新靶标[23]。有研究显示,异钩藤碱可通过抑制JNK通路减弱1-甲基-4-苯基吡啶诱导神经PC12细胞凋亡和氧化应激而发挥帕金森病神经保护作用[24]。本研究在抑郁小鼠模型中发现p-JNK蛋白表达水平明显升高,JNK信号通路异常激活;给予异钩藤碱治疗后p-JNK蛋白表达水平降低,JNK信号通路的活化明显受到抑制。表明异钩藤碱具有抑制JNK信号通路活化的作用,提示异钩藤碱可能通过抑制JNK信号通路活化抑制海马神经细胞凋亡和氧化应激损伤而发挥抗抑郁作用。
综上所述,异钩藤碱可通过抑制神经细胞凋亡和氧化应激改善抑郁小鼠的抑郁行为,其作用机制可能与抑制JNK信号通路活化有关。该结果进一步揭示了异钩藤碱抗抑郁的分子机制,为异钩藤碱成为临床抗抑郁药物提供了新的参考依据。

