血管紧张素Ⅱ与老年动脉粥样硬化关系的研究进展
王 洵,梁 斌
动脉粥样硬化(atherosclerosis,AS)是目前全球发病率最高的疾病,随着人口老龄化,与年龄相关的AS成为目前临床上老年心血管疾病的重要发病基础[1]。研究表明,在老年AS疾病中会出现大量衰老的血管平滑肌细胞(vascular smooth muscle cell,VSMC),致使斑块不稳定,从而促进AS的进展与急性冠脉综合征的发生[2-5]。因此,对于老年AS的研究在基础方面则转化为细胞衰老对于AS的作用。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)作为肾素-血管紧张素系统(renin-angiotensin-aldosteronesystem,RAAS)重要组成成分,在细胞衰老对于AS致病过程中发挥了不可或缺的作用,其主要通过作用于AT1受体促进VSMC衰老,进一步促进AS的形成[6-9]。AngⅡ可以修饰许多影响衰老VSMC迁移的因素,如单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)、钙蛋白酶1等[8]。此外,AngⅡ与衰老VSMC中的炎症密切相关,是核因子-κB(nuclear factor-kappa B,NF-κB)、转化生长因子-β(transforming growth factor-β,TGF-β)、线粒体膜电位(MMP)系统和活性氧(reactive oxygen species,ROS)产生的有效激活剂或促进剂。随着年龄的增长,循环中AngⅡ的水平逐渐增加。因此,AngⅡ是导致动脉炎症和细胞衰老的关键性因子,同时也是AS的关键因子[9-11]。然而,目前关于老年AS细胞方面的研究大多集中于表型及功能的改变,分子生物代谢方面的研究相对较少,这对于老年人AS的诊治,尤其是特殊用药,具有重要指导价值。现综述AngⅡ在老年AS中的病理生理过程。
1 AngⅡ在晚期糖基化终末产物(advanced glycation end products,AGEs)致AS中的作用
AGEs是过量的糖和蛋白质结合的产物,在体内有两个来源,一是过量的糖和蛋白质在体内合成AGEs,二是通过进食将食物中存在的AGEs摄入体内。AGEs 能够和身体的组织细胞相结合并对其产生破坏,包括细胞衰老,这也得到了一定的证据支持[12]。Gomes[13]研究表明,在衰老细胞内,AGEs/晚期糖基化终末产物受体(RAGE)/甲基赖氨酸(CML)/还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶系统诱导动脉壁内皮细胞的损伤,而脂质浸润会加速这一过程的进展。进一步研究表明,RAGE敲除或免疫阻断的RAGE下调可减少AngⅡ的生成,介导血管内皮细胞损伤,促进AS的形成。甲基赖氨酸这一过程中表现为优先摄取AGEs,诱导细胞内氧化应激和内质网应激,阻碍胆固醇逆转运,从而加速了细胞的脂质浸润[14]。这一途径也通过动物实验证明。该项实验在小鼠主动脉移植模型中测试了AS消退受损的机制,发现在低密度脂蛋白受体(LDLR)缺失型AS小鼠模型中,RAGE的缺失加速了AS的消退,并明显减少了病变,进一步证实了AGEs的致AS作用[15]。另有研究结果表明,AGEs可明显增加M1型巨噬细胞RAGE表达并激活NF-κB途径,促进甲基赖氨酸白细胞介素(IL)-6和肿瘤坏死因子-α(TNF-α)等炎性因子的表达,导致动脉炎症产生,NF-κB途径恰巧也是AngⅡ致炎作用的关键启动分子[16],表明AngⅡ在AGEs致老年AS中发挥了重要作用。
总之,AGEs对血管的损伤作用可以部分解释糖尿病导致AS的机制。从Gomes[13]的研究可以看出老年糖尿病病人罹患AS的风险相应增高,不仅来自于AGEs自身的损伤,而且也与其引起的脂质代谢紊乱有关,强调了冠心病一级、二级预防中血糖管理的重要性,同时也为老年糖尿病病人AS不良事件的研究提供了一个很好的结局指标。AGEs作用通路详见图1。
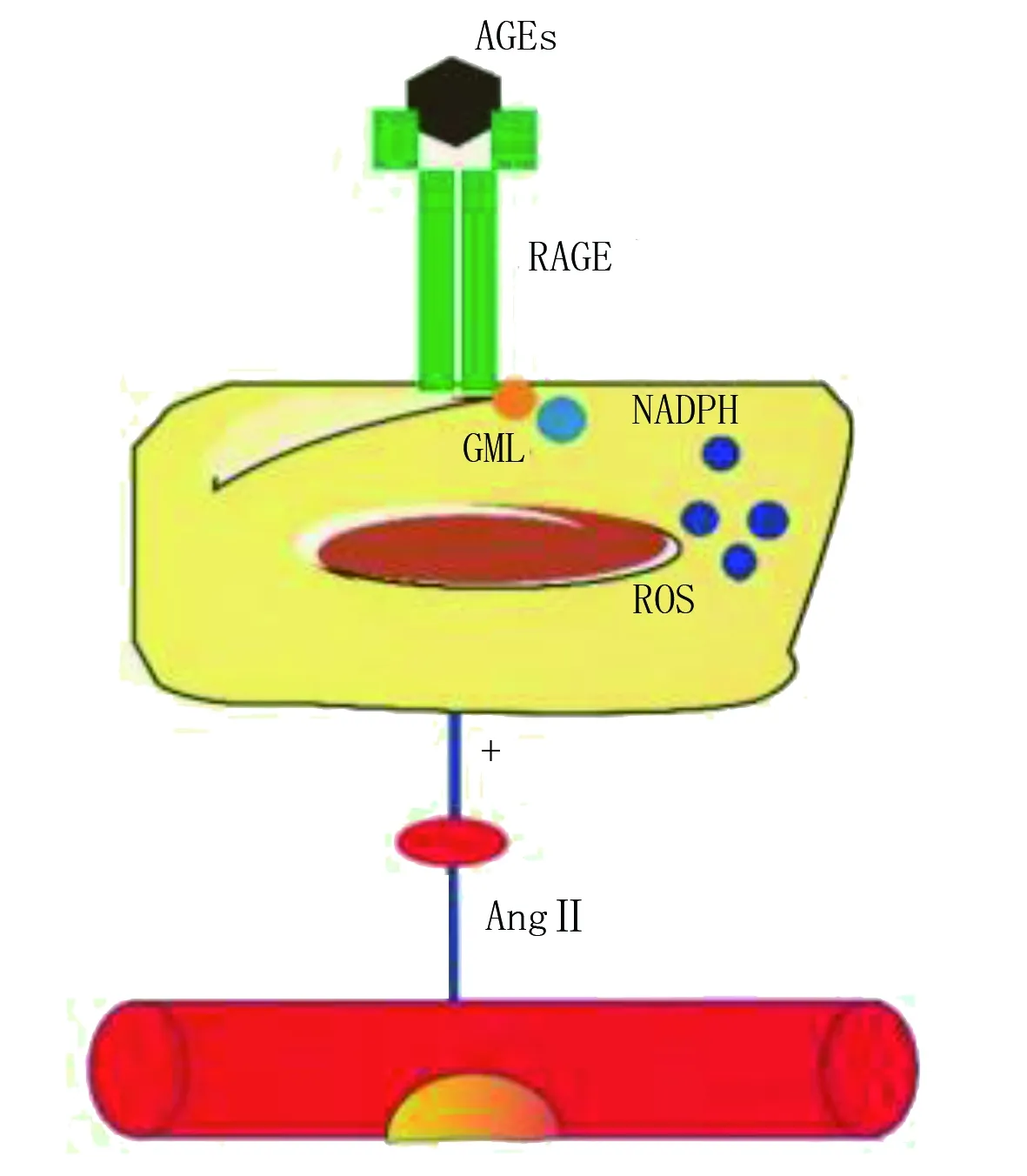
图1 AGEs作用通路[13]
2 AngⅡ在端粒酶致AS中的作用
端粒酶是细胞中负责端粒延长的一种酶,是基本的核蛋白逆转录酶,可将端粒DNA加至真核细胞染色体末端,从而把DNA复制损失的端粒填补起来,让端粒不会因细胞分裂而有所损耗。因此,端粒在不同物种细胞中对于保持染色体稳定性和细胞活性起着至关重要的作用。然而,Salpea等[17]却报道,AS中VSMC的端粒长度比正常人短。有研究发现,在对细胞进行AngⅡ长期刺激(30 d)后,可明显促进p16、p21等衰老相关基因的表达,减慢细胞的生长,同时降低衰老细胞中寿命相关基因的表达,端粒酶逆转录酶cDNA和端粒酶活性,但对细胞周期的影响尚不清楚[18]。另有研究表明,AngⅡ可以诱导SA-β-Gal阳性细胞、p21和纤溶酶原激活物抑制剂-1(PAI-1)表达上调。然而,AngⅡ1型受体相关蛋白内源性配体(Apelin)/AngⅡ1型受体相关蛋白轴通过腺苷酸活化蛋白激酶(AMPK)/沉默信息调节器1(Sirt1)信号通路改善AngⅡ诱导的人脐静脉内皮细胞中ROS的生成,增强端粒酶活性,从而改善内皮细胞衰老,增强内皮细胞的活性[19]。
虽然国内外已经有许多研究,但是端粒酶和端粒长度在AS形成中的潜在致病作用仍然存在争议,目前已有研究表明,AGEs可以影响端粒的长短,而二甲双胍可以保护端粒免受其损伤作用,但目前的研究价值有限,而且对于AngⅡ参与的端粒酶的缩短与活性下降也未做进一步的探讨。因此,对于端粒酶和AS的研究有可能成为未来的一个研究方向。
3 AngⅡ在核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体致AS中的作用
低度炎症存在于AS发展的所有阶段,全身炎症会增加炎性因子的水平,损害血管内皮细胞功能,引起动脉过早僵硬,加速AS和血栓形成,增加心血管疾病的风险、死亡率和发病率[20-22]。NLRP3炎性小体是参与低度固有免疫的关键分子,其可通过裂解半胱氨酸天冬氨酸蛋白酶-1(lytic cysteine aspartate protease-1,Caspase-1)将IL-1β和IL-18转化为成熟形式并引起内皮细胞炎症反应,促进AS的发展。如在人脐静脉内皮细胞(HUVEC)中添加丙烯醛可引起NLRP3炎症体激活,表现为Caspase-1及其下游成熟1L-1β和IL-18的分泌,导致AS的发展。使用小干扰RNA下调NLRP3基因表达可明显抑制丙烯醛诱导的细胞凋亡和促进细胞迁移。此外,自噬也参与了这一过程,自噬抑制剂3-甲基腺嘌呤(3-MA)加重了NLRP3炎症体的激活、凋亡和细胞迁移,自噬诱导剂雷帕霉素(RapA)减轻了上述现象[23]。研究发现,在体内,NLRP3抑制剂MCC950治疗减少了脂多糖诱导的IL-1β的分泌,而不影响TNF-α的反应。在体外,MCC950治疗可明显减少AS病变斑块中巨噬细胞的数量,但胶原含量和坏死核大小没有受到影响,这对研究斑块稳定性极其重要。此外,MCC950处理载脂蛋白E基因敲除(ApoE-/-)小鼠颈动脉血管细胞黏附分子1(VCAM-1)和细胞间黏附分子1(ICAM-1)mRNA表达明显降低[24]。证明NLRP3炎症小体有明显的致AS作用。另有研究发现,在博来霉素诱导的内皮细胞衰老中,NLRP3结合硫氧还蛋白结合蛋白(TXNIP),激活衰老内皮细胞NLRP3炎性小体,同时促进NLRP3炎症体相关基因凋亡相关的斑点样蛋白(ASC)、硫氧还蛋白互作蛋白(TXNIP)、Caspase-1和IL-1β在体内的表达,导致动脉衰老内皮细胞的炎症反应[25]。
AngⅡ在NLRP3炎症小体致细胞衰老并进一步导致AS的过程中发挥了重要的作用。研究表明,在最佳浓度(10-9mol/L)AngⅡ作用人脐静脉内皮细胞12 h后,人脐静脉内皮细胞中还原型辅酶Ⅱ(NADPH )氧化酶 4 (NOX4)、NLRP3、Caspase-1和IL-1β的蛋白水平明显升高。AngⅡ可能通过激活NLRP3炎性小体,增加IL-1β的蛋白表达,从而诱导血管炎症,促进AS进程[26]。另有证据表明,在老化血管中,AngⅡ可以诱导NLRP3上游信号分子NF-κB活化,导致单核细胞表达IL-6、单核细胞趋化蛋白-1和TNF-α的表达增加[22]。并且AngⅡ带来的这种炎症信号随年龄增长而增加,将使老年人AS的风险比年轻人高出很多。此外,老年人体内长期的慢性炎症,往往导致体内高凝状态,使老年人血栓的发生率明显高于年轻人,从而老年病人急性心肌梗死的发生率也较年轻病人明显升高,而且伴随着血管功能的紊乱,隐匿性心肌梗死的发病率明显提高,值得临床医师的广泛关注。
近年来,NLRP3炎症小体成为AS领域研究的一个热点话题,特别是对于NLRP3炎症小体相关的细胞焦亡的研究,但其在老年病人当中的具体机制尚不清楚,为未来NLRP3炎症小体的进一步研究提供了重要的科研价值。
4 AngⅡ在ROS自由基致AS中的作用
ROS可以诱导细胞发生氧化应激,其与体内抗氧化物质一直处于一种动态平衡之中,当细胞内ROS水平超过了抗氧化能力时,即可导致细胞因氧化应激而发生损伤,最终可能导致器官功能障碍。
研究表明,巨噬细胞氧化型低密度脂蛋白(oxLDL)暴露后可以上调小凹蛋白-1的表达,而后者反过来上调NOX2p47phox的水平,增加ROS的产生,这种联合作用会导致细胞衰老加剧,并可能为AS的临床干预提供一个靶点[27]。同时,研究表明,氧化型低密度脂蛋白引起的ROS使衰老的人主动脉内皮细胞中活性凋亡信号调节激酶1升高,诱导细胞凋亡,从而进一步介导AS内皮功能障碍[28]。AngⅡ在衰老细胞内ROS的致病过程中发挥了关键的作用。一方面,在线粒体内,AngⅡ增加了胞质锌水平,导致线粒体锌积累,从而致使线粒体功能障碍和线粒体ROS产生。ROS的产生可以进一步介导NF-κB激活和NADPH 氧化酶 1(NOX1)表达,NOX4上调和氧化应激的发生,最终诱导VSMC的衰老[29]。在此过程中,醛固酮通过盐皮质激素受体与AT1受体偶联诱导NF-κB途径的激活,进一步激活氧化应激,为上述过程起到了协同作用[30]。另一方面,RAAS的激活减少了天然抗氧化剂超氧化物歧化酶(SOD)、谷胱甘肽的产生,并降低其活性,使得ROS的对抗物质减少,体内氧化与抗氧化平衡被打破,进一步加重了细胞的衰老,细胞衰老可以促进AS的进展。因此,ROS产生的抑制成为老年人AS治疗的关键靶点。
此外,ROS导致的氧化应激在细胞衰老引起的AS中可以与细胞炎症相偶联,两者相辅相成,涉及两者的研究也相对多,揭示了其在细胞衰老中的关键作用。ROS与许多信号通路的关系尚存在一定的争议,值得深入研究。
5 AngⅡ在Klotho致AS中的作用
Klotho蛋白是内分泌成纤维细胞生长因子受体复合物的重要组成部分,在内分泌系统的构成中发挥了不可或缺的作用,可控制哺乳动物的多个代谢过程[31]。研究表明,Klotho蛋白似乎通过抑制生长因子信号转导和氧化应激而发挥抗衰老作用。既往研究表明,Wnt信号通路在细胞增殖、分化和衰老中发挥重要的作用[32]。Klotho蛋白可能通过配体作用与Wnt受体相结合从而抑制Wnt信号通路的持续激活,进而对抗细胞凋亡和衰老[33]。也有研究发现,Klotho蛋白敲除小鼠胰岛素抵抗明显增强,推测Klotho蛋白亦可能通过干扰胰岛素/胰岛素样生长因子1通路影响衰老进程和个体寿命[34]。Klotho蛋白还可直接调节内皮细胞P53/P21信号通路,下调P53、P16及其他细胞周期相关蛋白的表达,抑制衰老相关β-半乳糖苷酶的生成,进而影响细胞增殖和衰老表型[35]。以上实验证实了Klotho蛋白蛋白的抗衰老作用,并且有确切证据表明,在细胞内的水平随着年龄增加而降低,从40~70岁,其体内循环水平可降低2倍[36]。其中,转录因子-e2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)为Klotho蛋白的下游分子,Klotho蛋白可以激活VSMC中的Nrf2的表达,增加细胞内抗氧化蛋白谷氨酸半胱氨酸连接酶催化亚基(GCLC)、磷酸酰胺腺嘌呤二核苷酸醌氧化还原酶-1(NQO-1)、血红素加氧酶1(HO-1)的表达,清除细胞内生成的氧自由基,从而有助于防止氧化应激造成的血管平滑肌损伤[37-38]。在AS疾病动物模型中,把Klotho基因用腺病毒转染到小鼠体内可改善内皮细胞功能,增加一氧化氮(NO)合成,还可减轻血管周围组织纤维化,逆转血管重构,降低血压,减轻AS[39]。最新研究也表明,血清Klotho蛋白与AS病人糖脂代谢紊乱相关,低水平Klotho蛋白可能是代谢综合征的独立危险因素[40]。缺乏Klotho蛋白则加剧了血管衰老进而促进AS。以上几项试验研究均证实了Klotho蛋白对于AS的削弱作用。
然而,AngⅡ会使得Klotho蛋白的保护作用进行性削弱,对于激活VSMC中的Nrf2的表达这一进程进行阻碍。AngⅡ明显降低Nrf2的表达,减弱Nrf2向细胞核的转运,从而减少细胞的抗氧化蛋白GCLC、NQO-1、HO-1的生成,使血管壁更容易受到炎性因子的损伤。AngⅡ减弱血管细胞的抗氧化活性,无疑加速了AS的进展。目前研究证明,血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂可增加Klotho蛋白的表达,且Yoon 等[40]直接在损伤的肾脏模型中证明了体内Klotho蛋白水平与RAAS系统表达的相关性,但这种关系与AS的关系尚不清楚。
总之,对于Klotho蛋白及其下游分子Nrf2的研究对于氧化应激以及人类寿命的研究是近年来的热点话题,也展现出了相当多的成果,证实了Klotho蛋白在对抗细胞衰老当中的作用。因此,它在AS中的研究也受到了广泛的关注,但是目前的研究仅局限于氧化应激方面,对于代谢方面的研究尚不明确,且在实验设计方面缺乏全面而系统的研究,且目前仅局限于基础,对于临床应用尚有一定的道路,这为接下来的一些新型药物的机制研究提供了一定的参考价值。Klotho蛋白作用通路机制详见图2。
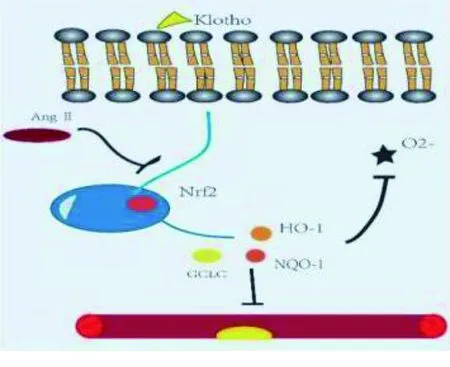
图2 Klotho蛋白作用通路机制[37]
6 小 结
AS是心血管疾病重要的病理生理基础,虽然目前关于AS机制的研究相对成熟,但是对于老年人AS的发生机制存在一定争议,AngⅡ是否参与了老年人AS过程亦不清楚。目前研究表明,AGEs增加、端粒酶活性降低、盐敏感性增强、NLRP3炎症小体、ROS的激活及Klotho蛋白的缺失或表达下降对于衰老细胞AS的形成与发展具有明显影响。这些分子之间互相影响又彼此独立,共同促进AS的发生与发展,同时也促进细胞的进一步衰老,细胞的衰老又进一步促进AS的形成与发展。因此,衰老的细胞对于AS的敏感度明显高于正常细胞。这可能部分解释了老年病人相对于年轻病人AS的高发病率、住院率、死亡率及不典型性,提示了老年病人AS诊治及研究过程也相对困难。老年AS病人的管理是一个综合诊治的过程,AngⅡ广泛参与了老年AS病人的病理生理过程,因此,抑制AngⅡ成为AS病人管理的重要方案,同时,也需要进一步完善其病理生理机制的研究。

