LncRNA H19通过PI3K/Akt通路对海人酸致癫痫大鼠海马神经细胞自噬的影响
李华晓,麦浩坚,宋同均,王士强,黎志迪,陈小凤
癫痫是由大脑某特定区域神经元过度放电引发的一种常见慢性神经系统疾病,其典型临床特征是反复的局部或全身性肌肉痉挛、抽搐和意识障碍,影响着全球数千万人的健康和生活质量[1-2]。尽管已有大量关于癫痫发生机制的研究,但其详细发生机制至今仍未阐明。自噬作为一种高度保守的降解过程已被发现与癫痫的发生密切相关,高度自噬是大脑神经元死亡的一大诱因,而神经元死亡是造成癫痫发生的一个重要因素[3]。因此,抑制神经元过度自噬可能对癫痫的治疗具有重要意义,有必要对癫痫过程中自噬的发生及抑制机制进行探究。长链非编码RNA(long non-coding RNAs,LncRNA)作为一种长度大于200 nt的非编码核糖核苷酸,可参与调控基因表达,近年来有研究发现其参与癫痫、脑梗死等神经系统疾病的发生[4]。LncRNA H19是最早发现的LncRNA之一,在癫痫中明显上调,并且参与细胞增殖、炎症反应等癫痫发生的多个方面[5-6]。研究表明,H19过表达会加剧颞叶癫痫模型大鼠海马神经元凋亡,而抑制其表达可保护细胞损伤[7]。磷脂酰肌醇3-激酶/丝氨酸/苏氨酸蛋白激酶B(phosphoinositide 3-kinase/serine/threonine protein kinase B,PI3K/Akt)通路参与癫痫的发生,其激活不仅有助于成人中枢神经元的再生[8],还可以抑制星形胶质细胞自噬,从而改善癫痫[9]。还有研究发现,在缺血再灌注小鼠脑组织中LncRNA H19表达上调,其可通过抑制PI3K/Akt通路增加脑损伤[10]。本研究探讨LncRNA H19是否可同样通过调控PI3K/Akt通路影响癫痫大鼠海马神经细胞自噬,以期对癫痫的自噬及治疗机制研究提供参考。
1 材料与方法
1.1 实验动物 50只无特定病原体(SPF)级SD大鼠(体质量235~280 g),购自中山大学(实验动物中心东校区),许可证:SCXK(粤)2016-0029,适应性饲养1周(12 h明暗交替),适应期内采食、饮水自由,试验前禁食12 h。
1.2 主要试剂 苏木精-伊红(HE)染色试剂盒、反转录试剂盒(货号:AR1180-100、RP1105)购自上海恒斐生物科技有限公司;实时荧光定量聚合酶链式反应(qRT-PCR)试剂盒(货号:QPG-050~QPG-052)购自上海吉玛制药技术有限公司;总蛋白提取试剂盒(货号:SD-001/SN-002)购自英文特生物技术(北京)有限公司;二喹啉甲酸(BCA)蛋白检测试剂盒(货号:CD-10793-ML)购自武汉纯度生物科技有限公司;Goat Anti-Rabbit IgG H&L辣根过氧化物酶(HRP)抗体、兔抗Beclin-1抗体(货号:ab6721、ab62557、ab51520)购自Abcam;兔抗微管相关蛋白轻链3(LC3)、甘油醛-3-磷酸脱氢酶(GAPDH)、磷酸化PI3K(p-PI3K)、PI3K、Akt、磷酸化Akt(p-Akt)抗体(货号:4108、2118、4228、4257、9272、9271)购自Cell Signaling Technology。
AlphaImager HP凝胶成像系统购自美国ProteinSimple公司;7500/7500 Fast Real-time Quantitative PCR购自AppliedBiosystems/赛默飞。
1.3 方法
1.3.1 分组与癫痫模型构建 将50只SD大鼠随机分为对照组、模型组、NC组(空载体)、LncRNA H19-shRNA组、LncRNA H19-shRNA+LY294002组(10 μL、1 μg/μL PI3K特异性抑制剂LY294002)[11],每组10只。癫痫模型大鼠构建:大鼠于颈内皮下注射10 mg/kg海人酸,若大鼠连续3次出现Ⅳ级及以上癫痫行为则表明造模成功[12],对照组注射等量生理盐水。Racine分级标准:0级为未出现抽搐发作现象;Ⅰ级为出现面部痉挛(包括咀嚼、立须、眨眼);Ⅱ级为出现以点头运动为主的头颈部痉挛;Ⅲ级为出现一侧前肢抽搐;Ⅳ级为出现身体直立伴两前肢抽搐;Ⅴ级为出现身体跌倒,四肢抽搐。造模成功后进行戊巴比妥钠腹腔注射麻醉,消毒后于脑部做正中矢状切口,于颅骨中线两侧开适当大小骨窗,取微量注射器吸取5 μL LncRNA H19-shRNA及空载体、10 μL LY294002对各组大鼠海马CA1区进行相应注射(1 μL/min),注射结束后留针5 min,骨蜡封口、缝合伤口,观察大鼠行为学变化,1周后颈椎脱臼处死大鼠进行后续实验。
1.3.2 脑电图观察大鼠脑电波 实验结束后,将大鼠全部麻醉后固定于脑立体定位仪上以顶部为中心,于中线两侧旁开2.0 mm,前囟前2.0 mm,前囟后3.8 mm植入皮下针型电极,缝合固定电极后记录1 h内脑电图(耳为参考电极),设置灵敏度500 μV,滤波2 Hz,纸速1.25 mm/s,时间常数0.2。
1.3.3 qRT-PCR检测大鼠海马组织中LncRNA H19表达水平 将5只大鼠的海马组织于研钵中研磨后,一部分使用Trizol法提取组织总RNA,检测浓度及纯度后以其为模板进行反转录,根据qRT-PCR试剂盒以cDNA为模板进行扩增,GAPDH为内参,经2-△△Ct分析LncRNA H19表达水平,另一部分用于蛋白免疫印迹法(Western Blot)检测脑组织蛋白表达情况。引物名称及序列见表1。

表1 引物名称及序列(5′-3′)
1.3.4 Western Blot检测大鼠海马组织Beclin-1、LC3及通路相关蛋白表达情况 将脑组织裂解后提取总蛋白,BCA试剂盒检测蛋白浓度后取上样缓冲液,将其与蛋白均匀混合进行100 ℃变性5 min后进行十二烷基硫酸钠(SDS)-聚丙烯酰胺(PAGE)凝胶电泳(每孔40 μg),蛋白分离后进行低温转膜、脱脂奶粉封闭(5%),按1∶1 000添加兔抗Beclin-1、LC3、GAPDH、p-PI3K、PI3K、Akt、p-Akt一抗孵育过夜(4 ℃),磷酸缓冲盐溶液(PBS)清洗后再加入HRP标记的免疫球蛋白G(IgG)二抗(1∶3 000)孵育2 h,增强型化学发光试剂(ECL)化学发光试剂显色,蛋白凝胶成像仪扫描观察,Quantity One(version 4.6)软件分析图像,对Beclin-1、LC3、p-PI3K、PI3K、Akt、p-Akt蛋白含量进行分析(n=5)。
1.3.5 HE及Nissl染色观察大鼠海马神经元损伤情况 另取5只大鼠的海马组织于4%多聚甲醛固定后(24 h)经脱水、浸蜡包埋进行连续冠状切片(3 μm),浸入二甲苯脱蜡、乙醇处理水化后,分别行HE染色与Nissl染色,然后脱水、封片、显微镜观察(n=5),随机选取Nissl染色切片上CA1区5个视野进行神经元计数(n=5)。
1.3.6 透射电镜观察海马神经元自噬情况 取大鼠海马组织于戊二醛中固定12 h后进行锇酸固定,丙酮脱水、包埋、切片(50 nm)、枸橼酸铅染色后使用透射电镜观察自噬情况。
1.3.7 免疫组化法检测大鼠海马组织Beclin-1、LC3Ⅱ蛋白表达情况 取石蜡切片经脱蜡、水化后添加H2O2孵育20 min清除内源性过氧化物酶,高压修复抗原后添加Beclin-1、LC3Ⅱ一抗(1∶200)孵育过夜,加入生物素标记的羊抗兔IgG抗体60 min后进行PBS清洗、免疫组化(SP)法染色后,脱水、干燥、封片观察到棕黄色为阳性染色。

2 结 果
2.1 大鼠脑电图及行为学观察 对照组大鼠脑电图波形正常、无癫痫发作;与对照组比较,模型组及NC组大鼠脑电图出现高幅高频波形,癫痫发作Ⅳ级以上;NC组大鼠脑电图波形及癫痫发作程度与模型组比较无明显差异;与模型组及NC组比较,LncRNA H19-shRNA组大鼠脑电图波形呈低频率及低幅波形,癫痫发作明显减轻;与LncRNA H19-shRNA组比较LncRNA H19-shRNA+LY294002组大鼠脑电图波形频率增加,癫痫发作明显加重。详见图1。

图1 各组大鼠脑电图(A为对照组;B为模型组;C为NC组;D为LncRNA H19-shRNA组;E为LncRNA H19-shRNA+LY294002组)
2.2 各组大鼠海马组织LncRNA H19表达水平比较 与对照组比较,模型组大鼠海马组织LncRNA H19表达水平明显增加(P<0.05);NC组大鼠海马组织LncRNA H19表达水平与模型组比较差异无统计学意义(P>0.05),LncRNA H19-shRNA组大鼠海马组织LncRNA H19表达水平明显低于模型组、NC组(P<0.05)。详见表2。

表2 各组大鼠海马组织LncRNA H19表达水平比较(±s)
2.3 各组大鼠海马组织中Beclin-1、LC3蛋白表达比较 与对照组比较,模型组大鼠海马组织中Beclin-1、LC3Ⅱ/LC3Ⅰ表达水平明显增加(P<0.05);与模型组比较,NC组Beclin-1、LC3Ⅱ/LC3Ⅰ表达水平差异无统计学意义(P>0.05);与对照组、模型组比较,LncRNA H19-shRNA组Beclin-1、LC3Ⅱ/LC3Ⅰ表达水平明显降低(P<0.05);与LncRNA H19-shRNA组比较,LncRNA H19-shRNA+LY294002组Beclin-1、LC3Ⅱ/LC3Ⅰ表达水平明显增加(P<0.05)。详见表3、图2。

表3 各组大鼠海马组织中Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达比较(±s)

图2 各组大鼠海马组织中Beclin-1、LC3Ⅱ/LC3Ⅰ蛋白表达条带图(A为对照组;B为模型组;C为NC组;D为LncRNA H19-shRNA组;E为LncRNA H19-shRNA+LY294002组)
2.4 各组大鼠海马组织中PI3K/Akt通路相关蛋白表达比较 与对照组比较,模型组大鼠海马组织中p-PI3K/PI3K、p-Akt/Akt表达水平明显降低(P<0.05);NC组大鼠海马组织中p-PI3K/PI3K、p-Akt/Akt表达水平与模型组比较差异无统计学意义(P>0.05),LncRNA H19-shRNA组大鼠海马组织中p-PI3K/PI3K、p-Akt/Akt表达水平较模型组、NC组明显增加(P<0.05);与LncRNA H19-shRNA组比较,LncRNA H19-shRNA+LY294002组大鼠海马组织中p-PI3K/PI3K、p-Akt/Akt表达水平明显降低(P<0.05)。详见表4、图3。

表4 各组大鼠海马组织中PI3K/Akt通路相关蛋白表达比较(±s)
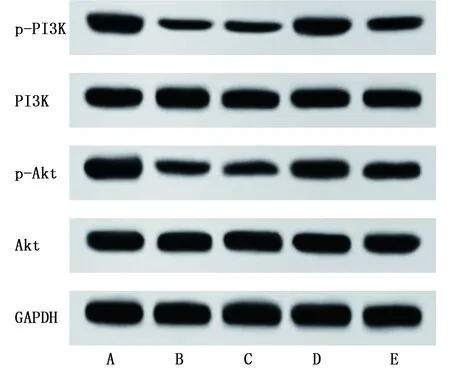
图3 各组大鼠海马组织中PI3K/Akt通路相关蛋白表达条带图(A为对照组;B为模型组;C为NC组;D为LncRNA H19-shRNA组;E为LncRNA H19-shRNA+LY294002组)
2.5 各组大鼠神经元损伤 对照组大鼠海马CA1区锥体细胞排列紧凑整齐、形态清晰完整,胞浆内存在大量尼氏小体;模型组和NC组大鼠海马CA1区锥体细胞排列松散紊乱、边界模糊、细胞核固缩、神经元数目明显减少(P<0.05);与模型组比较,LncRNA H19-shRNA组海马CA1区锥体细胞排列较为整齐紧凑,形态较为完整,核固缩现象减轻,尼氏小体数量增加,神经元数目明显增加(P<0.05);与LncRNA H19-shRNA组比较,LncRNA H19-shRNA+LY294002组海马CA1区神经元损伤加重,数目明显减少,差异均有统计学意义(P<0.05)。详见图4、图5、表5。
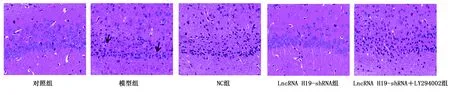
图4 HE染色观察各组大鼠神经元损伤情况(×400)

图5 Nissl染色观察各组大鼠神经元存活数目情况(×400)

表5 各组大鼠神经元存活数目情况比较(±s) 单位:个
2.6 透射电镜观察海马组织神经元自噬情况 对照组大鼠海马神经元存在少量溶酶体、未见自噬体;模型组和NC组大鼠海马神经元中出现大量自噬溶酶体;与模型组比较,LncRNA H19-shRNA组海马神经元中自噬溶酶体数目明显减少;与LncRNA H19-shRNA组比较,LncRNA H19-shRNA+LY294002组海马神经元中自噬体数目明显增加。详见图6。

图6 透射电镜观察海马组织神经元自噬情况(×25 000)
2.7 免疫组化法检测各组大鼠海马组织中Beclin-1、LC3Ⅱ蛋白表达情况 Beclin-1与LC3Ⅱ广泛存在于神经元胞浆中,与对照组比较,模型组大鼠海马组织中Beclin-1、LC3Ⅱ阳性表达明显增加;与模型组比较,NC组Beclin-1、LC3Ⅱ阳性表达无差异,LncRNA H19-shRNA组Beclin-1、LC3Ⅱ阳性表达明显降低;与LncRNA H19-shRNA组比较,LncRNA H19-shRNA+LY294002组Beclin-1、LC3Ⅱ阳性表达明显增加。详见图7。

图7 免疫组化法检测各组大鼠海马组织中Beclin-1、LC3Ⅱ蛋白表达情况(×200)
3 讨 论
癫痫是由神经元的异常兴奋诱发的神经系统疾病,其持续状态可造成神经系统和海马神经元急性或持久性的损伤[13]。癫痫病人存在一种或多种行为或认知障碍,其死亡风险高出正常人群2~3倍,是全球疾病相关死亡的主要原因[14]。自噬是一种保守的细胞降解途径,正常生理状态下处于低水平,通过降解受损、衰老蛋白质及细胞器来维持细胞内环境的稳定,但过度自噬则会导致细胞损伤[15]。有研究发现,自噬与癫痫之间存在紧密联系,过度的自噬可导致神经元凋亡,造成脑组织损伤,因此,自噬可能是治疗癫痫的一个新的突破口,有必要对其进行详细探究[14-15]。
LncRNA作为一类无编码蛋白质功能的转录本,通过调控基因表达参与细胞增殖、分化、自噬等生物学过程,参与癫痫等神经系统疾病的发生[16]。LncRNA H19被认为与中枢神经系统的发育和稳态密切相关,与缺血性脑卒中及癫痫等神经系统疾病的发生有关,LncRNA H19在癫痫持续状态大鼠海马神经元中表达水平明显增加[5,17]。在癫痫潜伏期LncRNA H19处于高表达状态,LncRNA H19通过靶向抑制let-7b表达促进海马神经元凋亡,促进癫痫发作[18]。有研究表明,LncRNA H19通过抑制MAP磷酸酶双特异性磷酸酶5(DUSP5)-细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)轴激活自噬,诱导脑缺血再灌注大鼠脑组织损伤[19]。本研究发现,模型组大鼠脑电图出现高幅高频波形,癫痫发作,LncRNA H19表达水平、神经元损伤程度明显增加,神经元存活数目降低,而LncRNA H19表达沉默可减轻大鼠癫痫发作程度、神经元损伤程度,增加神经元存活数目,该结果与其他研究结果[18]相一致,表明LncRNA H19参与癫痫的发生,其水平增加可促进大鼠神经元损伤,诱导癫痫发作,提示LncRNA H19可作为癫痫的一个潜在的治疗靶点。LC3参与自噬体的形成,LC3Ⅰ转变为LC3Ⅱ可促进自噬的发生,而Beclin1表达水平增加则会诱导细胞自噬[20]。本研究还发现,模型组大鼠海马组织中Beclin-1、LC3Ⅱ表达水平明显增加,而LncRNA H19表达沉默可降低Beclin-1、LC3Ⅱ表达水平,表明LncRNA H19表达增加对神经元的损伤可能与其促进细胞自噬有关。
PI3K/Akt在中枢神经系统中具有广泛的表达,是细胞存活及增殖的有效调节剂[21]。PI3K/Akt通路激活可抑制神经元凋亡并减轻癫痫模型大鼠癫痫发作程度[21]。LncRNA 母系表达基因3(materally expressed gene 3,MEG3)通过激活PI3K/Akt/雷帕霉素受体蛋白(mammalian target of rapamycin,mTOR)通路,抑制颞叶癫痫大鼠海马神经元炎症反应、氧化应激和细胞凋亡率,增加细胞活力[4]。LncRNA转移相关肺腺癌转录物 1(MALAT1)表达沉默可通过激活PI3K/Akt信号通路抑制癫痫大鼠海马神经元自噬和细胞凋亡[22]。LncRNA H19低表达可通过促进PI3K/Akt通路来抑制氧糖剥夺再灌注诱导的神经细胞的氧化应激和细胞凋亡[10]。本研究发现,模型组大鼠海马组织中p-PI3K/PI3K、p-Akt/Akt表达水平明显降低,LncRNA H19表达沉默可明显增加p-PI3K/PI3K、p-Akt/Akt表达水平,表明PI3K/Akt通路参与癫痫的发生。进一步研究发现,PI3K/Akt通路抑制剂可逆转LncRNA H19表达沉默对大鼠癫痫、自噬的抑制作用,表明LncRNA H19沉默对癫痫大鼠神经元自噬的抑制及神经元损伤的改善可能与其激活PI3K/Akt通路有关。
综上所述,LncRNA H19表达沉默可能通过促进PI3K/Akt通路激活来抑制癫痫大鼠海马神经细胞自噬,以此达到改善癫痫的作用。本研究不仅为癫痫自噬机制的研究提供数据依据,还对癫痫的治疗提供一个新的方向,但在未来的研究中还需对其下游机制进行深入探究。

