高效液相色谱串联质谱法同时测定红曲米中10 种真菌毒素含量
朱伟堃,井改革,赵蕊蕊,毕天琛,赵丹彤,王素香,刘延娟
(山东省菏泽市食品药品检验检测研究院,山东 菏泽 274000)
红曲米又名赤曲、红米、福米等,是我国传统药食两用的代表中药[1]。红曲米是以蒸至半熟的粳米为原料,接种曲霉科真菌紫色红曲霉Monascus purpurenusWent. 等菌种,经发酵而成[2]。研究表明,红曲米发酵过程中会产生莫纳可林类(如洛伐他汀等)、甾醇类、红曲色素等多种代谢产物,这些代谢产物具有预防心血管疾病、抗肿瘤、调脂等药理活性[3-5],广泛应用于医药、发酵食品、食品添加剂等领域。红曲米作为富含淀粉的发酵类谷物,红曲米的原料、发酵过程、贮存运输过程等均面临着被真菌毒素污染的风险。粮谷类[6-7]及淀粉基质的中药材及其炮制品[8-9]中黄曲霉毒素、赭曲霉毒素、呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、伏马毒素、T-2 毒素(T-2)等真菌毒素易超出限量标准。通风干燥的条件下,薏苡仁中黄曲霉毒素B1(AFB1)和黄曲霉毒素B2(AFB2)含量会大幅增加;高温高湿及通风干燥的条件下,薏苡仁中ZEN含量迅速增加[10]。真菌毒素具有较强致癌、致畸及肝肾毒性[11-12],有必要建立高效、准确的检测方法以筛查红曲米中的真菌毒素,确保食用和药用安全。目前,对红曲米中真菌毒素的研究较少,且多集中于桔霉素和赭曲霉毒素等[1,13]。2020 年版《中国药典(四部)》中列出了真菌毒素单独或联合测定的分析方法[8]。但中药基质复杂,不同基质样品会导致其分析方法不同[14]。参考《中国药典(四部)》方法[8],本研究中采用固相萃取柱净化,建立了同时测定红曲米中 AFB1,AFB2,T - 2,DON,ZEN 及黄曲霉毒素 G1(AFG1)、黄曲霉毒素G2(AFG2)、伏马毒素B1(FB1)、伏马毒素B2(FB2)、赭曲霉毒素A(OTA)10 种真菌毒素含量的高效液相色谱谱串联质谱(HPLC-MS/MS)法,为红曲米中真菌毒素的检测提供了参考。现报道如下。
1 仪器与试药
1.1 仪器
20AD 型高效液相色谱仪(日本岛津公司),API4000 型电喷雾三重四极杆质谱仪(美国Finnigan 公司);XS105 型电子天平(瑞士Mettler Toledo 公司,精度为0.01 mg);PRD -S-Q277 型超声波清洗器(杭州超声波有限公司,功率为600 W,频率为42 kHz);HY - 4型调速多用振荡器(金坛市江南仪器厂);3K15 型离心机(德国Sigma 公司);TTL - DCⅡ型氮吹仪(北京同泰联科技发展有限公司);Milli - Q 型超纯水仪(美国Merk Millipore公司)。
1.2 试药
10 种真菌毒素混合对照品溶液(天津阿尔塔科技有限公司,批号为S076583,AFB1,AFB2,AFG1,AFG2,FB1,FB2,T - 2,DON,OTA,ZEN 的质量浓度分别为0.04,0.02,0.04,0.02,0.4,0.4,0.4,10.0,0.04,0.1 µg/ mL,纯度为 99.9%,99.3%,99.0%,98.4%,99.0%,98.5%,99.0%,99.9%,99.9%,99.9%);真菌毒素六合一免疫亲和柱(北京华安麦科生物技术有限公司,批号为O0924AZNOTF,规格6 mL,柱容量AFB1,AFB2,AFG1,AFG2 为 300 ng,FB1 和 FB2 为 5 000 ng,T - 2 为 1 000 ng,DON 为 2 000 ng,OTA 为 100 ng,ZEN为1 000 ng);甲醇、乙腈、甲酸均为色谱纯,购于美国Merk 公司;氯化钾、氯化钠、磷酸二氢钾、磷酸氢二钠、吐温20、冰醋酸均为分析纯,购于天津科密欧化学试剂有限公司;玻璃纤维滤纸(英国Whatman 公司,型号934 - AH,孔径1.5 µm);12 批红曲米及其炮制品(市售,编号1-3 和编号7-9 为红曲米饮片,编号4-6 为红曲米药材,编号10 - 12 为红曲米炭;编号1 - 6 和编号10-11 产地为福建,编号7-9 产地为安徽,编号12产地为河北),经山东省菏泽市食品药品检验检测研究院赵丹彤副主任药师鉴定为正品。
2 方法与结果
2.1 检测条件
2.1.1 色谱条件
色谱柱:Acquity UPLC HSS T3 C18柱(100 mm ×2.1 mm,1.8 µm);柱温:40 ℃;流速:0.3 mL/min;进样量:10 µL;流动相:A 为 0.01% 甲酸,B 为含 0.1% 甲酸的乙腈 - 甲醇(1∶1,V/V),梯度洗脱(0~2.0 min 时5%B,2.0~2.1 min 时 5%B → 40%B,2.1~7.0 min 时40%B → 55%B,7.0~10.0 min 时 55%B → 90%B,10.0~10.5 min 时 90%B → 5%B,10.5~13.0 min 时5%B)。
2.1.2 质谱条件
采用电喷雾离子源(ESI),多反应监测、正负离子模式扫描;雾化气:氮气;雾化气流速:10.0 L /min;离子源温度:300 ℃;脱溶剂气温度:300 ℃;加热模块温度:400 ℃;碰撞气:氩气。质谱采集参数见表1。
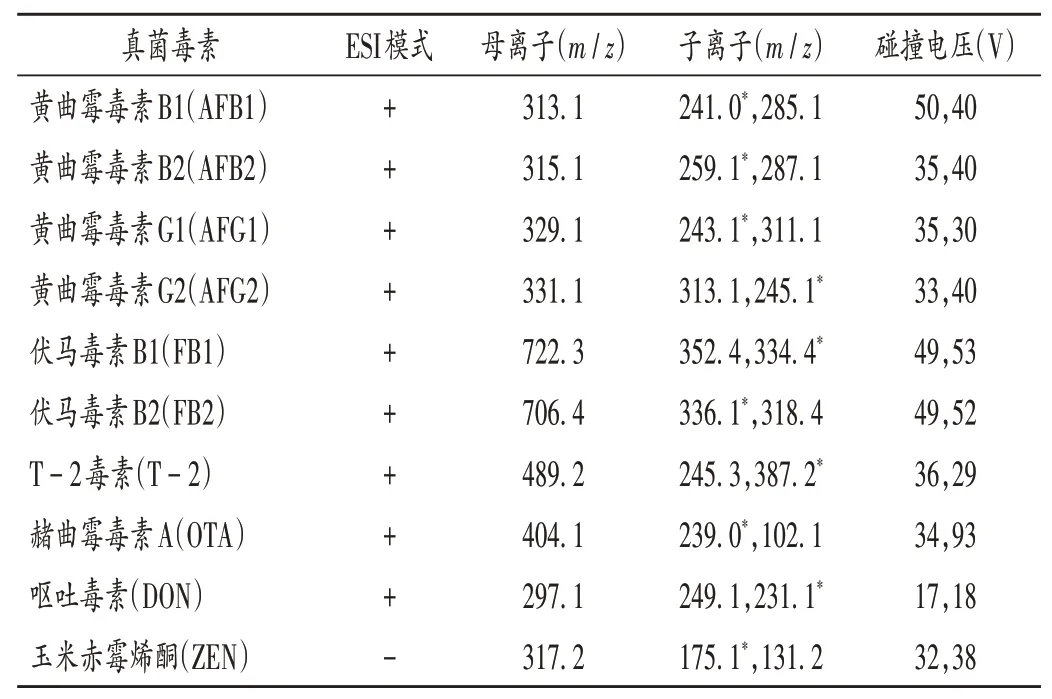
表1 10种真菌毒素质谱采集参数Tab.1 Mass spectrometry acquisition parameters of 10 mycotoxins
2.2 溶液制备
样品前处理:精密称取样品粉末6.25 g(过2 号筛),精密加入80%乙腈溶液(含1%乙酸)25 mL,摇床剧烈振荡(转速为250 r / min)20 min,离心(转速为4 000 r/min)5 min,移取上清液;向残渣中精密加入80%甲醇溶液25 mL,摇床剧烈振荡(转速为250 r / min)20 min,离心(转速为4 000 r/min)5 min,移取上清液,合并2次上清液,混匀,精密量取5 mL,加入35 mL 稀释液(NaCl 8 g,KCl 0.2 g,KH2PO40.2 g,Na2HPO4·12H2O 1.16 g),混匀,用玻璃纤维滤纸滤过。精密量取滤液32 mL,缓缓通过已处理好的免疫亲和柱,依次用0.1%吐温20水溶液、水各10 mL 洗脱,待液体排干后,用3 mL 含2%甲酸的甲醇溶液洗脱。洗脱方式为先上样2 mL,堵住亲和柱下方出口,静置3 min,收集洗脱液;再上样1 mL,堵住亲和柱下方出口,静置3 min,收集洗脱液。合并2次洗脱液,50 ℃下用氮吹仪吹干。
混合对照品溶液:分别精密量取上述10 种真菌毒素混合对照品溶液 25,50,125,250,500 µL,分别置5 mL 容量瓶中,加50%甲醇稀释并定容,摇匀,即得混合对照品溶液1-5。
空白基质溶液:经前期测定结果显示,样品(编号为8号)未检出10种真菌毒素,取5份作为空白基质,按样品前处理方法处理空白样品,精密量取混合对照品溶液1-5 各2 mL,混匀,用0.22 µm 滤膜滤过,取续滤液,分别为空白基质溶液1-5。
供试品溶液:取样品,按样品前处理方法处理,精密加入50%甲醇溶液2 mL,混匀,用0.22 µm 滤膜滤过,取续滤液,即得。
2.3 方法学考察
线性关系考察:取2.2 项下空白基质溶液1-5,按2.1项下检测条件进样检测,典型总离子流图见图1,提取离子对色谱图见图2。以10 种真菌毒素的峰面积(Y)为纵坐标、质量浓度(X,µg/mL)为横坐标,进行线性回归。详见表2。
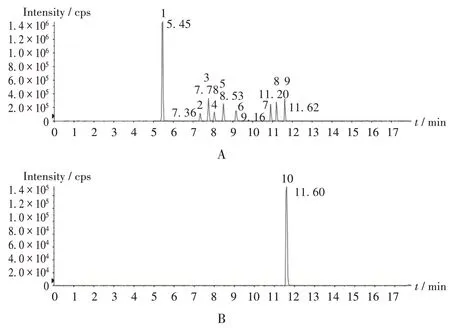
图1 10种真菌毒素典型总离子流图Fig.1 Typical total ion chromatograms of 10 mycotoxins
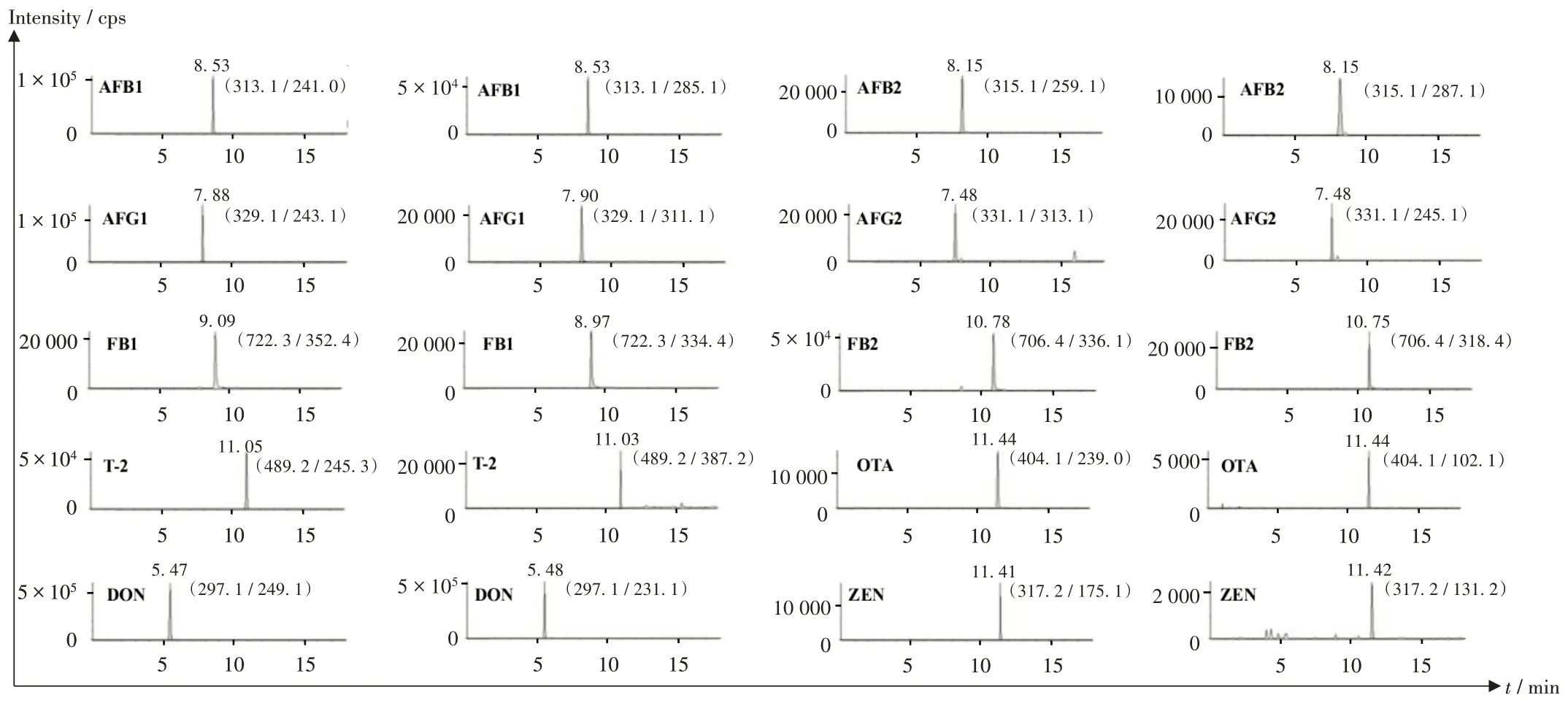
图2 10种真菌毒素提取离子对高效液相色谱串联质谱色谱图Fig.2 HPLC-MS/MS chromatograms of extracted ion pairs of 10 mycotoxins
检测限和定量限确定:取2.2项下空白基质溶液逐级稀释,按3 倍信噪比(S/N)计算检测限、10 倍S/N计算定量限。结果见表2。
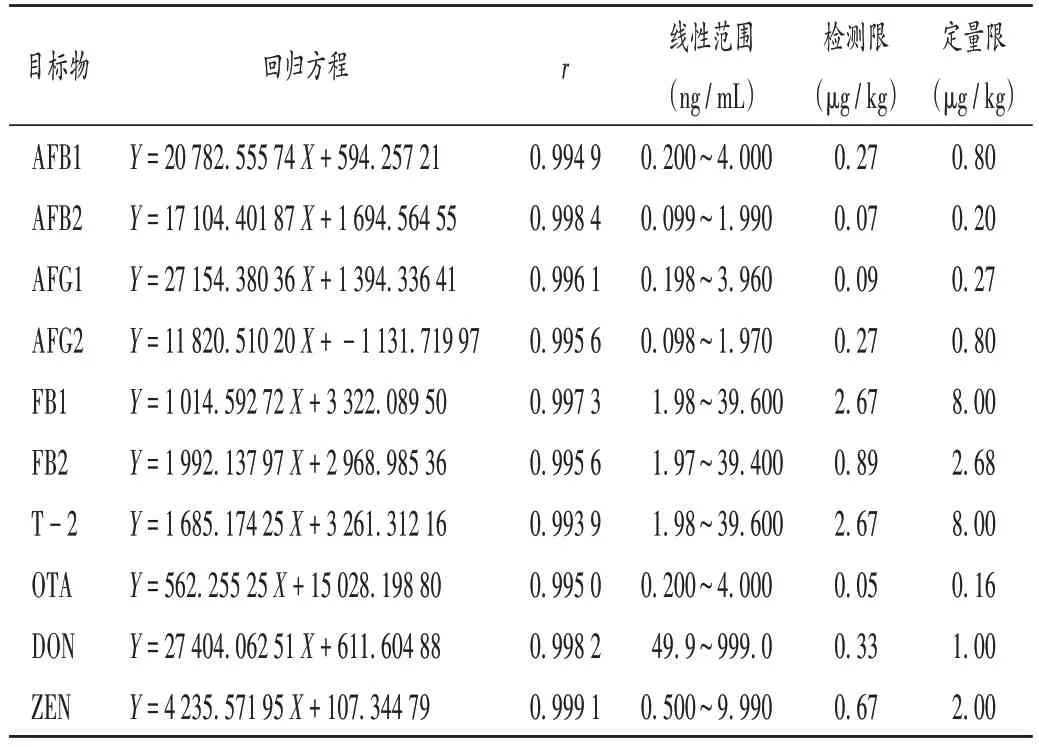
表2 10种真菌毒素线性关系考察与检测限及定量限确定结果Tab.2 Results of the linear relation test,LOD and LOQ of 10 mycotoxins
加样回收试验:精密称取空白基质适量,分别加入2.2 项下10 种真菌毒素混合对照品溶液0.25,0.625,2.5 mL,制成低、中、高3个浓度的样品加样回收试验溶液,按2.1 项下方法对样品进行前处理,各平行3 次,结果10 种真菌毒素的平均加样回收率均在60%~120%之间,相对标准偏差(RSD)均低于6.00%(n= 9),表明方法准确度良好。详见表3。
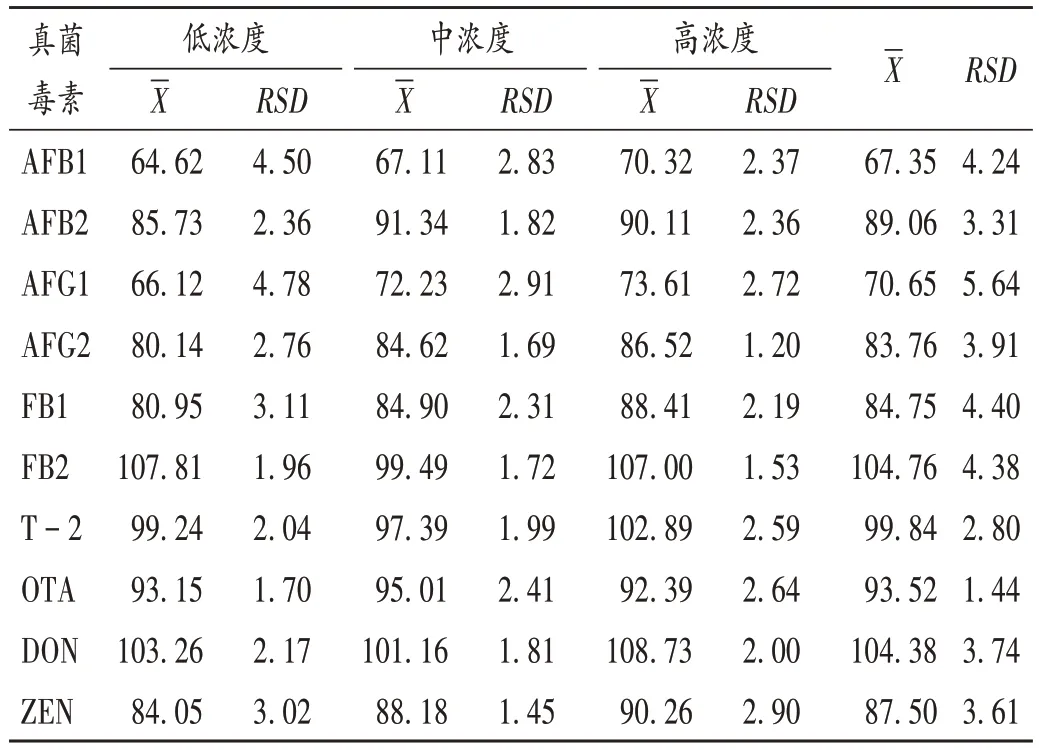
表3 10种真菌毒素加样回收试验结果(%,n=9)Tab.3 Results of the recovery test of 10 mycotoxins(%,n=9)
重复性试验:取加样回收试验项下中浓度样品加样回收试验溶液,平行制备6 份,按2.1 项下检测条件进样检测。结果AFB1,AFB2,AFG1,AFG2,FB1,FB2,T-2,OTA,DON,ZEN 的平均含量及RSD分别为2.75,1.87,2.87,1.65,33.60,38.92,38.29,3.79,1 007.23,8.83 µg/ kg,RSD分 别 为 4.89%,3.76%,3.20%,3.80%,1.49%,1.95%,1.81%,4.25%,1.53%,1.51%,表明方法重复性良好。
精密度试验:取2.2 项下空白基质溶液3,按2.1 项下检测条件连续进样5 次,结果10 种真菌毒素峰面积的RSD在0.30%~1.97%(n= 5)间,表明仪器精密度良好。
稳定性试验:取加样回收试验项下中浓度加样加收试验溶液,于室温下放置0,6,12,18,24 h时按2.1项下检测条件进样检测,记录10种真菌毒素的峰面积。结果 AFB1,AFB2,AFG1,AFG2,FB1,FB2,T - 2,OTA,DON,ZEN 峰面积的RSD均小于4.0%,分别为2.06%,1.83%,2.98%,1.10%,2.57%,2.06%,1.76%,2.17%,3.00%,2.99%(n= 5),表明待测样品溶液在24 h 内稳定性良好。
2.4 样品含量测定
取12 批样品,按2.2 项下方法制备供试品溶液,平行2 份,按2.1 项下检测条件进样测定,采用空白基质溶液匹配标准曲线,计算10种真菌毒素的含量。结果12批样品中AFB2,AFG1,FB1,T - 2,DON,OTA 6 种真菌毒素均未检出,AFB1,AFG2,FB2,ZEN 的检出情况见表4。
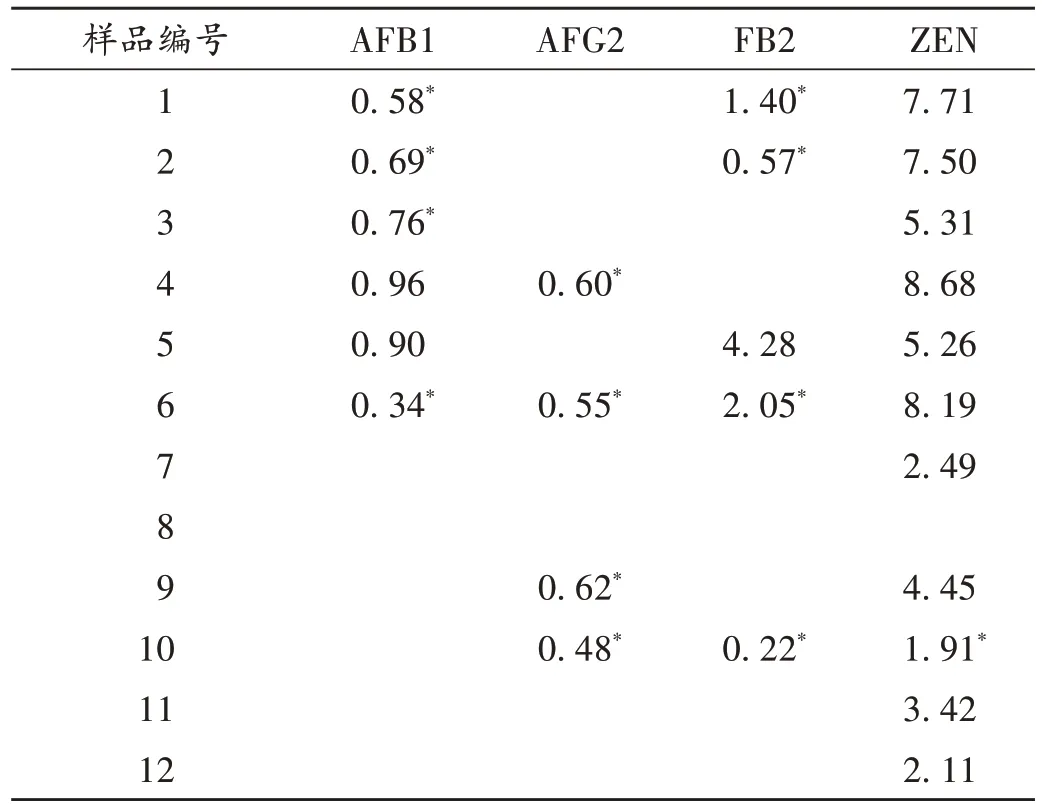
表4 12批样品中真菌毒素含量测定结果(μg/kg,n=2)Tab.4 Results of the content determination of mycotoxins in the 12 batches of samples(μg/kg,n=2)
3 讨论
3.1 色谱与质谱条件优化
2020年版《中国药典(四部)》中,多种真菌毒素的测定方法均以0.01%甲酸为流动相A,以乙腈-甲醇(1∶1,V/V)为流动相B,梯度洗脱[8]。但该条件下AFG2 的响应值过低,且DON 出峰时间过早,峰形较差。经反复试验,最终确定以0.01%甲酸为流动相A,以含0.1%甲酸的乙腈 - 甲醇(1∶1,V/V)为流动相B,梯度洗脱,可获得满意结果。
按2020年版《中国药典(四部)》多种真菌毒素的测定方法提供的质谱条件进行检测,发现OTA 在原负离子模式下响应值过低,不利于检测,后参考药典中单独测定OTA 的质谱条件,正离子模式下OTA 的响应值显著提高,可获得较好的检测结果。
3.2 样品前处理方法优化
提取液中加入一定量的盐,并使提取液pH 保持中性或偏酸性,可提取完全真菌毒素[14]。预试验中,采用原标准中70%甲醇进行提取,发现OTA,DON,ZEN 等的提取效率较低,参考文献[14-16]和2020年版《中国药典(四部)》中ZEN 的提取溶剂,采用偏酸性溶液进行提取,可获得较高回收率。
在通过固相萃取柱净化时,供试品溶液颜色较深,仅用水无法有效脱去样品中的色素,影响检测结果,采用0.1%吐温20水溶液可显著提高洗脱效率,并减少色素杂峰的影响。
3.3 基质效应考察
取2.2 项下50%甲醇配制的系列混合对照品溶液和空白基质溶液,分别按2.1 项下检测条件检测,并绘制标准曲线。通过比较基质/溶剂2 种标准曲线的斜率比值来判断某种真菌毒素的基质效应是增强还是减弱。斜率比值大于1 为基质效应增强,斜率比值小于1为基质效应减弱。结果AFG1 和AFG2 的基质效应不明显,AFB1,ZEN,DON呈基质减弱效应,OTA,AFB2,T-2,FB1,FB2 均呈基质增强效应。可见,超过60%的真菌毒素均受基质效应的影响,故最终确定以空白基质配制标准曲线,以抵消基质效应的影响。
3.4 样品检测结果分析
由检测结果可知,虽有部分样品检出,但均符合2020 年版《中国药典》(一部)中的规定,薏苡仁中AFB1不得过5 µg/kg,AFB1,AFB2,AFG1,AFG2总量不得过10 µg/kg,ZEN 不得过500 µg/kg[17],谷物及其制品中ZEN 的限量标准不得过 60 µg/kg[18],12 批样品中ZEN的残留量均符合限量要求。我国尚未制订伏马毒素限量标准,参考欧盟标准中对婴幼儿玉米制品中伏马毒素的总量(含FB1+FB2)不得过200 µg/kg[19],12 批样品均符合要求。
红曲米及其炮制品受真菌毒素污染的风险较小,但也可能是本研究中收集的样品量较少、覆盖范围较小,今后将扩大样品收集范围,进一步深入研究。本研究中建立的方法可同时测定红曲米中10种真菌毒素,为红曲米及其炮制品加工、运输、贮藏过程中的真菌毒素污染风险评估和监测提供技术支持。

