MicroRNA-155/Nrf2对体外培养雪旺细胞增殖和迁移的影响及作用机制*
赵飞,姚忠军,曹洪,朱必涛,张弥
(1.湖北医药学院附属太和医院 骨2科,湖北 十堰 442000;2.湖北医药学院附属人民医院创伤骨科,湖北 十堰 442000;3.湖北医药学院附属太和医院 皮肤科,湖北 十堰 442000)
坐骨神经慢性卡压损伤是临床上较常见的周围神经损伤,易致组织破坏和痛觉过敏[1-2]。研究发现,雪旺细胞是周围神经系统中特有的胶质细胞,在周围神经损伤后促进神经自发再生[3-5]。神经营养因子可促进神经再生,但该因子在临床应用上受到限制[6]。因此,迫切需要寻找新的方法保护雪旺细胞并提高其增殖、迁移等功能,促进神经再生,对治疗坐骨神经慢性卡压损伤等周围神经损伤具有重要意义。miRNA 是一类小的内源性非编码RNA,在周围神经损伤后表达失调,并影响雪旺细胞表型[7-8]。有研究显示,miR-155 在坐骨神经慢性卡压损伤大鼠中高表达,抑制其表达可缓解神经损伤引起的痛感和炎症反应[9-10]。然而,miR-155 在雪旺细胞中的功能与机制尚不明确。生物信息学在线工具starBase 预测发现核因子E2 相关因子2(Nrf2)可能是miR-155 的下游靶标,Nrf2 与细胞的增殖、迁移密切相关。神经生长因子(Ngf)、层粘连蛋白(Laminin)是介导细胞增殖和迁移的关键成分,但miR-155 是否靶向Nrf2 调控Ngf 和Laminin 表达,介导雪旺细胞增殖、迁移仍不清楚。故本研究以体外培养的雪旺细胞作为研究对象,进一步探讨miR-155 对雪旺细胞增殖、迁移的调控作用与潜在机制。
1 材料与方法
1.1 实验细胞和材料
大鼠雪旺细胞(RSC96,中国科学院细胞库),DMEM 培养基、胎牛血清(美国Gibco 公司),RNA 提取试剂盒、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试 剂盒、逆转录试剂盒(北京全式金生物工程技术研究有限公司),CCK-8 试剂盒(上海碧云天生物技术有限公司),miR-155 mimics、miR-155 inhibitor、小干扰RNA Nrf2 [si-Nrf2、si-Nrf2(1)、si-Nrf2(2)](苏州吉诺瑞生物科技有限公司),Lipofectamine 3000 细胞转染试剂(美国Invitrogen 公司),蛋白酶抑制剂混合液、RIPA 细胞裂解液(湖南艾佳生物科技股份有限公司),ECL 发光试剂盒(江苏凯基生物技术股份有限公司),兔抗Nrf2 抗体(1∶1000,武汉博士德生物工程有限公司),TransZolTMUP 试剂(北京全式金生物技术股份有限公司),PVDF 膜(美国Millipore 公司),pmirGLO 载体(上海生工生物工程股份有限公司),倒置相差显微镜(日本Olympus 公司)。
1.2 方法
1.2.1 细胞培养与分组 将大鼠雪旺细胞RSC96置于含10%胎牛血清的DMEM 培养基培养,在条件为37℃、5%二氧化碳的培养箱中培养,每2 天换液1 次。细胞达到80%融合,传代培养。为验证miR-155 过表达/抑制质粒转染效果,探究miR-155 对雪旺细胞增殖、迁移的影响,将细胞分为inhibitor NC组(细胞转染inhibitor NC 质粒)、miR-155 inhibitor 组(细胞转染miR-155 inhibitor 质粒)、miR-NC 组(细胞转染miR-NC 质粒)、miR-155 mimics 组(细胞转染miR-155 mimics 质粒)。为了验证Nrf2 沉默效果,将细胞分为si-NC 组(细胞转染si-NC 质粒)、si-Nrf2(1)组[细胞转染si-Nrf2(1)质粒]、si-Nrf2(2)组[细胞转染si-Nrf2(2)质粒]。为证实靶向Nrf2 可实现miR-155 对细胞增殖、迁移的影响和Nrf2、Ngf、Laminin mRNA 相对表达量的调控作用,拟抑制miR-155 表达的同时选取Nrf2 沉默效果较好的质粒(si-Nrf2)转染细胞行挽救实验,探讨miR-155 的作用是否会部分逆转,将细胞分为miR-155 inhibitor+si-NC组(细胞转染miR-155 inhibitor 和si-NC 质粒)、miR-155 inhibitor+si-Nrf2 组(细胞转染miR-155 inhibitor和si-Nrf2 质粒)。探究miR-155 对细胞增殖、迁移的作用以及miR-155 靶向Nrf2,要想证实miR-155 是通过调控Nrf2 发挥其作用,需要做挽救实验。
1.2.2 细胞转染 取对数生长期、生长状态良好的雪旺细胞,按照2.5×105个/孔的密度接种于6 孔板中,培养24 h。细胞达到60%~80%融合后,换成无血清培养基培养。根据Lipofectamine 3000 转染试剂说明书要求,取2 μL Lipofectamine 3000 加入198 μL无血清培养基,混匀,静置5 min 获得Lipofectamine 3000 稀释液。将miR-155 mimics(50 nmoL)、miR-155 inhibitor(50 nmoL)、si-Nrf2(1)(100 nmoL)和si-Nrf2(2)(100 nmoL)及阴性对照质粒(miR-NC、inhibitor NC、si-NC)分别加入200 μL 无血清培养基中,混匀,获得质粒稀释液。然后,将上述两种稀释液混合,静置15 min 后取100 μL 加入到含1 mL 无血清培养基的细胞中,混匀,于培养箱中孵育6 h,更换正常培养基培养24 h 用于后续实验。
1.2.3 CCK-8 法检测细胞增殖 取对数生长期的细胞,以3 000 个/孔的密度接种至96 孔板中,inhibitor NC 组、miR-155 inhibitor 组、miR-NC 组、miR-155 mimics 组均转染相应质粒,细胞培养24 h、48 h、72 h;inhibitor NC 组、miR-155 inhibitor 组、miR-155 inhib‐itor+si-NC 组、miR-155 inhibitor+si-Nrf2 组转染相 应质粒,均培养48 h。然后每孔加入10 μL CCK-8 溶液,孵育2 h,测定450 nm 波长吸光度值。每组设置3 个复孔,实验重复3 次,取平均值。
1.2.4 Transwell实验检测细胞迁移 Transwell 小室下室加入600 μL 含10%血清的培养基,取相应处理组细胞悬液150 μL 加入Transwell 小室中,3×104个细胞/孔,37℃、5%二氧化碳培养箱中培养24 h。然后取出Transwell 小室,弃掉每孔中的培养液、用无钙的磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2 遍,4%多聚甲醛固定30 min。用0.1%结晶紫染色20 min 后,使用棉签轻轻擦掉上层未迁移细胞。使用PBS 洗涤3 遍,于显微镜(×100)下拍照,并用Image J 软件分析。
1.2.5 qRT-PCR 测定mRNA 表达 将按分组处理好的雪旺细胞(1×105个/孔)接种于24 孔板中,培养24 h。细胞转染处理后加入预冷的PBS 润洗2 次,吸弃PBS,每孔加入1 mL 的TransZolTMUP 试剂提取总RNA,并以RNA 作为模板使用逆转录试剂盒获得cDNA,反应体系:RNA 1 μL,Oligo(dT)1 μL,Reaction Mix 10 μL,Enzyme Mix 1 μL,RNase-free Water 7 μL,42℃孵育15 min,85℃加热5 s。然后,以此cDNA 为模板参照引物序列进行qRT-PCR 扩增,扩增体系:Green qPCR Supermix 10 μL,正向引物0.4 μL,反向引物0.4 μL,cDNA 模板1 μL,Nuclease-free Water 8.2 μL;反应体系:94℃预变性30 s,94℃变性5 s,56℃退火15 s,72℃延伸10 s,共40 个循环。采用2-ΔΔCT法计算目的基因相对表达量,将U6作为miR-155 内参,GAPDH作为其他基因内参。基因引物序列见表1。

表1 引物序列
1.2.6 Western blotting测定蛋白表达 将按分组处理好的雪旺细胞(3×106个/mL)接种于6 孔板中并培养过夜。细胞转染质粒后,预冷的PBS 洗涤3 次,加入RIPA 裂解液(含蛋白酶抑制剂),提取雪旺细胞总蛋白,测定每组蛋白样品浓度。取5 μL 蛋白预染Marker 和30 μg 蛋白样品进行SDS-PAGE 凝胶电泳,转至PVDF 膜。转膜后封闭1 h,剪下Marker 目的条带和内参条带所在区域的膜。将膜放入相应的一抗稀释液中4℃孵育过夜,洗膜后再结合二抗1 h。最后,使用ECL 化学发光液于多功能凝胶成像系统进行曝光成像,其中Actin 作为内参。
1.2.7 双荧光素酶报告实验测量荧光素酶活性 分别将Nrf2 的3'-UTR 全长和Nrf2 突变体克隆到pmirGLO 载体中,获得野生型Nrf2 和突变型Nrf2 报告载体。将细胞以1 × 105个/孔的密度接种于24孔板中,并通过lipofectamine 3000 将报告载体和miR-155 mimics、miR-155 inhibitor 或阴性对照miRNC、inhibitor NC 共转染细胞。转染48 h 后,收集各组细胞,通过荧光素酶报告实验测定荧光素酶活性以评估miR-155 与Nrf2 的关系。
1.3 统计学方法
数据分析采用GraphPad Prism 8 和SPSS 22.0 统计软件。计量资料以均数±标准差()表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用Tukey post hoc test 法。P<0.05 为差异有统计学意义。
2 结果
2.1 各组miR-155相对表达量比较
inhibitor NC 组miR-155 相对表达量为(1.00±0.08)、miR-155 inhibitor 组为(0.29±0.04)、miR-NC组 为(1.00±0.14)、miR-155 mimics 组 为(2.63±0.18),经单因素方差分析,差异有统计学意义(F=188.200,P=0.000)。miR-155 inhibitor 组较inhibitor NC 组降低,miR-155 mimics 组较miR-NC 组升高,表明转染成功。
2.2 各组不同时间点吸光度值比较
inhibitor NC 组、miR-155 inhibitor 组、miR-NC组、miR-155 mimics 组0 h、24 h、48 h、72 h 的吸光度值比较,经重复测量设计的方差分析,结果显示:①不同时间点间的细胞增殖有差异(F=554.000,P=0.000);②各组细胞增殖有差异(F=147.500,P=0.000);③细胞增殖的变化趋势有差异(F=32.100,P=0.000)。见表2 和图1。
表2 各组不同时间点吸光度值比较()
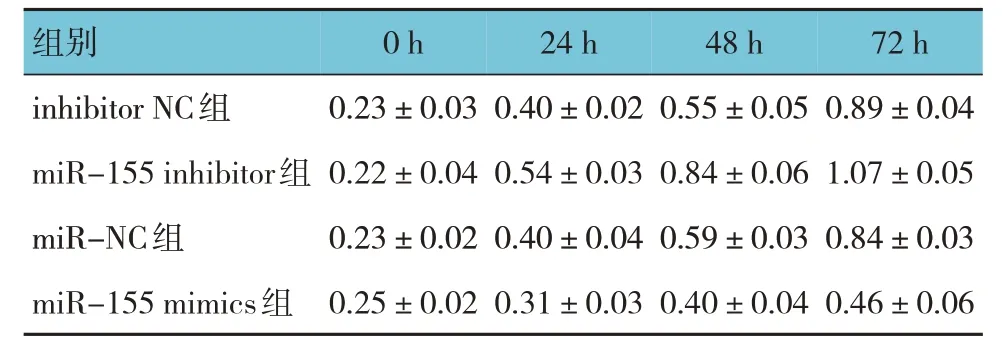
表2 各组不同时间点吸光度值比较()
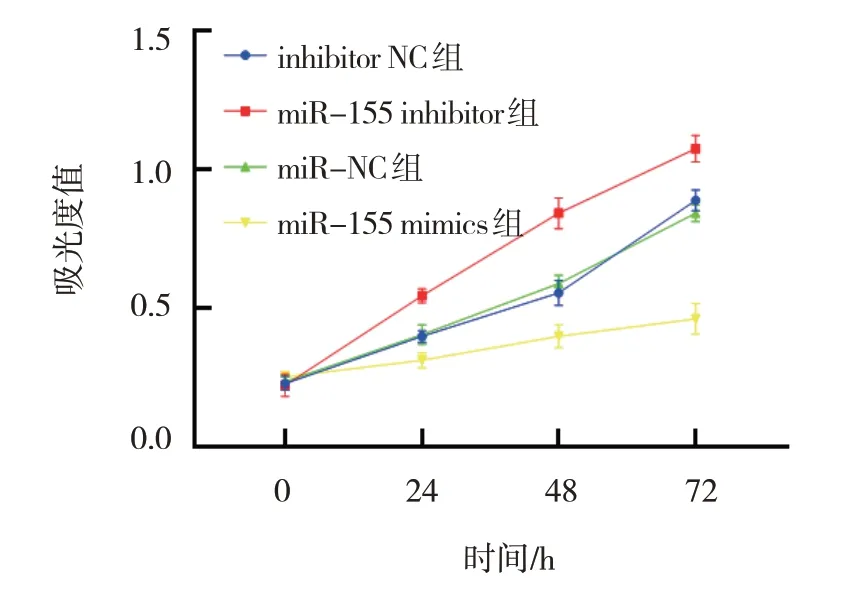
图1 各组不同时间点吸光度值的变化趋势()
2.3 各组细胞迁移数比较
miR-NC 组细胞迁移数为(278±9)个/视野、miR-155 mimics 组为(523±5)个/视野、inhibitor NC组为(274±21)个/视野、miR-155 inhibitor 组为(153±14)个/视野,经单因素方差分析,差异有统计学意义(F=394.300,P=0.000),miR-155 inhibitor 组 较inhibitor NC 组减少,miR-155 mimics 组较miR-NC 组增加。表明miR-155 抑制雪旺细胞迁移。见图2。
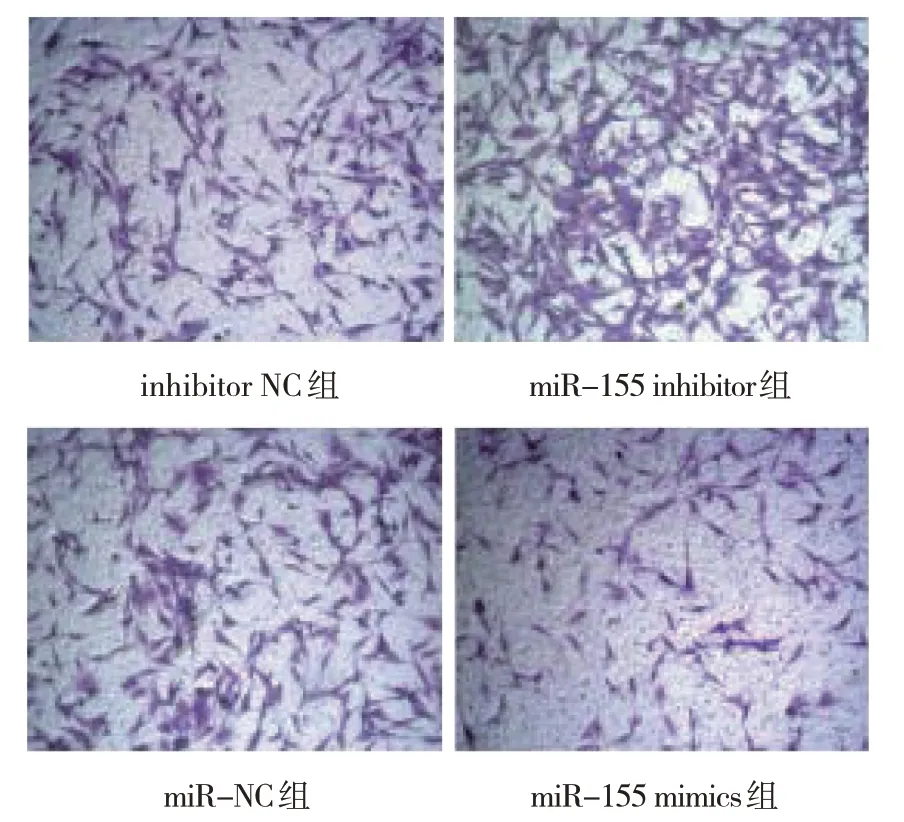
图2 miR-155抑制雪旺细胞迁移(×100)
2.4 各组Ngf、Laminin mRNA相对表达量比较
各组Ngf、Laminin mRNA 相对表达量比较,差异有统计学意义(P<0.05),miR-155 inhibitor 组较inhibitor NC 组 高,miR-155 mimics 组 较miR-NC 组低。表明miR-155 抑制Ngf、Laminin mRNA 相对表达。见表3。
表3 各组Ngf、Laminin mRNA相对表达量比较()
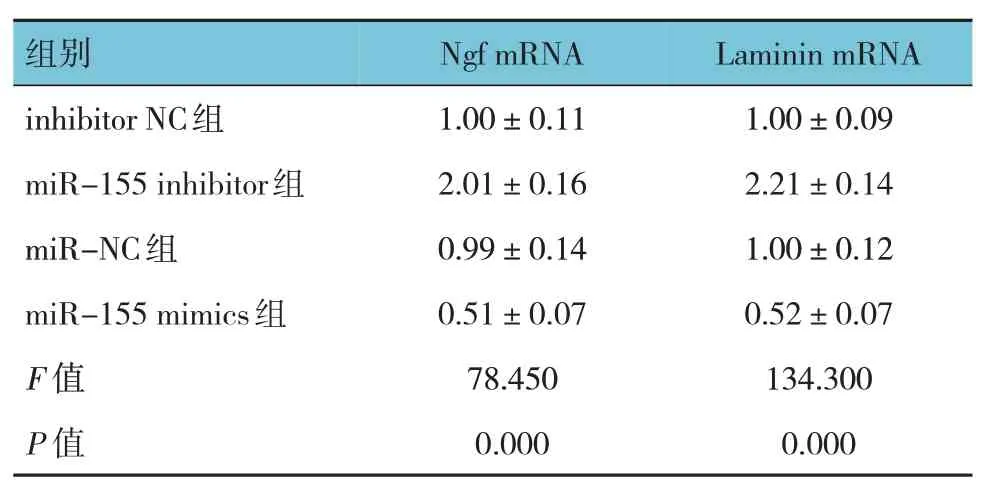
表3 各组Ngf、Laminin mRNA相对表达量比较()
2.5 各组Nrf2 mRNA、蛋白相对表达量比较
各组Nrf2 mRNA、蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05),miR-155 inhibitor 组 较inhibitor NC 组升高,miR-155 mimics 组较miR-NC 组降低。见表4、图3。
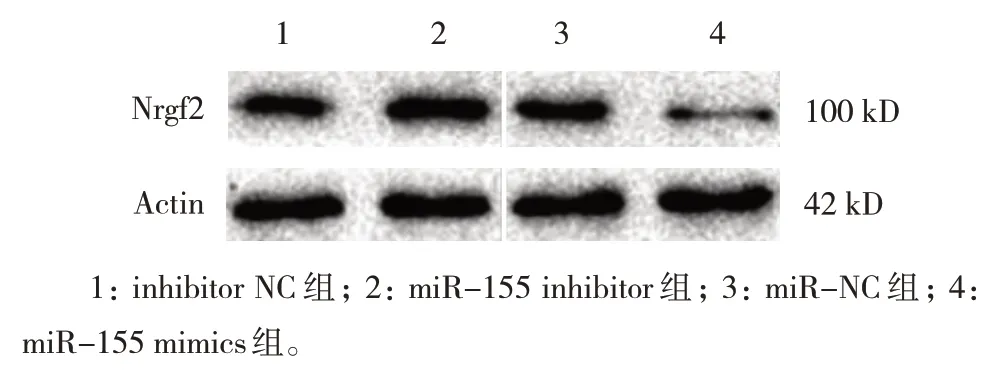
图3 各组Nrf2蛋白水平比较
表4 各组Nrf2 mRNA、蛋白相对表达量比较()
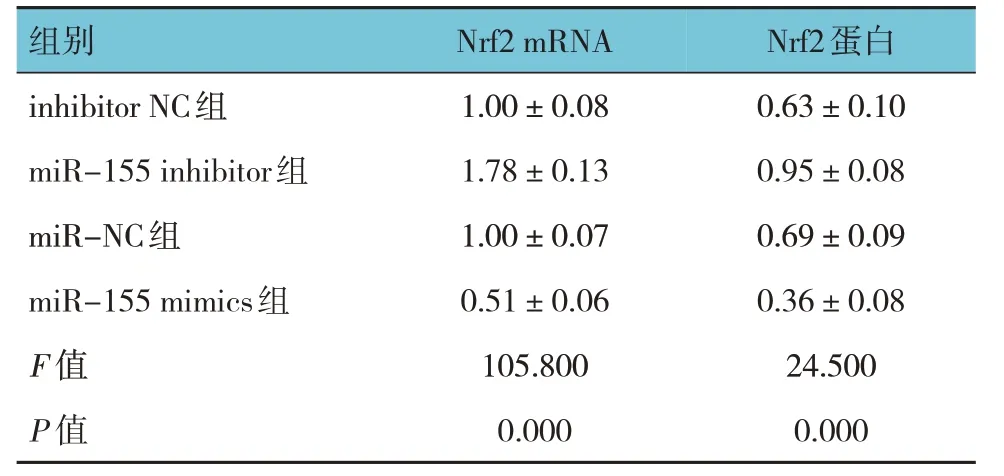
表4 各组Nrf2 mRNA、蛋白相对表达量比较()
2.6 Nrf2与miR-155的关系
在线生物信息学工具starBase 预测发现,miR-155 与Nrf2 存在潜在结合位点,并构建了突变序列(见图4)。各组野生型Nrf2 细胞荧光素酶活性比较,差异有统计学意义(P<0.05),miR-155 inhibitor组较inhibitor NC 组升高,miR-155 mimics 组较miRNC 组降低。各组突变型Nrf2 细胞的荧光素酶活性比较,差异无统计学意义(P>0.05)。结果表明,miR-155 与Nrf2 存在靶向关系。见表5。
表5 各组荧光素酶相对活性比较()

表5 各组荧光素酶相对活性比较()

图4 miR-155与Nrf2的结合位点的预测结果
2.7 沉默效果验证实验中各组Nrf2 mRNA相对表达量比较
沉默效果验证实验中si-NC 组Nrf2 mRNA 相对表达量为(1.00±0.07)、si-Nrf2(1)组为(0.46±0.07)、si-Nrf2(2)组为(0.34±0.09),经单因素方差分析,差异有统计学意义(F=47.140,P=0.000),si-Nrf2(1)组和si-Nrf2(2)组较si-NC 组降低,且si-Nrf2(2)组效果更好。
2.8 挽救实验中各组Nrf2 mRNA相对表达量比较
挽救实验中各组Nrf2 mRNA 相对表达量为(1.00±0.14)、miR-155 inhibitor 组为(1.97±0.12)、miR-155 inhibitor+si-NC 组为(1.89±0.10)、miR-155 inhibitor+si-Nrf2 组为(1.23±0.08),经单因素方差分析,差异有统计学意义(F=55.410,P=0.000),miR-155 inhibitor 组 较 inhibitor NC 组 高,miR-155 inhibitor+si-Nrf2 组较miR-155 inhibitor+si-NC 组低。表明si-Nrf2 可部分逆转miR-155 inhibitor 对Nrf2 表达的调控。
2.9 挽救实验中各组细胞吸光度值比较
挽救实验中inhibitor NC 组细胞吸光度值为(0.40±0.05)、miR-155 inhibitor 组为(0.80±0.06)、miR-155 inhibitor+si-NC 组为(0.85±0.06)、miR-155 inhibitor+si-Nrf2 组为(0.52±0.06),经单因素方差分析,差异有统计学意义(F=44.370,P=0.000),miR-155 inhibitor 组 较 inhibitor NC 组 高,miR-155 inhibitor+si-Nrf2 组较miR-155 inhibitor+si-NC 组低。表明si-Nrf2 可部分逆转miR-155 inhibitor 对雪旺细胞增殖的调控。
2.10 挽救实验中各组细胞迁移数量比较
挽救实验中inhibitor NC 组细胞迁移数量为(262±19)个/视野、miR-155 inhibitor 组为(493±28)个/视野、miR-155 inhibitor+si-NC 组为(487±23)个/视野、miR-155 inhibitor+si-Nrf2 组为(304±37)个/视野,经单因素方差分析,差异有统计学意义(F=57.160,P=0.000),miR-155 inhibitor 组较inhibitor NC组增加,miR-155 inhibitor+si-Nrf2 组较miR-155 inhibitor+si-NC 组减少。表明si-Nrf2 可部分逆转miR-155 inhibitor 对雪旺细胞迁移的调控。
2.11 挽救实验中各组Ngf、Laminin mRNA相对表达量比较
挽救实验中各组Ngf、Laminin mRNA 相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05),miR-155 inhibitor 组较inhibitor NC 组高,miR-155 inhibitor+si-Nrf2 组较miR-155 inhibitor+si-NC 组低。表明si-Nrf2 可部分逆转miR-155 inhibitor对Ngf、Laminin mRNA 相对表达量的调控。见表6。
表6 挽救实验中各组Ngf、Laminin mRNA相对表达量比较()
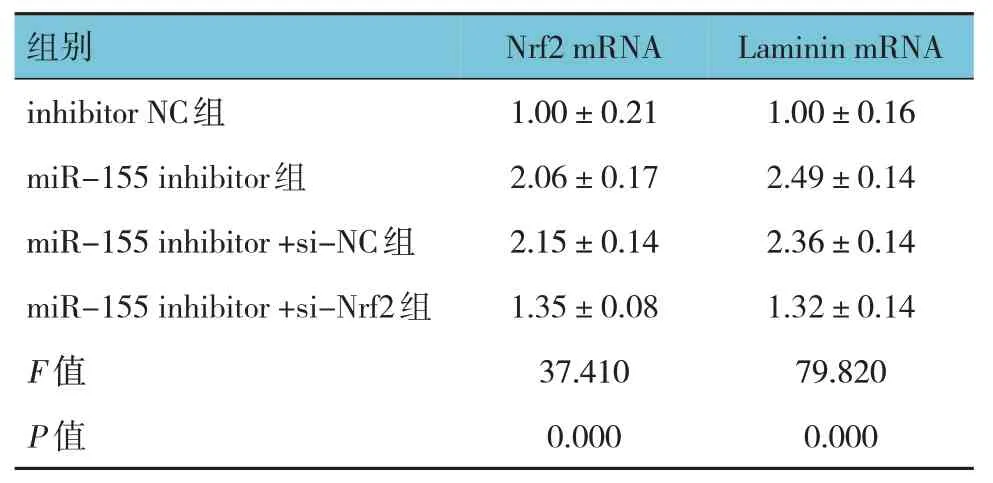
表6 挽救实验中各组Ngf、Laminin mRNA相对表达量比较()
3 讨论
近年来,miRNAs 的研究引起了人们的关注,旨在为神经再生提供更深入的机制研究和可靠的生物靶点。越来越多的研究发现,miRNAs 在神经发育和神经再生过程中调节各种复杂的细胞行为和生物活性[11-12]。有证据显示,抑制miR-155 可以减轻糖尿病周围神经病变的坐骨神经损伤,突显了作为神经损伤治疗靶点的潜力[13]。这也提示,miR-155可能参与了周围神经再生和修复的过程。
雪旺细胞是外周神经系统中独特的胶质细胞,其主要参与建立周围神经再生的有利微环境。周围神经损伤后,雪旺细胞发生如去分化、增殖、迁移和髓鞘形成等一系列表型的改变[14-16]。在这些表型中,增殖和迁移能力对雪旺细胞的自发再生和神经损伤部位的修复具有重要意义[17]。雪旺细胞在周围神经损伤后期能沿受损轴突迁移,促进轴突长距离再生[18]。因此,增加雪旺细胞数量和提升雪旺细胞迁移能力是损伤治疗的主要任务。近年来的研究表明,MiR-3099 促进雪旺细胞增殖和迁移[19];miR-148b 通过调控其靶基因的表达影响雪旺细胞的增殖与迁移能力[20]。尽管已有研究初探了miR-155 在神经损伤中的作用,但miR-155 是否是雪旺细胞增殖和迁移的关键分子尚不清楚。本研究首次证实了miR-155 对雪旺细胞增殖和迁移调控作用,抑制miR-155 的表达可促进雪旺细胞增殖、迁移。
Ngf 是神经细胞生长、维持和存活的重要蛋白质,也是神经元存活途径中的关键信号分子[21]。层黏连蛋白Laminin 是基底层的重要组成部分,支持细胞的分化、迁移、黏附、表型和存活。实验发现,雪旺细胞转染miR-155 inhibitor 后Ngf 和Laminin 表达水平显著升高,而转染miR-155 mimics 的细胞Ngf 和Laminin 表达水平显著降低。这些证据表明,miR-155 调控雪旺细胞增殖可能是通过影响Ngf 和Laminin 表达介导的。
已有文献报道,在损伤的周围神经中Nrf2 通路失活,且过表达Nrf2 能够促进周围神经损伤后雪旺细胞介导的功能修复[22-23]。也有文献报道,Nrf2 参与调控细胞的增殖和迁移[24]。在本研究中,miR-155过表达明显抑制Nrf2 的表达,而抑制miR-155 显著促进Nrf2 的表达,且沉默Nrf2 能部分逆转miR-155 inhibitor 对雪旺细胞增殖和迁移的调控作用。这些结果提示,miR-155 靶向调控Nrf2 通路的活化,影响雪旺细胞功能。
综上所述,抑制miR-155 可能通过激活Nrf2 通路,上调Ngf、Laminin 的表达,促进雪旺细胞的增殖和迁移。本研究将有助于加深对非编码RNA 在周围神经修复和再生中的生物学功能的理解,并为坐骨神经慢性卡压损伤等临床诊断和治疗策略提供科学依据。

