老年营养风险指数联合血浆纤维蛋白原与白蛋白比值对放化疗老年直肠癌患者的预后价值*
张世瑶,陈培培,李莉,顾亚静,毛睿
(新疆医科大学第一附属医院 1.临床营养科,2.肿瘤中心,新疆 乌鲁木齐 830011)
结直肠癌是我国常见的恶性肿瘤,2020 全球癌症统计报告显示,我国结直肠癌发病率和病死率居所有恶性肿瘤第2 位和第5 位,新发和病死病例分别有55.5 万例和28.6 万例[1]。新辅助或辅助放化疗是治疗直肠癌的标准方式,但不同肿瘤分期、耐受度和肿瘤复发转移风险患者的远期生存率也存在差异[2]。研究表明,40%~80%的恶性肿瘤患者存在营养问题,20%的结直肠癌患者会出现营养不良,是导致结直肠癌患者辅助治疗效果降低和病死率上升的重要原因[3-4]。老年营养风险指数(geriatric nutritional risk index,GNRI)是BOUILLANNE 等[5]编制的一种老年患者营养评估工具,目前已被广泛应用于老年心血管疾病、血液透析和重症患者营养评估。近期研究表明GNRI 可预测老年患者食管癌、鼻咽癌等恶性肿瘤根治术或放化疗预后[6-9]。凝血异常和炎症反应与肿瘤发生、发展密切相关[10]。血浆纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,F/A)能同时反映凝血、炎症和营养状况[11]。本研究回顾性分析2015 年1 月—2017 年1 月新疆医科大学第一附属医院收治的150 例行放化疗的直肠癌患者临床资料,探讨GNRI 联合F/A 对放化疗老年直肠癌患者预后的价值。
1 资料与方法
1.1 一般资料
选取2015 年1 月—2017 年1 月新疆医科大学第一附属医院收治的150 例行放化疗的老年直肠癌患者。其中男性91 例,女性59 例;年龄60~82 岁,平均(68.14±5.05)岁;体质量指数(body mass index,BMI)17~30 kg/m2,平均(22.41±2.55)kg/m2;肿瘤部位:低位直肠癌77 例、中高位直肠癌73 例;放化疗方式:新辅助放化疗65 例、辅助放化疗85 例;肿瘤直径:≥ 5 cm 76 例、<5 cm 74 例;肿瘤距肛缘距离:≥ 5 cm 75例、<5 cm 75例;癌胚抗原:≥15 ng/mL 101 例、<15 ng/mL 49 例;分化程度:低分化32 例、中高分化118例;TNM分期[12]:Ⅱ期47例、Ⅲ期72例、Ⅳ期31 例;有淋巴结转移91 例,无淋巴结转移59 例。纳入标准:①年龄>60 岁,且经活检证实为直肠癌;②参照《中国结直肠癌诊疗规范(2015 年版)》[2]行放化疗治疗;③可规律随访,生存信息无缺失。排除标准:①合并其他肿瘤;②合并其他致死性疾病,预期生存低于3 个月;③既往有放化疗史;④近期输血、大量失血;⑤合并血液系统疾病;⑥近期有使用免疫抑制剂、抗凝药物。本研究经医院伦理委员会批准。
1.2 方法
1.2.1 病理资料收集 收集患者性别、年龄、BMI、既往史、肿瘤部位、放化疗方式[包括新辅助放化疗(术前放化疗)和辅助放化疗(术后放化疗)]、放疗剂量、肿瘤直径、肿瘤距肛缘距离、分化程度、TNM 分期、淋巴结转移等资料。
1.2.2 生化指标检测 采集患者放化疗前静脉血5 mL 装入EDTA 管,以1 500 r/min 离心6 min,提取血浆,化学发光法检测癌胚抗原水平,乳胶增强免疫比浊法检测纤维蛋白原(Fibrinogen,Fib)水平,溴甲酚绿法检测白蛋白(Albumin,Alb)水平,计算血浆纤维蛋白原与白细胞比值(F/A)=Fib(g/L)/Alb(g/L)。
1.2.3 GNRI 计算 患者放化疗前计算GNRI,GNRI=1.489×Alb(g/L)+41.7×(实际体重/理想体重),男性理想体重(kg)=身高(cm)-100-{ [身高(cm)-150]/ 4};女性理想体重(kg)=身高(cm)-100-{ [身高(cm)-150]/ 2.5}。当患者实际体重低于理想体重时使用两者比值结果,当患者实际体重大于理想体重时取值1,GNRI 越低表示营养不良风险越高。
1.3 随访
放化疗后通过门诊或电话随访5 年,前2 年每3 个月随访1 次,后3 年每6 个月随访1 次,统计患者生存情况。
1.4 统计学方法
数据分析采用SPSS 28.0 统计软件。计数资料以构成比或率(%)表示,比较用χ2检验;计量资料以均数±标准差()表示,比较用t检验;Kaplan-Meier 法绘制生存曲线,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线;影响因素的分析用一般多因素Cox 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 不同GNRI和血浆F/A的直肠癌患者总生存率比较
150 例直肠癌患者放化疗后随访6~60 个月,中位随访45 个月,死亡56 例,5 年总生存率为62.67%(94/150)。150 例直肠癌患者放化疗前GNRI 中位数为96.38(92.46,98.95),血浆F/A 中位数为0.12(0.10,0.14),根据GNRI 和F/A 中位数将150 例直肠癌患者分为高GNRI 组(≥ 96.38)、低GNRI 组(<96.38)和高F/A 组(≥ 0.12)和低F/A 组(<0.12)分别有75 例、75 例和86 例和64 例。Kaplan-Meier 生存曲线显示,高GNRI 组5 年总生存率为72.00%,低GNRI 组为53.33%,经χ2检验,差异有统计学意义(χ2=8.536,P=0.003),高GNRI 组高于低GNRI 组。高F/A 组5 年总生存率为53.49%,低GNRI 组为75.00%,经χ2检验,差异有统计学意义(χ2=11.360,P=0.001),高F/A 组低于低GNRI 组。见图1。

图1 不同GNRI和血浆F/A患者Kaplan-Meier生存曲线
2.2 死亡组与对照组患者临床资料比较
根据患者存活状况分为死亡组和存活组,分别有56 例和94 例。两组BMI、糖尿病史、肿瘤部位、放化疗方式、TNM 分期、淋巴结转移、Fib、Alb、GNRI、F/A 比较,差异有统计学意义(P<0.05),死亡组BMI、Alb 和GNRI ≥ 96.38 比例低于存活组,糖尿病史、低位直肠癌、TNM 分期Ⅲ、Ⅳ期、有淋巴结转移、Fib、F/A ≥ 0.12 高于存活组。两组患者性别、年龄比较,差异无统计学意义(P>0.05)。见表1。
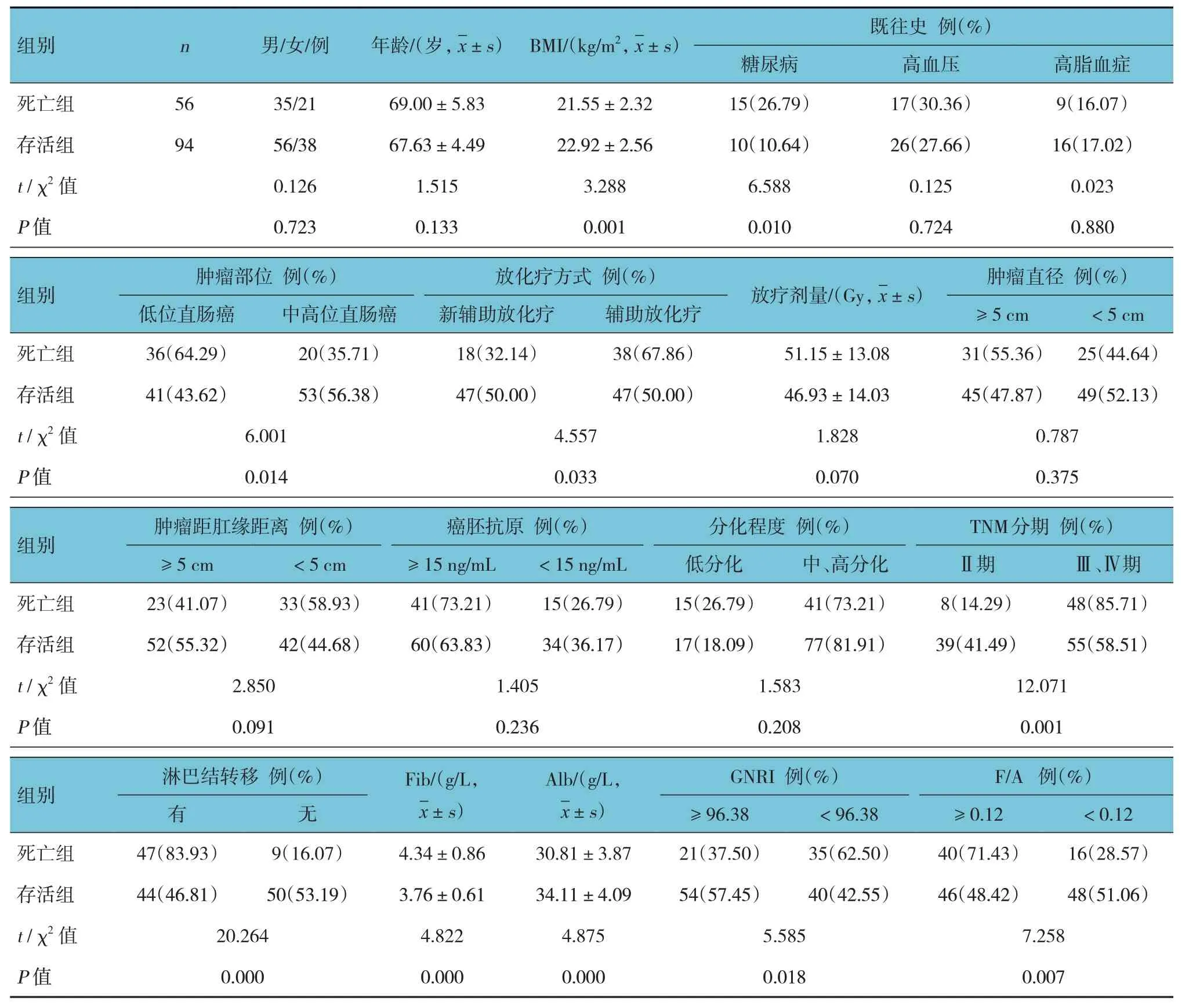
表1 死亡组与存活组患者临床资料比较
2.3 影响放化疗老年直肠癌患者预后的一般多因素Cox回归分析
以随访时间为时间变量,BMI(赋值为实测值)、糖尿病(有=1,无=0)、肿瘤部位(低位直肠癌=1,中高位直肠癌=0)、放化疗方式(辅助放化疗=1,新辅助放化疗=0)、TNM 分期(Ⅲ、Ⅳ期=1,Ⅱ期=0)、淋巴结转移(有=1,无=0)、Fib(赋值为实测值)、Alb(赋值为实测值)、GNRI(≥ 96.38=1,<96.38=0)、F/A(≥ 0.12=1,<0.12=0)为自变量,存活状况(死亡=1,存活/删失=0)为因变量,建立多因素Cox 一般回归模型(引入水准为0.05)。结果显示:TNM 分期Ⅲ、Ⅳ期[H^R=1.909(95% CI:1.085,3.358)]、淋巴结转移[H^R=2.535(95% CI:1.218,5.278)]、F/A≥0.12 [H^R=1.484(95% CI:1.021,2.156)]是放化疗老年直肠癌患者预后危险因素(P<0.05),GNRI ≥ 96.38 [H^R=0.918(95% CI:0.857,0.983)]是放化疗老年直肠癌患者预后保护因素(P<0.05)。见表2。

表2 影响放化疗老年直肠癌患者预后的一般多因素Cox回归分析参数
2.4 GNRI、F/A 单独及联合预测放化疗老年直肠癌患者预后不良的效能
ROC 曲线分析结果显示,GNRI 预测放化疗老年直肠癌患者预后不良的截断值为95.41,敏感性为67.86%(95% CI:0.583,0.746),特异性为72.34%(95% CI:0.659,0.857);F/A 最佳临界值为0.12,敏感性 为78.57%(95% CI:0.688,0.872),特异性为78.72%(95% CI:0.664,0.895);两者联合预测的敏感性 为87.50%(95% CI:0.766,0.924),特异性为75.53%(95% CI:0.623,0.851)。见表3 和图2。

表3 GNRI和血浆F/A单独及联合预测放化疗老年直肠癌患者预后不良的诊断效能参数
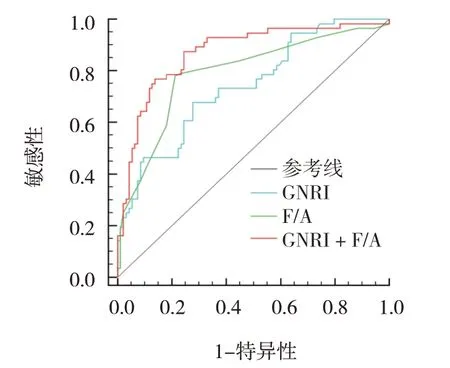
图2 GNRI、血浆F/A单独及联合预测放化疗老年直肠癌患者预后不良的ROC曲线
3 讨论
直肠癌是起源于直肠黏膜上皮的一种常见的消化系统恶性肿瘤,发病可能与血吸虫病、克罗恩病、结直肠息肉、溃疡性结肠炎等有关,早期常无明显症状,以致于大多患者确诊时处于进展期。随着近年来全直肠系膜切除技术和术前新放化疗的推广,直肠癌患者5 年生存率明显提升,但直肠癌仍然是我国死亡率最高的恶性肿瘤之一,疾病负担十分沉重[1]。放化疗作为直肠癌手术前后的辅助治疗手段,适宜不能进行手术或手术无法切除的微小病灶,对预防癌症复发和转移具有重要作用,放化疗前早期筛查预后较差群体,可选择合适的个体化治疗方案,最大程度地提高临床疗效,为患者带来最大生存收益。目前临床主要依靠临床分期评估直肠癌患者放化疗前状况和预后,但仅纳入肿瘤本身的生物特性,只能反映肿瘤负荷状态,忽略了患者自身状况对预后的影响。
直肠癌常引起以体重下降为主要表现的营养不良,与直肠癌影响消化道功能和肿瘤状态下营养需求量增加、代谢水平高、营养物质吸收不良等有关,可导致患者免疫力降低、体重减轻、骨骼肌含量减少和功能减退,进一步引起癌性恶液质,严重影响手术和放化疗等多学科治疗效果,导致患者预后不良,因此指南也建议将营养治疗贯穿于直肠癌患者整个治疗过程[4,13]。近年多项研究指出,GNRI 适用于多种多个年龄段患者的营养评估,并与患者预后相关。一项关于老年冠状动脉疾病患者的Meta分析报道,基线GNRI 降低与老年冠状动脉疾病患者全因死亡和心血管事件风险较高有关[14]。1 项关于癌症患者的Meta 分析报道,基线GNRI 降低与癌症患者术后并发症风险增加和生存期缩短有关[15]。本研究结果显示,高GNRI 组5 年总生存率明显提升,说明GNRI 与放化疗老年直肠癌患者预后密切相关,这与LIAO 等[16]报道低GNRI 老年直肠癌患者总生存率和无病生存率降低结果相符。进一步分析表明,GNRI 是放化疗老年直肠癌患者预后的独立影响因子,可能与营养不良会降低患者免疫功能和肿瘤细胞对放化疗的敏感性,降低患者放化疗耐受性,增加放化疗后不良反应发生率,影响远期疗效有关。同时营养不良作为一种慢性炎症反应,能影响蛋白质、碳水化合物和脂类代谢,导致肌肉蛋白质丢失,引起癌症恶病质,降低患者预后[17]。但本研究ROC 曲线分析结果显示,GNRI 预测放化疗老年直肠癌患者预后不良的AUC 仅0.741,考虑与本研究时间较长和血浆Alb 易受炎症影响有关。同时肌肉减少是肿瘤患者放化疗耐受性差和营养不良的重要体现,体重并不能很好地反映肿瘤患者身体组分和肌肉变化,事实上41%的肿瘤患者体重减轻5%时,肌肉组织损耗已超过5%[17]。本研究中虽然死亡组BMI 明显降低,但并不能独立影响放化疗老年直肠癌患者预后,可能也与此有关。
Fib 是肝脏合成的一种具有凝血功能的蛋白质,在凝血最后阶段能转变为不溶性纤维蛋白使血液凝固。研究证实,Fib 能通过调节肿瘤细胞的增殖、侵袭和迁移,或调节免疫细胞在肿瘤微环境中的功能,促进肿瘤发生、发展[18]。实验表明,Fib 能通过激活局部黏着斑激酶促进直肠癌增殖[19]。此外研究报道,Fib 可作为结直肠癌的辅助诊断指标,但对预后评估较差[20]。Alb 是肝脏合成的一种蛋白质,具有维持渗透压和营养的作用,因此常被作为反映机体营养状态指标。营养不良患者常伴有免疫功能降低,低免疫应答能通过炎症和增加感染风险等途径促进肿瘤发展[21]。Alb 还是一种负性急相反应蛋白,不仅能反映机体营养状态,还具有抗炎作用,能通过增强机体免疫应答发挥抗肿瘤作用[22]。有学者研究报道,低Alb 结直肠癌患者体力活动能力更低,术后住院时间更长[23]。本研究中Alb 与Fib 并不能独立影响放化疗老年直肠癌患者预后,可能与Alb易受炎症影响和Fib 易受基础疾病、体重、血压等因素影响有关。本研究结果显示,高F/A 组5 年总生存率明显降低,说明F/A 与放化疗老年直肠癌患者预后密切相关,这与张磊等[24]报道结果相符。进一步分析表明,F/A 是放化疗老年直肠癌患者预后的独立影响因子,原因是F/A 综合了Fib 和Alb 对患者的影响,弥补了两者不足之处,能很好地反映凝血、炎症和营养状况。血栓栓塞是肿瘤患者放化疗后最常见的并发症之一,也是导致患者死亡的主要原因,Fib 作为一种促凝血因子,能通过促进直肠癌患者静脉血栓形成影响预后[25]。Alb 作为一种非特异性宿主防御物质,具有抗炎作用,低水平Alb 反映直肠癌患者机体炎症反应严重,炎症能影响营养供给、消耗和吸收导致营养不良,影响患者预后[26]。本研究ROC 曲线结果分析显示,F/A 预测放化疗老年直肠癌患者预后不良的AUC 为0.789,说明F/A 也可能成为患者预后不良的辅助预测指标,同时GNRI和血浆F/A 联合预测放化疗老年直肠癌患者预后不良的AUC 为0.870,较GNRI 和血浆F/A 单独预测显著增加,说明GNRI 联合血浆F/A 对放化疗老年直肠癌患者预后具有良好预测作用。
综上所述,GNRI 降低和血浆F/A 升高与老年直肠癌患者预后不良有关,GNRI 联合血浆F/A 预测放化疗老年直肠癌患者预后更佳。但本研究样本量较少,还需前瞻性、多中心研究进一步证实。

