甲基化芯片技术检测粪便DNA甲基化在海南地区少数民族人群大肠癌筛查中的应用*
刘倩,王振奋,黄平
(海南省人民医院 1.胃肠外二科 2.肛肠外科,海南 海口 570311)
大肠癌包括直肠癌、结肠癌,早期无特异性症状,>60%大肠癌确诊时已处于中晚期[1]。因此,早筛查、早诊断是抑制大肠癌病情进展、减少不良预后的关键。目前,临床针对大肠癌的早期诊断技术包括肠镜检查、大便隐血试验、基因突变检测等,虽可一定程度上提升大肠癌的早期检出率,但仍存在一定不足,如肠镜检查属于侵入性操作、大便隐血试验特异性低、基因突变的位点不固定等[2-4]。DNA甲基化是表观遗传学中常见的调节基因表达方式,在胚胎发育、遗传印记与维持正常细胞功能等方面发挥关键作用[5]。SIDRANSKY 等[6]于1992 年在结直肠癌患者粪便中检测到突变的KRAS基因,首次证实粪便DNA 甲基化检测方法的可行性。随后不断有研究报道,粪便中基因异常甲基化可有效检出大肠癌,但理想生物标记物的确定尚存在一定争议[7]。国内有研究发现,少数民族比汉族更易患大息肉(直径>9 mm)且更易癌变,少数民族结直肠癌的恶性程度比汉族更高、预后更差,发病年龄比汉族早[8]。海南省位于中国最南端,是1 个由汉族、黎族、苗族、回族等37 个民族组成的省份,少数民族人口约164.42 万,占全省总人口的18.11%(居全国前10位)。少数民族生活方式、生活环境与风俗习惯与其他地区存在很大差异,但目前关于海南地区少数民族大肠癌的筛查与流行病学数据稀缺。本研究通过VAV3、IKZF1、RIMS1基因分析甲基化芯片技术检测粪便DNA 甲基化在海南地区少数民族人群大肠癌筛查中的应用价值,旨在为大肠癌的无创筛查提供依据。
1 资料与方法
1.1 一般资料
选取2020 年6 月—2022 年6 月海南省人民医院就诊的大肠癌高危少数民族人群102 例。其中男性56例,女性46例;年龄43~77岁,平均(59.63±5.82)岁;体质量指数19.62~29.59 kg/m2,平均(23.57±2.75)kg/m2;黎族39 例,苗族30 例,回族25 例,其他8 例。纳入标准:①海南地区少数民族人群;②年龄30~80 岁;③符合《中国早期结直肠癌及癌前病变筛查与诊治共识》[9]得大肠癌高危人群标准;④大便潜血阳性或大肠癌危险因素调查问卷阳性;⑤收集粪便前1 周内肠道未接受灌肠、结肠镜检查等侵入性操作;⑥未接受任何抗肿瘤治疗;⑦自愿签署知情同意书。排除标准:①因直肠畸形、肛门畸形或高度狭窄而致结肠镜无法插入;②伴有严重下消化道梗阻、切口疝、腹部疝气或可疑结肠穿孔;③肝功能急性衰竭或慢性衰竭;④肠镜检查禁忌证;⑤精神障碍、认知障碍等。另选取同期本院招募30 例健康志愿者作为对照组,肠镜下所见结直肠黏膜无明显病变。对照组中男性17 例,女性13 例;年龄41~80 岁,平均(60.02±4.96)岁;体质量指数18.86~28.42 kg/m2,平均(22.68±2.43)kg/m2;黎族12 例,苗族8 例,回族7 例,其他3 例。两组一般资料比较,差异无统计学意义(P>0.05),可对比。
1.2 方法
1.2.1 粪便标本采集、保存 首先给予受试者大便潜血定量检测专用采便管及“长安心”特定试剂盒(广州市康立明生物科技有限责任公司),研究人员严格按照产品说明书对受试者进行培训。每个受检者按要求取5~10 g 粪便并置于“长安心”粪便保护液中常温保存,标本随机编号,并进行肠镜检查,粪便标本采集、肠镜检查及组织病理检查,操作标准按照《中国消化内镜活组织检查与病理学检查规范专家共识(草案)》[10]进行。
1.2.2 甲基化芯片技术检测粪便DNA甲基化 ①甲基化芯片设计。通过查阅以往文献,发现VAV3、SDC2、ITGA4、RIMS1、NDRG4、WIF-1、HPP1、IKZF1、TFPI2等基因启动子甲基化在检测大肠癌中均表现出较高的阳性率[11-14],并筛选出VAV3、RIMS1、IKZF1基因,针对其高甲基化位点设计探针,制作甲基化芯片。②检验芯片工作状态。根据亚硫酸氢盐修饰试剂盒(广州市康立明生物科技有限责任公司)说明书进行甲基化修饰,修饰时间为3.5 h 左右,修饰后测序验证芯片检测甲基化的敏感性,评估芯片工作状态。③提取DNA。取200 mg 左右粪便,按照粪便DNA 提取试剂盒(广州市康立明生物科技有限责任公司)说明书提取DNA,用Nano-300 微量分光光度计(广州市康立明生物科技有限责任公司)测定DNA 浓度。将DNA 保存在AE 缓冲液(200 μL)中,并置于-20℃冰箱中保存待测。④重亚硫酸氢盐钠转化DNA。⑤荧光标记、Linker-PCR 扩增靶基因。⑥扩增靶序列与芯片杂交。⑦检测杂交结果,评估甲基化状态。
1.2.3 肠镜检查 粪便DNA 甲基化筛查后2 周内接受肠镜检查,由经验丰富的肠胃科医师按照《中国消化内镜活组织检查与病理学检查规范专家共识(草案)》[10]执行肠镜检查,要求肠镜进入深度达回盲部,并观察大肠癌/腺瘤/增生性息肉、腺瘤与病灶的大小、位置等。对所有可见病变进行活检,留取标本送至病理科制作切片,进一步明确诊断。
1.3 观察指标
①粪便DNA 中VAV3、RIMS1、IKZF1基因甲基化状态;②粪便DNA 中VAV3、RIMS1、IKZF1基因单独及联合检测甲基化率,评估大肠癌、腺瘤的诊断效能。计算公式:敏感性=a/(a+c)、特异性=d/(b+d)、准确率=(a+d)/a+c+b+d、阳性预测值=a/(a+b)、阴性预测值=d/(c+d)。见表1。
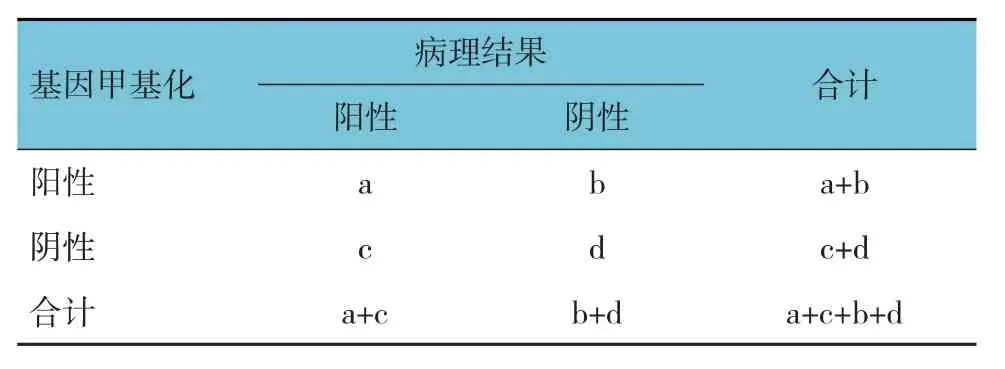
表1 诊断效能评估
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计数资料以率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 肠镜病理结果
肠镜病理结果显示,102 例患者中大肠癌52 例,腺瘤28 例,增生性息肉22 例,并分别作为大肠癌组、腺瘤组和增生性息肉组。
2.2 各组粪便DNA 中VAV3、IKZF1、RIMS1 基因单独及联合检测甲基化率比较
各组粪便DNA 中VAV3、IKZF1、RIMS1基因单独及联合检测甲基化率比较,差异有统计学意义(P<0.05),大肠癌组高于腺瘤组、增生性息肉组、对照组。腺瘤组与增生性息肉组VAV3、IKZF1、RIMS1基因单独及联合检测甲基化率比较,差异无统计学意义(P>0.05)。见表2。
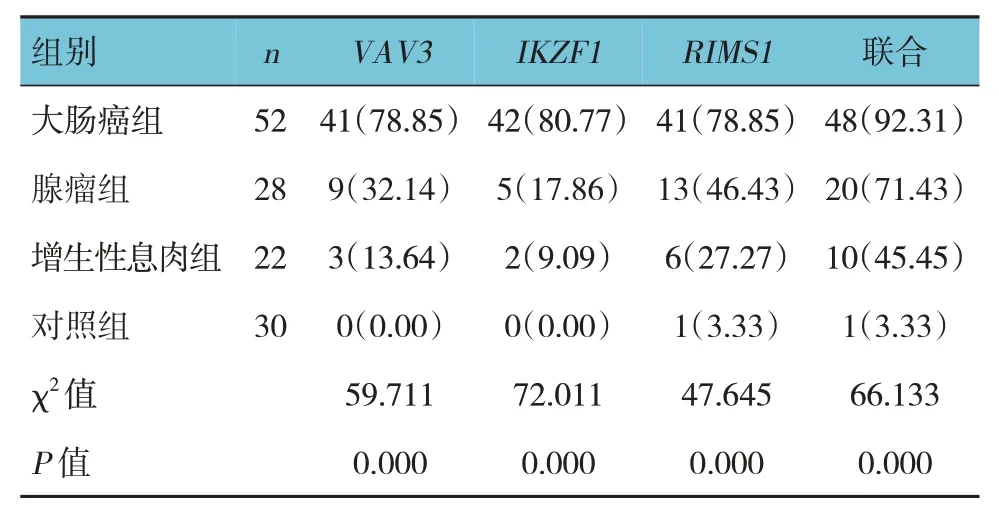
表2 各组粪便DNA中VAV3、IKZF1、RIMS1基因单独及联合检测甲基化率比较 例(%)
2.3 粪便DNA 中VAV3、IKZF1、RIMS1 基因单独及联合检测大肠癌的诊断效能
将肠镜病理结果作为金标准,粪便DNA 中VAV3、IKZF1、RIMS1基因联合检测大肠癌的特异性、敏感性、阴性预测值、阳性预测值、准确率最高,分别为 100.00%、92.31%、92.59%、100.00% 和96.08%。见表3、4。
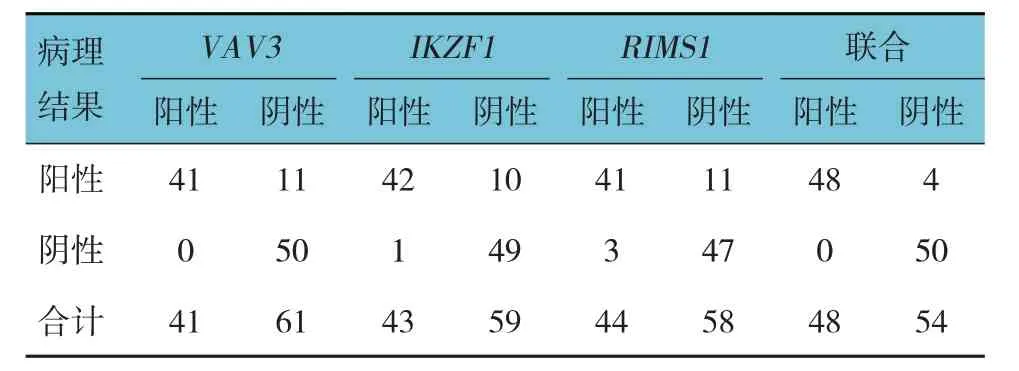
表3 粪便DNA中VAV3、IKZF1、RIMS1基因甲基化单独及联合检测与肠镜病理结果对比 例

表4 粪便DNA中VAV3、IKZF1、RIMS1基因单独及联合检测大肠癌的诊断效能
2.4 粪便DNA 中VAV3、IKZF1、RIMS1 基因单独或联合检测腺瘤的诊断效能
将肠镜病理结果作为金标准,粪便DNA中VAV3、IKZF1、RIMS1基因联合检测腺瘤的特异性、敏感性、阴性预测值、阳性预测值、准确率最高,分别为97.30%、71.43%、90.00%、90.91%和90.20%。见表5、6。
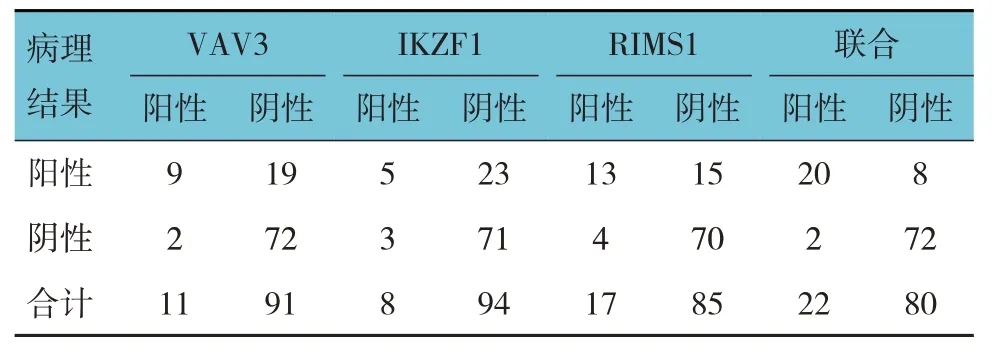
表5 粪便DNA中VAV3、IKZF1、RIMS1基因单独及联合检测甲基化与肠镜病理结果对比 例
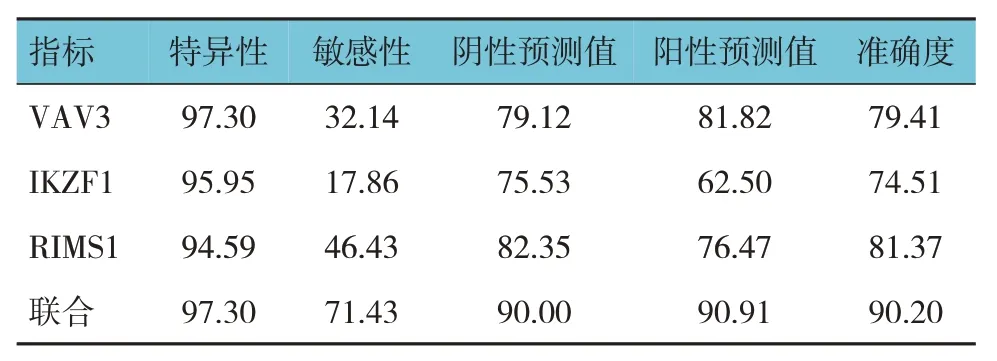
表6 粪便DNA中VAV3、IKZF1、RIMS1基因单独及联合检测腺瘤的诊断效能 %
3 讨论
由于粪便样本的抑制性成分多且成分复杂,甲基化基因片段含量低,甲基化特异性PCR、甲基化测序等传统基因甲基化检测方式可能难以准确定量、定性检测粪便中的甲基化基因[15-17]。DNA 甲基化芯片技术是一种基于二代测序技术的定量定性检测技术,利用双色荧光分别标记扩增产物,再在基因芯片上杂交,最后通过荧光密度比值的高低筛选出差异甲基化基因[18-19]。该技术具有微型性、自动性、高通量性等特点,且可实现对整体甲基化水平的精细研究。KUHMANN 等[20]利用DNA 甲基化芯片技术测定大肠癌患者231 个DNA 修复基因,结果显示,不同人种间大肠癌患者的DNA 甲基化转移酶3A 基因及连接酶4 基因、基质金属蛋白酶9 基因等均出现高甲基化,且连接酶4 基因启动子区的高甲基化达60%的患者比例高达51%。朱慧萍等[21]研究报道,在大肠癌早期筛查中,甲基化芯片技术检测粪便DNA 甲基化的检出率高于大便隐血试验、血清癌胚抗原检测。进一步证实,甲基化芯片技术可提高粪便DNA 甲基化的检出率,其原因可能在于DNA 甲基化芯片技术通过酶切富集启动子与CpG 岛区域,并实施Bisulfite 测序,可提高检测全基因组DNA 甲基化状态的分辨率与测序数据的利用率,因此该技术的DNA 甲基化检出率高于传统的大便隐血试验、甲基化特异性聚合酶链反应法。
通过查阅以往文献,发现VAV3、SDC2、ITGA4、RIMS1、NDRG4、WIF-1、HPP1、IKZF1、TFPI2等基因启动子甲基化在检测大肠癌中均表现出较高的阳性率[11-14],并筛选出VAV3、RIMS1、IKZF1基因纳入本研究。其中VAV3 蛋白具有多个功能域,可参与细胞转化、细胞骨架组织与癌基因等调控过程中。ZHANG 等[22]研究发现,KCNJ12、VAV3-AS1、EVC 联合诊断大肠癌分期的AUC、敏感性、特异性分别为0.87、83.0%和71.2%。IKZF1基因属于锌指DNA 结合蛋白家族,其主要功能在于调节细胞分化。YOUNG 等[23]采用实时荧光聚合酶链反应测定184 例大肠癌与616 例腺瘤患者血浆IKZF1、BCAT1甲基化表达,结果显示,IKZF1联合BCAT1甲基化诊断大肠癌、腺瘤的敏感性分别为71.2%和22.9%。杨葳等[24]研究发现,结直肠癌患者血液中IKZF1单基因甲基化阳性率为46.00%,与IRF4、SEPT9、BCAT1基因联合可有效提升结直肠癌检出率。RIMS1基因属于RAS基因超家族成员之一,该基因突变可造成直肠癌、肺癌等恶性肿瘤细胞增殖、转移。夏晨静[12]研究发现,IKZF1、RIMS1基因启动子甲基化在结直肠癌中具有较高的特异性与阳性率,有助于发现癌前病变。本研究结果显示,52 例大肠癌粪便中VAV3、IKZF1、RIMS1基因甲基化分别检出41 例、42 例和41 例,甲基化率均超过75.00%。28 例腺瘤患者粪便中上述3 个基因启动子DNA 甲基化率分别为32.14%、17.86%、46.43%,对照组中仅检出1 例RIMS1基因甲基化,表明VAV3、IKZF1、RIMS1基因甲基化状态改变与大肠癌发生、发展有关,有望作为大肠癌检测的新型筛查指标。大肠癌的发生、发展属于一种多阶段、多步骤、多基因参与的过程,是由正常结肠黏膜上皮细胞通过表观遗传学、遗传学的异常积累后形成[25-26]。因此,没有一种基因在所有大肠癌癌变过程中是通用的,单个基因检测存在敏感性低等缺点。诸多学者致力于研究粪便多基因联合检测,以寻找1 个检测大肠癌性能理想、消耗低的生物标记组合。本研究结果发现,VAV3、IKZF1、RIMS1基因联合检出大肠癌、腺瘤、增生性息肉的阳性率分别为92.31%、71.43%和45.45%,且诊断大肠癌、腺瘤的敏感性、准确率均较高,但特异性未见明显提高,提示联合检测可提升大肠癌筛查准确率,但可能不是最优的基因组合方式。因此后期需进一步扩大样本量,并筛选不同的基因组合,以保障特异性、敏感性均处于较高水平。
综上所述,甲基化芯片技术提示海南地区少数民族人群大肠癌患者粪便中VAV3、IKZF1、RIMS1基因表现出较高的甲基化水平,且联合检测可提升大肠癌、腺瘤的诊断效能。相信随着基因测序技术尤其是甲基化芯片技术的发展与成本降低,使得大规模测序与检测成为可能。但本研究仍存在一定不足,如本研究属于横断面研究,缺乏时效性验证,结果可能存在一定偏倚;未对比海南地区少数民族人群与汉族人群的大肠癌筛查结果、病理特征;未分析其他基因甲基化的筛查结果等,故后期需将上述不足作为重点,进一步展开研究。

