尼古丁促进高糖高脂诱导的心肌细胞凋亡的机制研究*
赵静,郭蕊,孟芝君,刘彩红,谢耀丽,刘晶,曹济民,王亚静
(1.山西医科大学 基础医学院,山西 太原 030000;2.山西医科大学附属人民医院 检验科,山西 太原 030012;3.山西医科大学第二医院 内分泌科,山西 太原 030001)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者的一种特殊心脏表现,其特征是早期的左心室肥大和舒张功能障碍,晚期出现明显的心力衰竭和收缩功能降低[1]。吸烟是心血管疾病和2 型糖尿病的独立危险因素[2-3]。尼古丁是香烟烟雾的主要成分,是最具药理活性的成分之一[4]。有研究已证明长期暴露于高水平尼古丁是诱发和促发包括心肌病和周围血管疾病在内的心血管疾病的致病因素[5]。目前尼古丁促进DCM 的机制还有待探究。有研究显示,细胞色素酶P4501A1(Cyp1a1)和神经元乙酰胆碱受体β4 亚基(Chrnb4)的表达与突变与吸烟密切相关[6-7],但这2 个基因是否促进DCM进展,目前尚未报道。本研究拟制备高糖/高脂细胞模型(糖尿病模型)进行细胞实验,旨在探讨尼古丁对DCM 的影响及Cyp1a1 和Chrnb4 在其中的作用机制,为吸烟人群中DCM 患者的治疗提供新的思路。
1 材料与方法
1.1 主要材料和仪器
H9C2 细胞(BNCC353655,商城北纳创联生物科技有限公司),DMEM 完全高糖培养基(KGM12800S,江苏凯基生物技术有限公司),胰蛋白酶消化液(T1300,北京索莱宝科技有限公司),1×磷酸盐缓冲液(phosphate buffered saline,PBS)(0.01 moL,pH 7.4)(KGB5001,江苏凯基生物技术有限公司),葡萄糖(G116307,上海阿拉丁生化科技股份有限公司),棕榈酸酯(HY-N2341,美国MCE 公司),尼古丁(54-11-5,成都德思特生物技术有限公司),AMPK 抑制剂(P5499-5MG,美国Sigma-Aldrich 公司),DCFHDA(HY-D0940,美国MedChemExpress 公司),Cyp1a1和Chrnb4 干扰质粒(上海吉凯基因化学技术公司),凋亡试剂盒(AP105-100kit,杭州联科生物技术股份有限公司),Reactive Oxygen Species Assay Kit(KGT010-1100 assays,江苏凯基生物技术股份有限公司),JC-1 线粒体膜电位检测试剂盒(BB-4105,上海贝博生物科技有限公司),丙二醛(Malondialdehyde,MDA)试剂盒(MM-0385R1,武汉酶免生物科技有限公司),超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(MM-0386R1,武汉酶免生物科技有限公司),ChamQ Universal SYBR qPCR Master Mix(Q711-02,南京诺唯赞生物科技股份有限公司),超纯RNA 提取试剂盒(CW0581M)、Trizon Reagent(CW0580S,江苏康为世纪生物科技股份有限公司),HiScript Ⅱ Q RT SuperMix(R223-01)、SYBR qPCR Master Mix(Q711-02,南京诺唯赞生物科技股份有限公司),50×TAE 缓冲液(T1060,北京索莱宝科技有限公司),6×DNA Loading Buffer(GH101-01,北京全式金生物技术股份有限公司),50 bp DNA Ladder[MD108,天根生化科技(北京)有限公 司],Gsafe Red plus 核酸染料(GK20002,美 国GLPBIO 公司),琼脂糖粉(75510-019,美国Invitrogen公司),RIPA 细胞裂解液(C1053,北京普利莱基因技术有限公司),BCA 蛋白定量试剂盒(CW0014S,江苏康为世纪生物科技股份有限公司),GAPDH(TA-09,北京中杉金桥生物技术有限公司,1/2 000),Anti Cyp1a1(DF3565,1/500)、Anti Chrnb4(DF9698,1/500)、Anti p-AMPK(AF3423,1/500)、Anti Casepase-2(DF2908,1/500)、Anti Casepase-3(AF6311,1/500)、Anti Casepase-9(AF6348,美国Affinity 公司,1/500),免疫球蛋白G(H+L)(ZB-2301,北京中杉金桥生物技术有限公司,1/2 000),流式细胞分析仪[NovoCyte 2060R,艾森生物(杭州)有限公司],PCR 仪[CFX Connect™,伯乐生命医学产品(上海)有限公司],蛋白电泳仪(DYY-6C,北京市六一仪器厂),化学发光成像系统[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司]。
1.2 细胞分组
根据不同的方法,将细胞分为对照组、尼古丁组、高糖/高脂模型组、尼古丁+高糖高脂模型组。对照组正常培养,不做处理;尼古丁组在对照组基础上添加6 μmoL/L 尼古丁处理26 h;高糖/高脂模型组在对照组基础上添加33.3 mmoL/L 葡萄糖和500 μmoL/L 棕榈酸酯共同处理24 h;尼古丁+高糖高脂模型组在对照组基础上添加6 μmoL/L 尼古丁处理2 h 后,用33.3 mmoL/L 葡萄糖和500 μmoL/L 棕榈酸酯共同处理24 h[8]。
用Cyp1a1基因验证细胞实验分组,将细胞分为shRNA-NC 组、shRNA-Cyp1a1 组、AMPK 抑制剂组、shRNA-Cyp1a1+AMPK 抑制剂组。shRNA-NC 组采用H9C2 细胞转染shRNA-NC 质粒48 h;shRNA-Cyp1a1组采用H9C2 细胞转染shRNA-Cyp1a1 质粒48 h;AMPK 抑制剂组采用AMPK 抑制剂Dorsomorphin-2HCl 处理H9C2 细胞24 h;shRNA-Cyp1a1+AMPK 抑制剂组采用H9C2 细胞转染shRNA-Cyp1a1 质粒48 h后,添加AMPK 抑制剂Dorsomorphin-2HCl 处理细胞24 h。
用Chrnb4基因验证实验分组,将细胞分为shRNA-NC 组、shRNA-Chrnb4 组、AMPK 抑制剂组、shRNA-Chrnb4+AMPK 抑制剂组。shRNA-NC 组采用H9C2 细胞转染shRNA-NC 质粒48 h;shRNA-Chrnb4组采用H9C2 细胞转染shRNA-Chrnb4 质粒48 h;AMPK 抑制剂组采用AMPK 抑制剂Dorsomorphin-2HCl 处理H9C2 细 胞24 h;shRNA-Chrnb4+AMPK 抑制剂组采用H9C2 细胞转染shRNA-Chrnb4 质粒48 h后,添加AMPK 抑制剂Dorsomorphin-2HCl 处理细胞24 h。
1.3 方法
1.3.1 流式细胞术检测细胞活性氧(ROS)水平 按照1 ∶1 000 用无血清培养基稀释DCFH-DA,使其终浓度为10 μmol/L;收集细胞,加入稀释好的DCFH-DA,37℃培养箱中孵育20 min;无血清的培养液洗涤,去除多余的DCFH-DA;PBS 洗涤,以1 500 r/min 离心5 min,弃上清液;300 μL PBS 重悬细胞,上机,检测细胞ROS 水平。
1.3.2 流式细胞术检测细胞线粒体膜电位 根据JC-1 线粒体膜电位检测试剂盒说明书,配置JC-1 工作液;收集细胞,加入500 μL JC-1 工作液悬浮细胞,培养箱孵育15~20 min;以2 000 r/min 离心5 min,收集细胞,1×Incubation Buffer 洗涤2 次;500 μL 1×Incubation Buffer 悬浮细胞,上机。
1.3.3 ELISA 法检测细胞内SOD 活性和微量MDA含量 根据试剂盒说明书配置好相关工作液,设置空白孔、标准孔和样品孔。标准孔依次加入0.0 u/mL、12.5 u/mL、25.0 u/mL、50.0 u/mL、100.0 u/mL 和200.0 u/mL 浓度的50 μL 标准品,样品孔中加入50 μL 样品混匀,加入100 μL 酶标试剂。封板膜封板,37℃孵育60 min;揭封板膜,洗涤液洗涤,弃去液体,拍干;先后加入显色剂A、B 各50 μL,混匀,37℃,避光显色15 min;加入50 μL 终止液;450 nm波长测定各孔吸光度值。
1.3.4 实时荧光定量聚合酶链反应检测Cyp1a1、Chrnb4 mRNA 相对表达量 提取各组待测细胞内RNA,随后根据对应的逆转录试剂盒说明书合成cDNA,加入反应体系,在PCR 仪上检测。根据2-ΔΔCt法计算相对表达量。引物由通用生物系统(安徽)有限公司合成。引物序列见表1。

表1 引物序列
1.3.5 Western blotting 检测蛋白表达水平 将各组细胞加入裂解液,充分研磨,以12 000 r/min 离心15 min,收集匀浆。取上清液,根据BCA 试剂盒说明书测定蛋白浓度。配置好浓缩胶和分离胶,加入已变性的蛋白样品,电泳,转膜。加入一抗,4℃过夜;加入二抗,室温孵育1~2 h。滴加ECL曝光液曝光。用Image J 软件分析各条带灰度值。
1.3.6 流式细胞术检测细胞凋亡 收集待测细胞,PBS 洗涤2 次,以1 500 r/min 离心3 min;加入预冷的1×Binding Buffer 300 μL,重悬细胞;分别向每管细胞中加入3 μL Annexin V-APC 和5 μL 7-AAD,混匀;室温避光孵育10 min;加入预冷的1×Binding Buffer 200 μL,混匀,上机检测。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差()表示,比较用方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组SOD、MDA、ROS、线粒体膜电位比较
对照组、尼古丁组、高糖/高脂模型组与尼古丁+高糖/高脂模型组SOD 水平比较,经方差分析,差异有统计学意义(P<0.05),尼古丁组、高糖/高脂模型组、尼古丁+高糖/高脂模型组较对照组降低(P<0.05),尼古丁+高糖/高脂模型组较高糖/高脂模型组降低(P<0.05)。各组MDA 水平比较,经方差分析,差异有统计学意义(P<0.05),尼古丁+高糖/高脂模型组较对照组和高糖/高脂模型组升高(P<0.05)。各组ROS 含量比较,经方差分析,差异有统计学意义(P<0.05),高糖/高脂模型组、尼古丁+高糖/高脂模型组较对照组升高(P<0.05),尼古丁+高糖/高脂模型组较高糖/高脂模型组升高(P<0.05)。各组线粒体膜电位的比较,经方差分析,差异有统计学意义(P<0.05),尼古丁组、高糖/高脂模型组、尼古丁+高糖/高脂模型组较对照组降低(P<0.05),尼古丁+高糖/高脂模型组较高糖/高脂模型组降低(P<0.05)。见表1 和图1、2。
表1 各组SOD、MDA、ROS、线粒体膜电位水平比较()
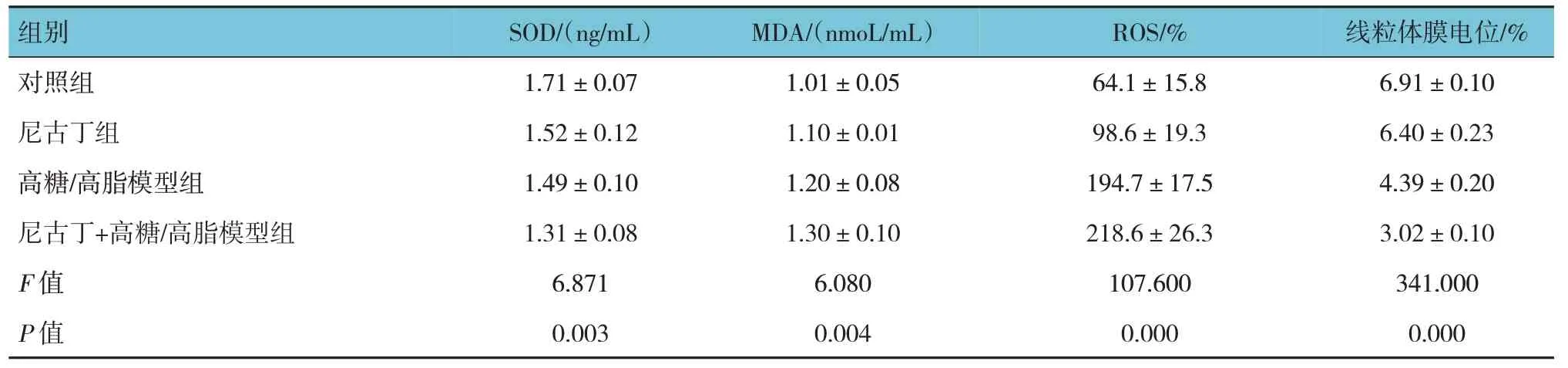
表1 各组SOD、MDA、ROS、线粒体膜电位水平比较()

图1 各组ROS含量比较图

图2 各组H9C2细胞流式细胞图
2.2 尼古丁对高糖/高脂H9C2 细胞内Cyp1a1、Chrnb4 mRNA、蛋白及p-AMPK、Caspase-2凋亡途径相关蛋白表达水平的影响
对照组、尼古丁组、高糖/高脂模型组与尼古丁+高糖/高脂模型组Cyp1a1 和Chrnb4 mRNA 表达比较,经方差分析,差异有统计学意义(P<0.05),尼古丁组、高糖/高脂模型组、尼古丁+高糖/高脂模型组较对照组升高(P<0.05),尼古丁+高糖/高脂模型组较高糖/高脂模型组升高(P<0.05)。各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1、Chrnb4 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),尼古丁组和尼古丁+高糖/高脂模型组Caspase-2、Caspase-3、Caspase-9、Cyp1a1、Chrnb4 蛋白相对表达量较对照组升高(P<0.05),p-AMPK 蛋白相对表达量较对照组降低(P<0.05),高糖/高脂模型组p-AMPK 蛋白相对表达量较对照组降低(P<0.05),Caspase-9、Cyp1a1、Chrnb4 蛋白相对表达量较对照组升高(P<0.05),尼古丁+高糖/高脂模型组Caspase-2、Caspase-3、Caspase-9、Cyp1a1、Chrnb4 蛋白相对表达量较高糖/高脂模型组升高(P<0.05),p-AMPK 蛋白相对表达量较高糖/高脂模型组降低(P<0.05)。见表2、3 和图3。

图3 各组蛋白相对表达量
表2 各组Cyp1a1、Chrnb4 mRNA相对表达量比较()

表2 各组Cyp1a1、Chrnb4 mRNA相对表达量比较()
2.3 各组H9C2 细胞凋亡率和Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1 蛋白相对表达量比较
shRNA-NC 组、shRNA-Cyp1a1 组、AMPK 抑制剂组与shRNA-Cyp1a1+AMPK 抑制剂组H9C2 细胞凋亡率分别为(15.90±1.77)%、(2.38±0.74)%、(35.90±4.16)%、(27.97±2.30)%,经方差分析,差异有统计学意义(F=97.790,P=0.000),shRNA-Cyp1a1 组较shRNA-NC 组降低(P<0.05),AMPK 抑制剂组和shRNA-Cyp1a1+AMPK 抑制剂组较shRNA-NC 组升高(P<0.05),shRNA-Cyp1a1+AMPK 抑制剂组较AMPK抑制剂组降低(P<0.05)。各组Caspase-2、Caspase-3、Caspase-9、p-AMPK 和Cyp1a1 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),shRNA-Cyp1a1 组Caspase-2、Caspase-3、Caspase-9、Cyp1a1 蛋白水平较shRNA-NC 组降低(P<0.05),p-AMPK 蛋白水平较shRNA-NC 组升高(P<0.05),AMPK 抑制剂组Caspase-2、Caspase-3、Caspase-9、Cyp1a1 蛋白水平较shRNA-Cyp1a1+AMPK 抑制剂组升高(P<0.05),p-AMPK 蛋白水平较shRNA-Cyp1a1+AMPK 抑制剂组降低(P<0.05),shRNA-Cyp1a1+AMPK 抑制剂组Cyp1a1 蛋白水平与shRNA-Cyp1a1 组比较无差异(P>0.05)。见表4 和图4、5。
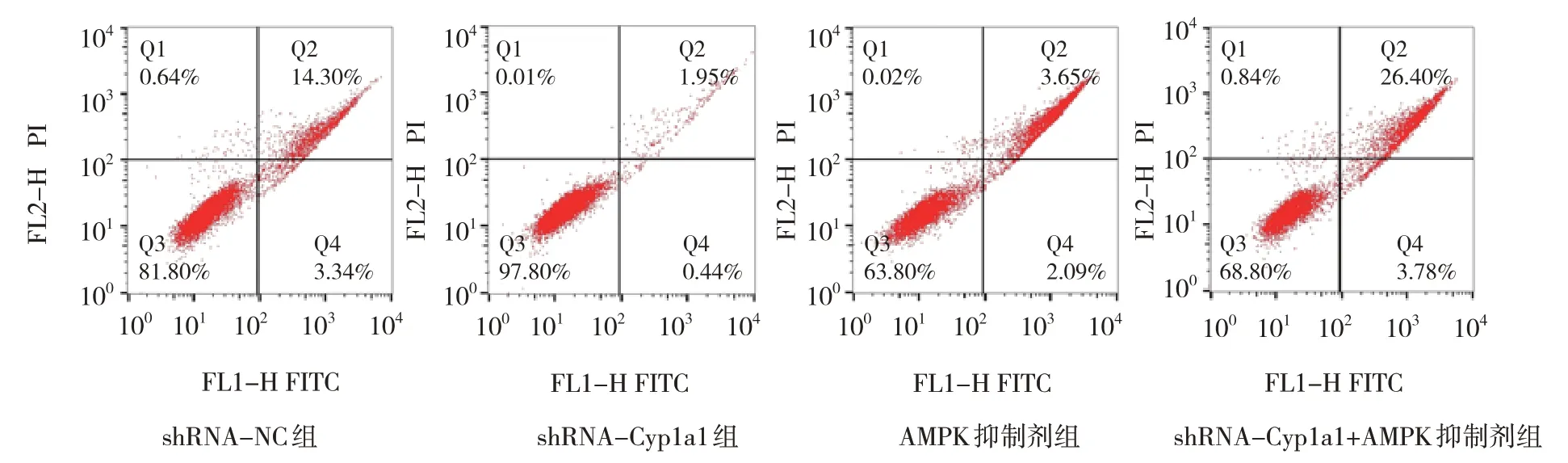
图4 各组H9C2细胞流式细胞术结果
表3 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1、Chrnb4蛋白相对表达量比较()

表3 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1、Chrnb4蛋白相对表达量比较()
表4 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1蛋白相对表达量比较()
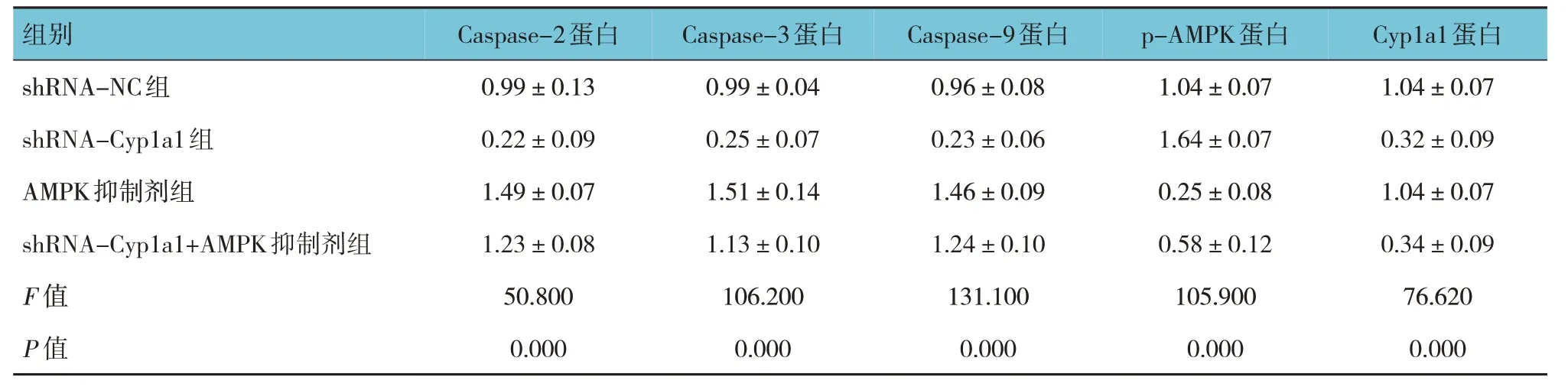
表4 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Cyp1a1蛋白相对表达量比较()
2.4 Chrnb4 对心肌细胞凋亡及Caspase-2 凋亡途径的影响
shRNA-NC 组、shRNA-Chrnb4 组、AMPK 抑 制剂组和shRNA-Chrnb4+AMPK 抑制剂组心肌细胞凋亡率分别为(15.01±2.46)%、(1.89±0.58)%、(37.12±2.85)%、(28.24±3.13)%,经方差分析,差异有统计学意义(F=117.200,P=0.000),shRNA-Chrnb4 组 较 shRNA-NC 组降低(P<0.05),AMPK 抑制剂组和shRNA-Chrnb4+AMPK抑制剂组较对照组增加(P<0.05),shRNAChrnb4+AMPK 抑制剂组较AMPK 抑制剂组降低(P<0.05)。各组Caspase-2、Caspase-3、Caspase-9、p-AMPK 和Chrnb4 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05),shRNAChrnb4 组Caspase-2、Caspase-3、Caspase-9、Chrnb4蛋白相对表达量较shRNA-NC 组降低(P<0.05),p-AMPK 蛋白相对表达量较shRNA-NC 组升高(P<0.05),AMPK 抑制剂组和shRNA-Chrnb4+AMPK 抑制剂组Caspase-2、Caspase-3、Caspase-9 相对表达量较shRNA-NC 组升高,p-AMPK 蛋白相对表达量较shRNA-NC 组降低(P<0.05),shRNAChrnb4+AMPK 抑制剂组Chrnb4 蛋白较shRNA-NC组降低,shRNA-Chrnb4+AMPK 抑制剂组Caspase-2、Caspase-3、Caspase-9、Chrnb4 蛋白相对表达量较AMPK 抑制剂组降低(P<0.05),p-AMPK 蛋白相对表达量较AMPK 抑制剂组升高(P<0.05)。shRNAChrnb4+AMPK 抑制剂组Chrnb4 蛋白相对表达量与shRNA-Chrnb4 组比较无差异(P>0.05)。见表5 和图6、7。
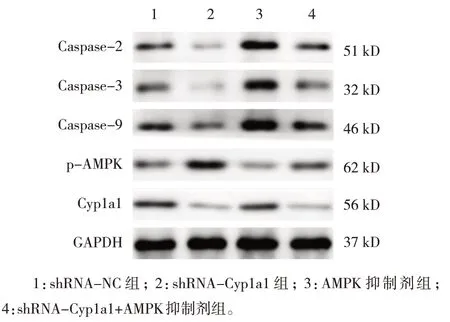
图5 各组蛋白相对表达量
表5 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Chrnb4蛋白相对表达量比较()
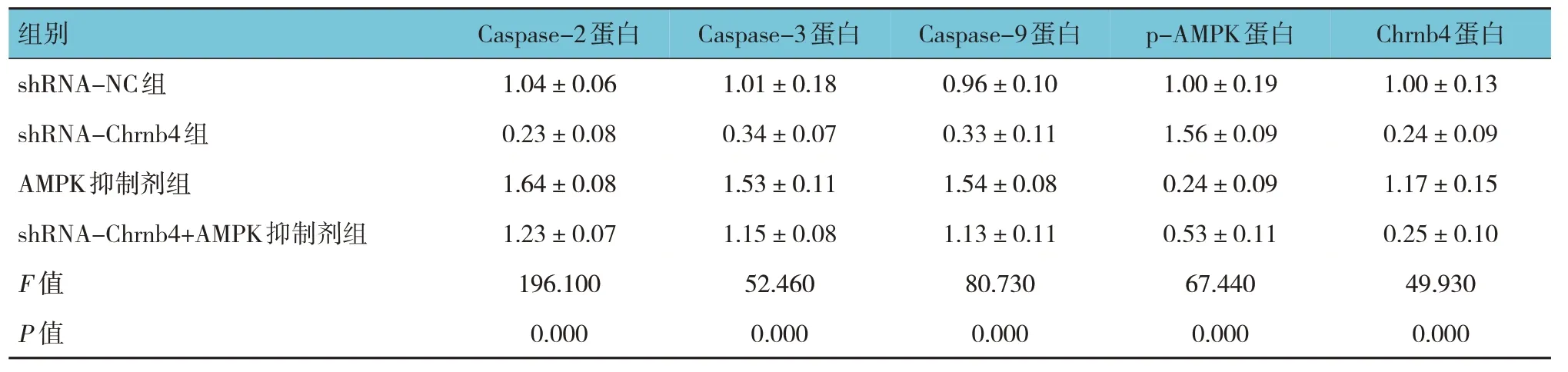
表5 各组Caspase-2、Caspase-3、Caspase-9、p-AMPK、Chrnb4蛋白相对表达量比较()
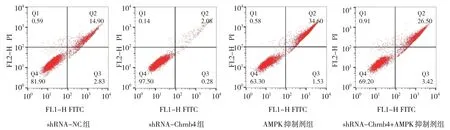
图6 各组H9C2细胞流式细胞术结果
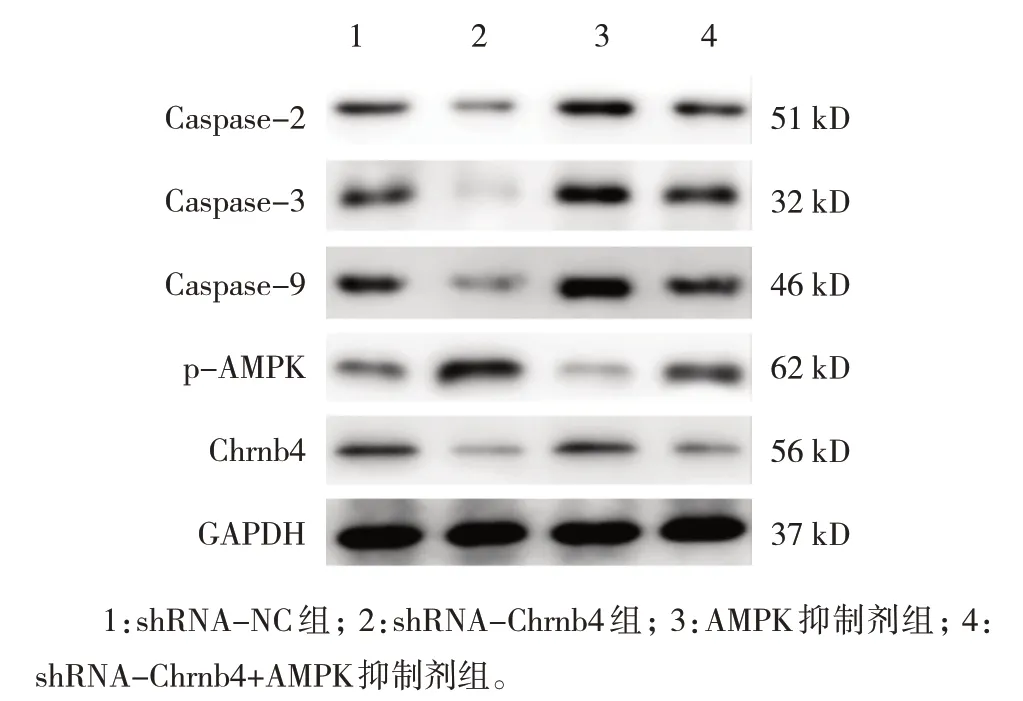
图7 各组蛋白相对表达量
3 讨论
心肌细胞凋亡是DCM 发展机制之一。有研究表明,低凋亡水平心肌细胞可导致致命的扩张型心肌病,抑制心肌细胞凋亡可阻碍该疾病的进展[9]。因此抑制心肌细胞凋亡可能是预防DCM 的新疗法。本研究结果发现,尼古丁诱导且加重高糖高脂心肌细胞凋亡,其机制可能是通过上调Cyp1a1、Chrnb4 表达,抑制AMPK 活性,导致线粒体功能障碍,氧化应激增加,进一步激活Caspase-2 凋亡途径。
ROS 是在心脏生理和病理中具有重要作用的信号分子[10]。在生理条件下,心脏ROS 信号调节心脏发育和心肌细胞成熟、心脏钙处理、兴奋收缩耦合和血管张力;然而,导致ROS 水平升高时产生不受调节的病理状况可通过对DNA、蛋白质和脂质的氧化损伤以及线粒体通透性转换孔的激活、线粒体功能障碍等导致氧化应激[11]。氧化应激与各种细胞类型的凋亡信号有关,包括心肌细胞[12-13]。本研究中发现尼古丁及高糖/高脂均会导致心肌细胞线粒体功能障碍,氧化应激增加,而尼古丁会放大高糖/高脂培养条件下的心肌细胞的线粒体功能障碍和氧化应激效应,与ZHANG 等[14]和RAMALINGAM等[15]的研究结果一致。
AMPK 是一种主要的细胞能量传感器和代谢稳态的主调节器,在调节心肌细胞凋亡中发挥着重要作用[16]。AMPK 与尼古丁的一些作用直接相关[17]。有研究证明敲除Cyp1a1 可抑制细胞增殖,阻断与Cyclin D1 减少相关的Go-G 细胞周期,并增加与AMPK 和Akt 磷酸化减少相关的凋亡[18],与本研究结果一致。这些结果表明Cyp1a1 参与细胞增殖和存活途径,其机制可能与AMPK 通路有关。编码nAChRβ4 亚基的Chrnb4基因广泛存在于气道上皮细胞,并形成异质nAchR 来调节尼古丁受体的亲和力。有研究证明激动剂1,1-二甲基-4-苯基哌嗪碘化选择性靶向α3β4 nAChr,通过增加棕色脂肪、心脏和骨骼肌中的葡萄糖摄取,显著改善了糖耐量[19]。本研究结果发现,Chrnb4 表达与AMPK 活性呈负相关,即干扰Chrnb4 后AMPK 活性上调。故笔者推测,尼古丁上调Cyp1a1、Chrnb4 表达,抑制AMPK 活性,进而导致线粒体功能障碍,氧化应激增加,最终导致心肌细胞凋亡。
本研究结果进一步发现,H9C2 细胞内Caspase-2、Caspase-3、Caspase-9 蛋白水平显著增加,干扰Cyp1a1 或Chrnb4 后,H9C2 细胞内Caspase-2、Caspase-3、Caspase-9 蛋白相对表达量显著下调。越来越多的证据表明,具有半胱氨酸酶招募结构域的凋亡抑制因子是一种内源性蛋白,在心脏组织中高度表达,能够通过靶向多点激活来抑制缺血-再灌注诱导的心肌细胞凋亡[20]。SINHA-HIKIM 等[21]的研究结果显示,Caspase-2 介导的内在通路信号是尼古丁加高脂肪饮食诱导心肌细胞凋亡的机制之一。
综上所述,尼古丁诱导高糖、高脂心肌细胞凋亡率增加,其机制可能是上调Cyp1a1、Chrnb4 表达,抑制AMPK 活性,导致线粒体功能障碍,氧化应激增加,并进一步激活Caspase-2 凋亡途径,上调Caspase-3、Caspase-9 表达诱导细胞凋亡。

