浅析《中国药典》(2020版)中阿奇霉素颗粒标准的变化
崔玉玲,张红梅
济南市食品药品检验检测中心, 济南 250014
阿奇霉素是大环内酯类抗菌药物,可通过抑制细菌的蛋白质合成而达到抗菌作用,其抗菌谱较广,对革兰阳性菌、革兰阴性菌、支原体等都有抗菌活性,适用于敏感菌引起的急性支气管炎、急性细菌性肺炎、支原体肺炎、急性扁桃体炎等[1-2]。阿奇霉素的颗粒制剂因便于分剂量、易服用的优点而广泛用于儿童。《中国药典》(2005版)开始收录阿奇霉素颗粒,经过15年的发展,到《中国药典》(2020版),阿奇霉素颗粒的标准制定得更加规范合理,更加科学严谨,充分保证了其临床使用的安全性和有效性。
本文以实验为基础,结合《中国药典》(2020版)与《中国药典》(2015版)中有关物质项因标准不同出现的结果判定变化,并对新增项目溶出度进行测定,比较不同版本《中国药典》中阿奇霉素颗粒的标准变化。
1 阿奇霉素颗粒标准在历版《中国药典》中的演变[3 -6 ]
阿奇霉素颗粒标准检验项目主要有性状、鉴别、检查及含量测定。其中,反映药品安全性的检查项目包括碱度、水分及颗粒剂项下的粒度、装量差异等,具体变化见表1。

表1 阿奇霉素颗粒在不同版本《中国药典》中的方法和判定标准比较a
2 阿奇霉素颗粒有关物质在不同标准下的结果判定差异[5 -6 ]
2.1 仪器与试剂
LC-20A高效液相色谱仪(日本岛津公司);MS105DU型电子天平(瑞士Mettler Toledo公司);PB-10酸度计(德国赛多利斯公司)。
阿奇霉素对照品(批号:130593-202004,纯度94.3%)、阿奇霉素系统适用性对照品(批号:130609-202008,系统适用性试验用)、阿奇霉素杂质A(批号:130651-202003,鉴别/检查用)、阿奇霉素杂质S(批号:130655-202004,鉴别/检查用)均购自中国食品药品检定研究院;乙腈(色谱纯)、甲醇(色谱纯)、磷酸氢二钾(分析纯)、磷酸二氢铵(分析纯)、磷酸(分析纯)等均购自国药集团化学试剂有限公司;纯化水(山东普利思饮用水股份有限公司)。
5批阿奇霉素颗粒样品分别来自A、B、C、D、E共5家生产企业,批号分别为8D0251F04、1912022、19061301、190604、200102,依次编号为 S1、S2、S3、S4、S5。
2.2 实验方法
2.2.1 色谱条件
按照《中国药典》(2015版、2020版)有关物质测定方法,采用CAPCELL PAK C18MGⅡ色谱柱(4.6mm×250mm,5μm);以磷酸盐缓冲液(取0.05mol/L磷酸氢二钾溶液,用20%磷酸溶液调节pH至8.2)-乙腈(45∶55)为流动相A,以甲醇为流动相B;线性梯度洗脱(0~35min,75%→95%A;35~64min,95%→95%A;64~65min,95%→75%A;65~71min,75%→75%A);柱温为30℃;流速为1.0ml/min,检测波长为210nm;进样体积为50 μ l。
2.2.2 溶液的制备
稀释液:称取磷酸二氢铵1.73g,加水溶解并稀释至1000ml,用氨试液调节pH至(10.0±0.05),得到磷酸二氢铵溶液。按磷酸二氢铵溶液-甲醇-乙腈(7∶7∶6)为比例配制稀释液。
供试品溶液:取阿奇霉素颗粒适量,加稀释液溶解并定量稀释制成每1ml中约含阿奇霉素10mg的溶液,用0.45μm的微孔滤膜滤过,取续滤液。
对照溶液:精密量取供试品溶液1ml,置200ml量瓶中,用稀释液稀释至刻度,摇匀。
杂质S对照品与杂质A对照品溶液:取杂质S对照品与杂质A对照品各适量,加稀释液溶解并稀释制成每1ml中各约含0.05mg的溶液。
系统适用性溶液:取阿奇霉素系统适用性对照品适量,加杂质S对照品与杂质A对照品溶液溶解并稀释制成每1ml中约含10mg的溶液。
灵敏度溶液:精密量取对照溶液10ml,置50ml量瓶中,用稀释液稀释至刻度,摇匀。
2.2.3 限度规定
《中国药典》(2015版)规定限度为:杂质B峰面积不得大于对照溶液主峰面积的4倍(2.0%);杂质H与杂质Q按校正后的峰面积计算(分别乘以校正因子0.1、0.4)不得大于对照溶液主峰面积的2倍(1.0%);其他单个杂质峰面积不得大于对照溶液主峰面积的2倍(1.0%);各杂质峰面积之和按校正后的峰面积计算不得大于对照溶液主峰面积的8倍(4.0%)。
《中国药典》(2020版)规定限度为:杂质B峰面积不得大于对照溶液主峰面积的4倍(2.0%);杂质R、杂质Q、杂质J、杂质I、杂质S、杂质A和杂质H按校正后的峰面积计算(分别乘以校正因子0.5、0.4、0.7、1.6、0.4、1.4、0.1)均不得大于对照溶液主峰面积的2倍(1.0%);其他单个杂质峰面积不得大于对照溶液主峰面积的2倍(1.0%);各杂质峰面积的和按校正后的峰面积计算不得大于对照溶液主峰面积的8倍(4.0%);小于灵敏度溶液主峰面积的峰忽略不计。
2.3 结果
对5批样品同时进行有关物质项检查,通过《中国药典》(2015版、2020版)不同的判定标准,结果变化见表2。
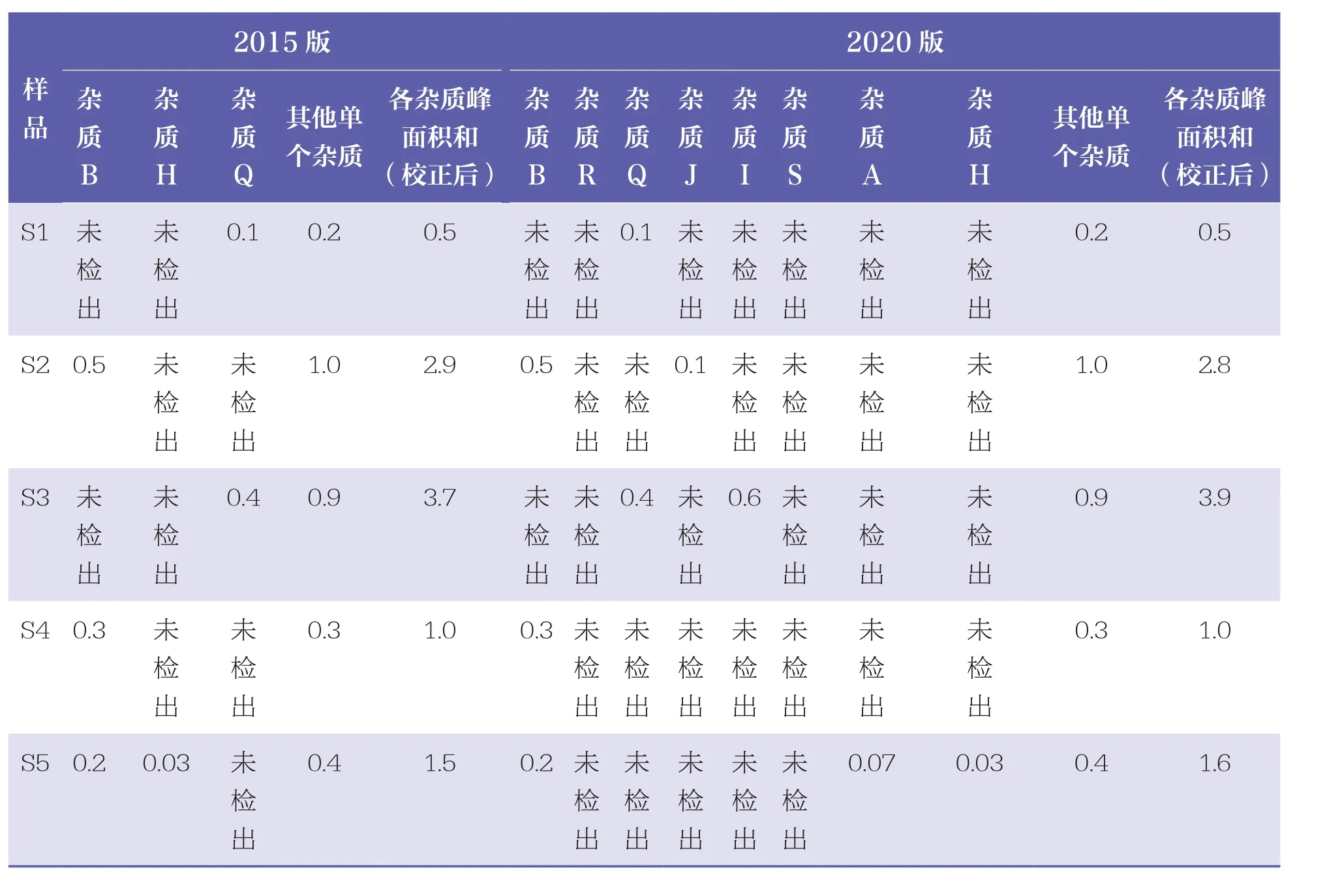
表2 应用不同版本《中国药典》标准比较5批阿奇霉素颗粒有关物质的结果 %
3 溶出度测定[6]
3.1 仪器与试剂
UDT-812溶出度试验仪(美国LOGAN公司);ZKT-18F真空脱气仪(天大天发科技有限公司);高效液相色谱仪、酸度计、电子天平同“2.1”项下。
磷酸氢二钠(分析纯)、盐酸(分析纯)均购自国药集团化学试剂有限公司;其他同“2.1”项下。
样品同“2.1”项下。
3.2 实验方法
按照《中国药典》(2020版)溶出度与释放度测定法(通则0931 第二法)测定5批阿奇霉素颗粒的溶出度。以磷酸盐缓冲液(pH6.0)500ml为溶出介质,转速为50r/min,分别于15、30、45、60min取样进行测定,其中30min时取样用以计算溶出度。每批样品取6袋进行测定。测定方法除进样体积为100μl外,其余条件同“2.2.1”项下。
3.3 结果
3.3.1 溶出度
5批阿奇霉素颗粒的溶出度结果见表3。
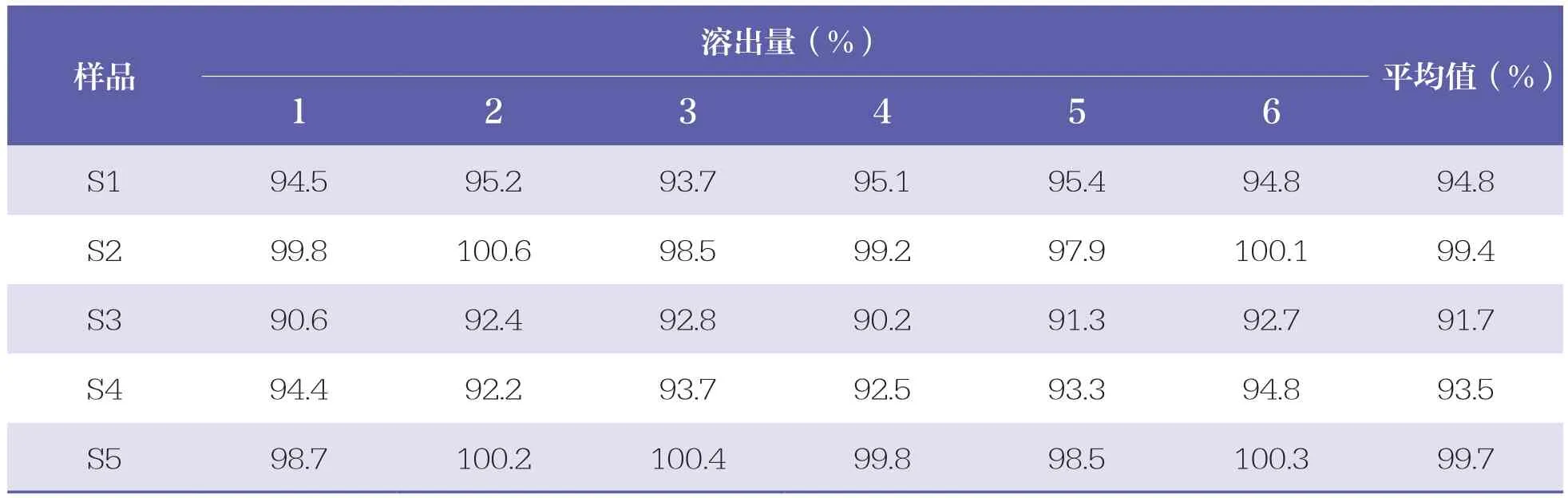
表3 5批阿奇霉素颗粒的溶出度结果
3.3.2 溶出曲线
5批阿奇霉素颗粒的溶出曲线见图1。

图1 5批阿奇霉素颗粒的溶出曲线
4 讨论
经过多年的发展、改进和提升,《中国药典》中阿奇霉素颗粒的鉴别项在单一的薄层色谱法基础上增加了HPLC,且薄层色谱法的点样浓度由30mg/ml降至5mg/ml、点样量由10μl降至2μl,提示方法灵敏度有了较大幅度的提升;有关物质项由薄层色谱法改为HPLC,色谱条件由等度洗脱改为梯度洗脱,系统适用性增加分离度、信噪比的要求以及判定标准中增加各杂质限量要求,不仅提高了方法灵敏度、系统适用性要求,还更加严格控制了各杂质的限量,进一步保证了药品的安全性;溶出度是控制药品质量、评价药物生物利用度和疗效的重要指标,阿奇霉素为水难溶性药物,口服吸收性较差,生物利用度不高,而溶出是限速步骤,应对溶出度进行考察[7-11],《中国药典》(2020 版)增加了溶出度测定项,进一步合理完善了阿奇霉素颗粒的标准;含量测定方法由抗生素微生物检定法改为HPLC,提高了方法的灵敏度和准确度,减少人为操作影响,提高检验效率和结果的可靠性,进一步保证了药品的有效性。
本研究中,因为标准的不同,同一批样品测得的数据结果判定会有差异,但由于杂质的量都很小,影响不是很明显。按《中国药典》(2015版)中阿奇霉素颗粒标准判定,对于杂质R、杂质J和杂质S只能按其他杂质(限度1.0%)计算。如果杂质含量处于限度边缘,样品结果判定可能为不合格;但当按《中国药典》(2020版)中阿奇霉素颗粒标准判定,分别乘以相应的校正因子,杂质含量可能低于相应限度,这样计算出来的杂质含量更准确,样品结果判定更为合理。因为阿奇霉素颗粒有关物质测定采用的是主成份自身对照法,各杂质与主成份(阿奇霉素)在HPLC上的响应因子不同,所以各杂质以相应的校正因子进行计算更为合适。《中国药典》(2020版)对阿奇霉素颗粒有关物质项的判定更加细化、更加严格,也同阿奇霉素原料标准保持一致,而《中国药典》(2015版)中阿奇霉素颗粒有关物质项的判定与阿奇霉素原料药标准判定要求不一致,表现为比阿奇霉素原料药要求更宽松。
阿奇霉素在水中几乎不溶,作为口服药物应该测定其溶出度。本研究中,不同厂家的样品溶出度结果虽然不同,但都达到了标准中的限度要求,即标示量的75%,表明样品均符合规定;各样品溶出量基本在30min左右达到峰值,表明《中国药典》(2020版)标准设置的取样时间合理。
综上所述,历版《中国药典》对于阿奇霉素颗粒的标准在不断修订和完善,且《中国药典》(2020版)的检验项目设置更合理,判定标准更加严谨,整体标准日趋完善,进一步确保了药品的安全性和有效性。

