人参皂苷Rg1 通过调控AMPK/NLRP3 通路介导的细胞焦亡抑制大鼠肺纤维化研究
邓宏哲,陈 昆,李 鹏,朱清海*
1.黄淮学院直属附属驻马店市中心医院 普外腹腔镜、减重与代谢外科,河南 驻马店 463000
2.黄淮学院化学与制药工程学院,河南 驻马店 463003
肺纤维化(pulmonary fibrosis,PF)是一种罕见的呼吸系统疾病,主要特征为肺泡壁及间质内大量炎性细胞浸润、成纤维细胞过度增殖以及细胞外基质合成增多、肺结构破坏等,并最终导致进行性严重呼吸困难[1]。既往研究显示,PF 发病率呈逐年增加趋势,且患者预后状况极差,确诊后平均生存时间仅为2~3 年,严重危害人类健康[2]。目前,对于PF 除肺移植外尚缺乏理想的药物治疗。因此以PF发病机制的关键环节为切入点,研发有效的治疗药物对于改善PF 患者预后具有重要的临床价值。
人参皂苷Rg1是三七总皂苷中的主要活性成分,具有抗炎、抗纤维等作用[3]。研究显示,人参皂苷Rg1能够上调小窝蛋白-1 表达,下调转化生长因子-β1(transforming growth factor-β1,TGF-β1)表达,降低肺组织α-肌动球蛋白(α-smooth muscle actin,α-SMA)和羟脯氨酸(hydroxyproline,Hyp)含量,从而改善PF 大鼠组织形态[4],提示人参皂苷Rg1可能是治疗PF 的潜在药物。但是目前有关人参皂苷Rg1在PF 中的机制研究仍然较少。细胞焦亡作为一种新的炎症性细胞死亡方式,在PF 进展中发挥重要作用。研究显示,博来霉素诱导的大鼠PF模型中焦亡相关蛋白半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)、白细胞介素-1β(interleukin-1β,IL-1β)和IL-18 表达显著升高,而抑制Caspase-1 表达能够抑制细胞焦亡过程,从而显著改善大鼠PF 组织形态[5],提示通过调控Caspase-1 依赖性细胞焦亡可能为治疗PF 的关键机制之一。腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)/NOD 样受体蛋白3(NOD-like receptor protein 3,NLRP3)是细胞焦亡调节的重要途径,抑制AMPK表达能够激活NLRP3 进而启动细胞焦亡[6],且AMPK 及NLRP3 炎性小体激活在PF 组织损伤中发挥重要作用[7-8]。本研究拟通过构建博来霉素诱导大鼠PF 模型,旨在从AMPK/NLRP3 介导细胞焦亡途径探究人参皂苷Rg1抗大鼠PF 的作用机制,以期为人参皂苷Rg1开发临床应用治疗PF 提供实验依据。
1 材料
1.1 动物
SPF 级雄性SD 大鼠50 只,体质量180~200 g,6~8 周龄,购自郑州大学医学院实验动物学部,生产许可证号SCXK(豫)2018-0007,使用许可证号SYXK(豫)2019-0013。动物饲养于(24±2)℃、相对湿度(55±5)%的环境中,昼夜交替光照,自由进食饮水,适应性喂养1 周。动物实验符合3R 原则,通过驻马店市中心医院动物医学伦理委员会审查(批准号2021LL020)。
1.2 药品与试剂
人参皂苷Rg1(批号AF20033002,质量分数为90%)购自成都埃法生物科技有限公司;博来霉素(批号20067411)购自瀚晖制药有限公司;AMPK 激动剂 AICAR(批号 S1802)、AMPK 抑制剂Compound C(批号S7306)购自美国Selleck 公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、IL-1β、IL-18 检测试剂盒(批号分别为20180052IL6M、20165200IL1M、20160645TNF1M、20160648IL18M)购自上海拜力生物科技有限公司;BCA 蛋白浓度测定试剂盒、牛血清白蛋白(bovine serum albumin,BSA)、苏木素-伊红(HE)染色试剂盒、显影液、β-actin 抗体、HRP 标记的山羊抗鼠IgG 抗体、HRP 标记的山羊抗兔IgG 抗体(批号分别为P0012S、ST023、C0105S、C1091、AF5001、A0412、A0408)购自上海碧云天生物技术公司;Masson 染色液(批号G1343)购自北京Bioss 公司;免疫组化检测试剂盒(批号SP-9001)购自北京中杉金桥公司;Hyp 检测试剂盒(批号A030-2-1)购自南京建成生物工程研究所;collagen I 抗体(批号ab270993)、α-SMA 抗体(批号ab265588)购自英国Abcam 公司;AMPK 抗体、p-AMPK 抗体、NLRP3抗体、Caspase-1 抗体、消皮素D(gasdermin D,GSDMD)抗体、IL-1β 抗体、IL-18 抗体(批号分别为9158、5759、13158、83383、39754、12703、67775)购自美国CST 公司。
1.3 仪器
LP-5117 型多功能酶标仪(长春乐镤科技有限公司);CKX53 型荧光倒置显微镜(日本Olympus公司);H3-18KR 型高速冷冻离心机(湖南可成仪器设备有限公司);Flexivent fv-fx4 型小动物肺功能分析系统(加拿大Scireq 公司);Gel Doc XR+型凝胶成像系统(美国Bio-Rad 公司);MDF-C8V(N)型-80 ℃冷冻冰箱(日本SANYO 公司)。
2 方法
2.1 造模、分组与给药
参照文献方法[4,9]构建PF 大鼠模型,大鼠ip 1%戊巴比妥钠(35 mg/kg)麻醉后,取仰卧位固定,行器官插管后单次注射博来霉素(5 mg/kg),模型成功率为100%。造模成功后2 d,动物随机分为模型组、人参皂苷Rg1(72 mg/kg)[4,10]组、AMPK 激动剂(200 mg/kg)组、人参皂苷Rg1(72 mg/kg)+AMPK 抑制剂(20 mg/kg)[11-12]组,每组各10 只,另取10 只大鼠作为对照组。人参皂苷Rg1组ig 人参皂苷Rg1,AMPK 激动剂组ip AICAR,人参皂苷Rg1+AMPK 抑制剂组ig 人参皂苷Rg1同时ip Compound C,对照组和模型组ig 生理盐水,1 次/d,连续28 d。
2.2 大鼠呼吸功能指标检测
各组大鼠麻醉后,行气管插管并利用小动物肺功能分析系统检测大鼠呼吸功能相关指标,测定用力肺活量(forced vital capacity,FVC)、第0.3 秒用力呼气容积(forced expiratory volume,FEV0.3)与FVC 的比值(FEV0.3/FVC)、最大呼气量(peak expiratory flow,PEF)和最大通气量(maximal voluntary ventilation,MVV)。以上检测指标均由同一人完成,每只大鼠测量3 次,取平均值。
2.3 肺组织标本采集
给药结束后,称定各组大鼠体质量,大鼠ip 戊巴比妥钠麻醉,断头处死,取全肺,生理盐水冲洗肺组织表面血渍,滤纸吸干水平,称定质量,计算肺指数。将部分左肺组织放置于4%多聚甲醛溶液中固定,右肺组织放置于冷冻管内放置于-80 ℃冰箱保存备用。
肺指数=肺湿质量/体质量
2.4 肺组织病理形态学观察
取于4%多聚甲醛中固定的左肺组织,脱水、透明石蜡包埋,制备组织切片,切片厚度约3~5 μm,进行HE 染色、封片后,于显微镜下观察肺组织病理学变化;进行Masson 染色,观察肺组织病理学变化及胶原沉积情况。
2.5 肺组织Hyp、TNF-α、IL-6、IL-1β 和IL-18 含量检测
剪取100 mg 各组大鼠右肺组织,充分匀浆,3000 r/min 离心10 min,取上清液,按照试剂盒说明书测定Hyp、TNF-α、IL-6、IL-1β 和IL-18 含量。
2.6 免疫组化检测肺组织collagen I 和α-SMA 蛋白表达
取各组大鼠左肺组织石蜡切片,按照免疫组化检测试剂盒处理,分别滴加collagen I、α-SMA 抗体(1∶200)孵育后,滴加二抗(1∶1000)孵育,DAB显色,于显微镜下观察肺组织collagen I、α-SMA 阳性表达,collagen I、α-SMA 蛋白阳性表达呈棕黄色颗粒。利用Image Pro Plus 图像分析软件进行半定量分析,每组取6 张切片,随机取6 个高倍视野,测量每个视野中蛋白阳性染色区域面积,计算得到阳性染色区域面与总面积比值,即为collagen I、α-SMA 蛋白相对表达量。
2.7 Western blotting 检测肺组织AMPK/NLRP3通路及焦亡相关蛋白表达
取各组大鼠右肺组织,剪碎,液氮碾磨成细粉状,加入5 倍量裂解液,4 ℃裂解40 min,提取蛋白,采用BCA 法测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5% BSA,室温封闭2 h;分别加入p-AMPK 抗体(1∶1000)、AMPK 抗体(1∶1000)、NLRP3 抗体(1∶1000)、Caspase-1 抗体(1∶1000)、GSDMD 抗体(1∶1000)、IL-1β 抗体(1∶1000)、IL-18 抗体(1∶1000)和β-actin 抗体(1∶2000),4 ℃孵育过夜;加入相应二抗(1∶5000),室温孵育1~2 h;洗膜3 次,每次5 min,滴加显影液,显影并拍照。
2.8 统计学分析
3 结果
3.1 人参皂苷Rg1 对PF 大鼠肺功能的影响
如表1 所示,与对照组比较,模型组大鼠肺功能指标FVC、FEV0.3/FVC、PEF 和MVV 均显著降低(P<0.05);与模型组比较,人参皂苷Rg1组和AMPK 激动剂组FVC、FEV0.3/FVC、PEF 和MVV指标均显著升高(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组FVC、FEV0.3/FVC、PEF 和MVV 指标均显著降低(P<0.05)。
表1 人参皂苷Rg1 对PF 大鼠肺功能的影响 (,n=6)Table 1 Effect of ginsenoside Rg1 on pulmonary function of PF rats (,n=6)
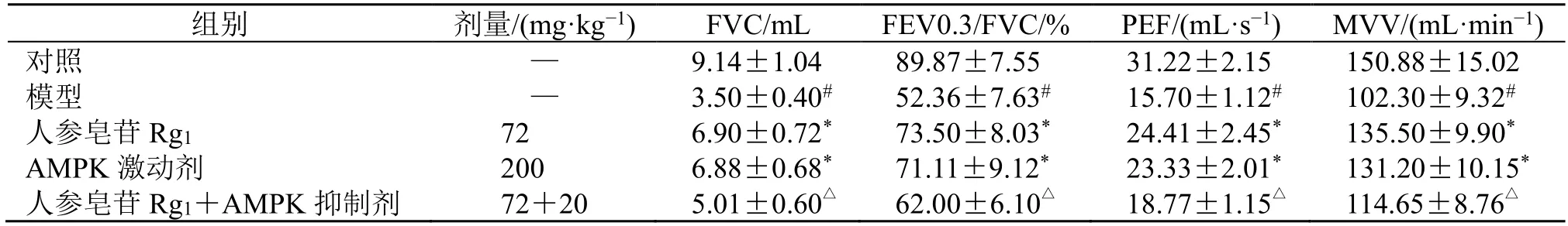
表1 人参皂苷Rg1 对PF 大鼠肺功能的影响 (,n=6)Table 1 Effect of ginsenoside Rg1 on pulmonary function of PF rats (,n=6)
与对照组比较:#P<0.05;与模型组比较:*P<0.05;与人参皂苷Rg1 组比较:△P<0.05,下表同#P < 0.05 vs control group;*P < 0.05 vs model group;△P < 0.05 vs ginsenoside Rg1 group,same as below tables
3.2 人参皂苷Rg1 对PF 大鼠肺组织病理变化的影响
HE 染色结果(图1)显示,对照组大鼠肺组织形态结构正常,肺泡清晰可见,未见明显的炎症细胞浸润。模型组大鼠肺组织结构紊乱,肺泡壁明显增厚且有部分肺泡已消失,可见大量炎症细胞在肺泡和间质腔内浸润。与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠肺组织结构损伤减轻,肺泡壁厚度降低,炎症细胞浸润现象降低。与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺组织损伤程度较模型相似。
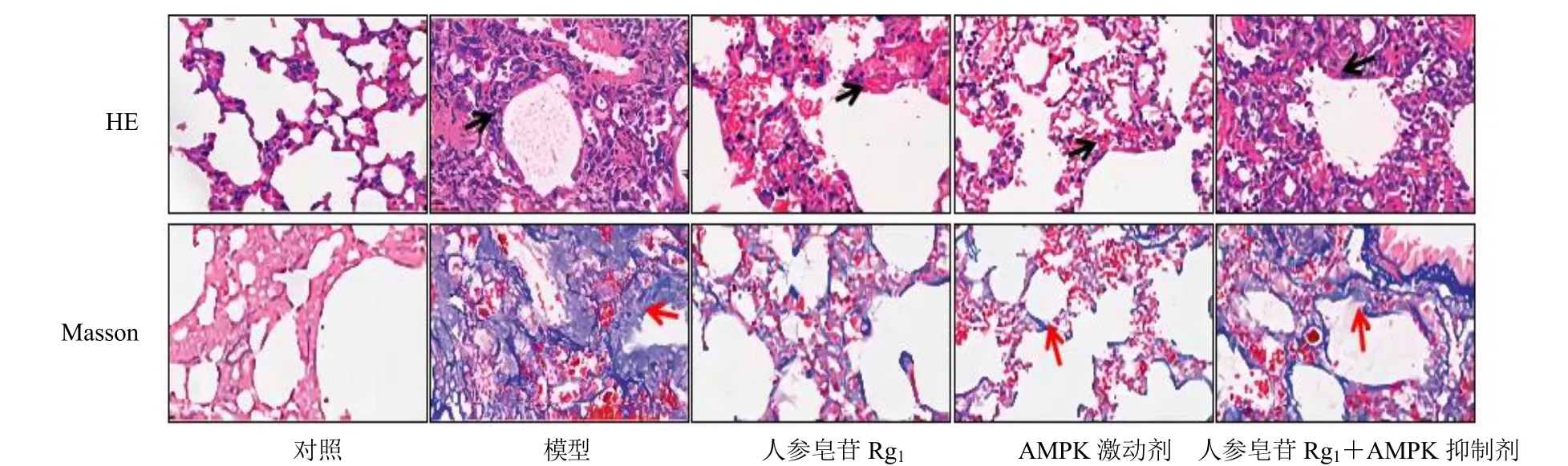
图1 人参皂苷Rg1 对PF 大鼠肺组织病理变化的影响 (×400)Fig.1 Effect of ginsenoside Rg1 on pathological changes of lung tissue in PF rats (× 400)
Masson 染色结果显示,对照组大鼠肺组织结构正常,无典型的纤维化现象。模型组大鼠肺组织出现大量胶原沉积,纤维化程度严重。与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠胶原沉积降低,纤维化程度减轻。与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺组织胶原沉积增多,纤维化程度加重,与模型组相近。
3.3 人参皂苷Rg1 对PF 大鼠肺指数和肺组织Hyp含量的影响
如表2 所示,与对照组比较,模型组大鼠肺指数和肺组织Hyp 含量均显著增加(P<0.05);与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠肺指数和肺组织Hyp 含量均显著降低(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺指数和肺组织Hyp 含量均显著增加(P<0.05)。
表2 人参皂苷Rg1 对PF 大鼠肺指数和肺组织Hyp 含量的影响 (,n=6)Table 2 Effect of ginsenoside Rg1 on lung index and Hyp content in lung tissue of PF rats (,n=6)

表2 人参皂苷Rg1 对PF 大鼠肺指数和肺组织Hyp 含量的影响 (,n=6)Table 2 Effect of ginsenoside Rg1 on lung index and Hyp content in lung tissue of PF rats (,n=6)
3.4 人参皂苷Rg1 对PF 大鼠肺组织collagen I 和α-SMA 蛋白表达的影响
如图2 和表3 所示,与对照组比较,模型组大鼠肺组织collagen I 和α-SMA 蛋白表达均显著增加(P<0.05);与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠肺组织collagen I 和α-SMA 蛋白表达均显著降低(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺组织collagen I 和α-SMA 蛋白表达均显著增加(P<0.05)。
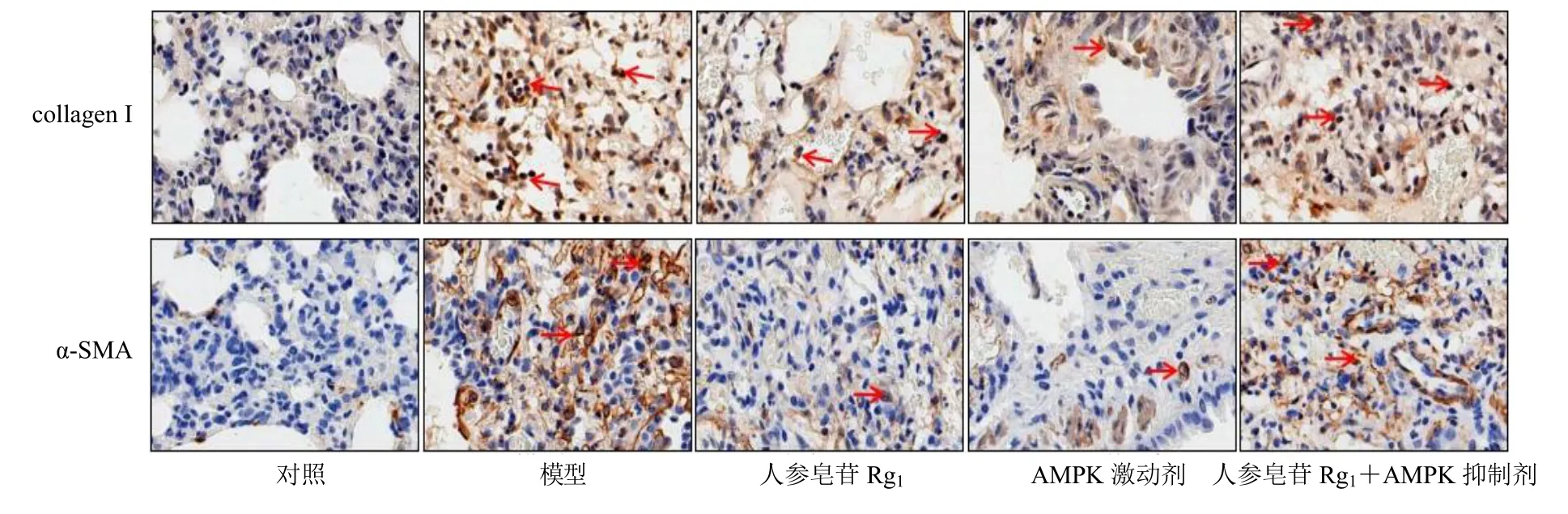
图2 免疫组化检测各组大鼠肺组织collagen I 和α-SMA 蛋白表达 (×400)Fig.2 Expressions of collagen I and α-SMA protein in lung tissue of rats in each group detected by immunohistochemistry(× 400)
表3 人参皂苷Rg1 对PF 大鼠肺组织collagen I 和α-SMA蛋白表达的影响 (,n=6)Table 3 Effect of ginsenoside Rg1 on collagen I and α-SMA protein expressions in lung tissue of PF rats (,n=6)
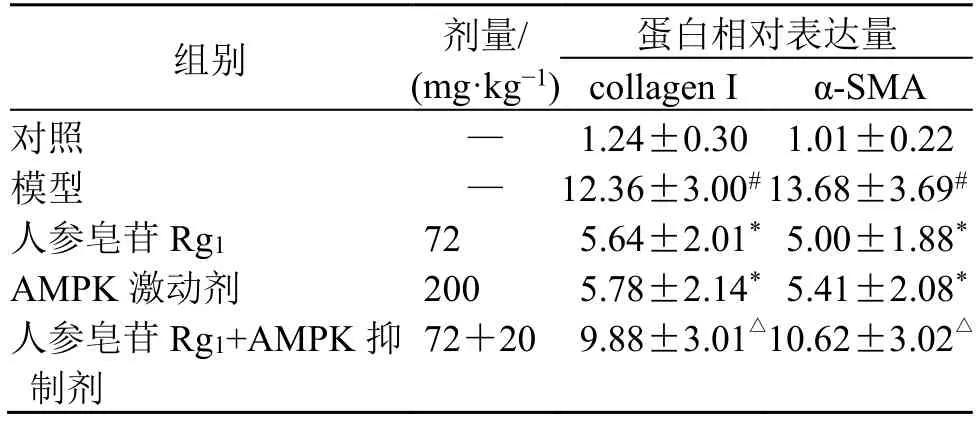
表3 人参皂苷Rg1 对PF 大鼠肺组织collagen I 和α-SMA蛋白表达的影响 (,n=6)Table 3 Effect of ginsenoside Rg1 on collagen I and α-SMA protein expressions in lung tissue of PF rats (,n=6)
3.5 人参皂苷Rg1 对PF 大鼠肺组织炎症因子水平的影响
如表4 所示,与对照组比较,模型组大鼠肺组织TNF-α、IL-6、IL-1β 和IL-18 水平均明显升高(P<0.05);与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠肺组织TNF-α、IL-6、IL-1β 和IL-18 水平均明显降低(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺组织TNF-α、IL-6、IL-1β 和IL-18 水平均明显升高(P<0.05)。
表4 人参皂苷Rg1 对PF 大鼠肺组织TNF-α、IL-6、IL-1β 和IL-18 水平的影响 (,n=6)Table 4 Effect of ginsenoside Rg1 on levels of TNF-α,IL-6,IL-1β and IL-18 in lung tissue of PF rats (,n=6)
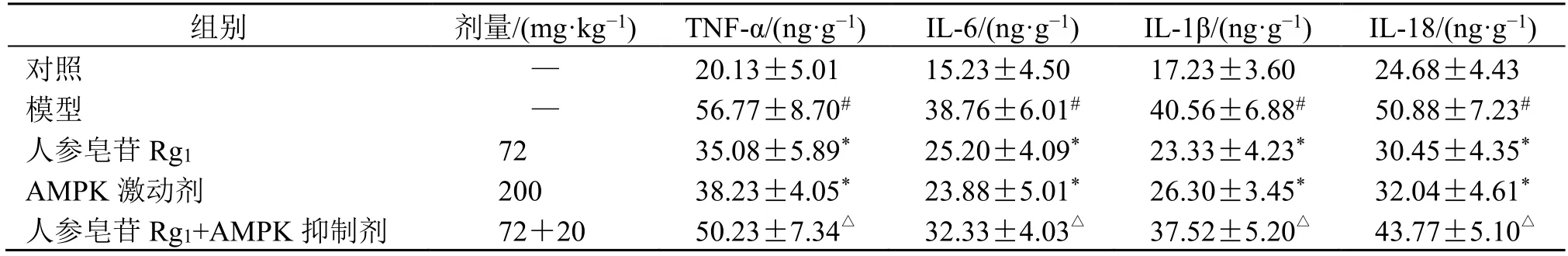
表4 人参皂苷Rg1 对PF 大鼠肺组织TNF-α、IL-6、IL-1β 和IL-18 水平的影响 (,n=6)Table 4 Effect of ginsenoside Rg1 on levels of TNF-α,IL-6,IL-1β and IL-18 in lung tissue of PF rats (,n=6)
3.6 人参皂苷Rg1 对PF 大鼠肺组织AMPK/NLRP3 通路相关蛋白表达的影响
如图3 所示,与对照组比较,模型组大鼠肺组织p-AMPK/AMPK 蛋白表达水平显著降低(P<0.05),NLRP3 蛋白表达水平显著升高(P<0.05);与模型组比较,人参皂苷Rg1组及AMPK 激动剂组大鼠肺组织p-AMPK/AMPK 蛋白表达水平显著升高(P<0.05),NLRP3 蛋白表达水平显著降低(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组大鼠肺组织p-AMPK/AMPK 蛋白表达水平显著降低(P<0.05),NLRP3 蛋白表达水平显著升高(P<0.05)。

图3 人参皂苷Rg1 对PF 大鼠肺组织AMPK/NLRP3 通路相关蛋白表达的影响 (,n=6)Fig.3 Effect of ginsenoside Rg1 on expressions of AMPK/NLRP3 pathway related proteins in lung tissue of PF rats (,n=6)
3.7 人参皂苷Rg1 对PF 大鼠肺组织焦亡相关蛋白表达的影响
如图4 所示,与对照组比较,模型组大鼠肺组织 cleaved Caspase-1/pro Caspase-1、GSDMD-N/GSDMD、IL-1β 和IL-18 蛋白表达水平均明显升高(P<0.05);与模型组比较,人参皂苷Rg1组及AMPK 激动剂组cleaved Caspase-1/pro Caspase-1、GSDMD-N/GSDMD、IL-1β 和IL-18 蛋白表达水平均明显降低(P<0.05);与人参皂苷Rg1组比较,人参皂苷Rg1+AMPK 抑制剂组cleaved Caspase-1/pro Caspase-1、GSDMD-N/GSDMD、IL-1β 和IL-18蛋白表达水平均明显升高(P<0.05)。

图4 人参皂苷Rg1 对PF 大鼠肺组织焦亡相关蛋白表达的影响 (,n=6)Fig.4 Effect of ginsenoside Rg1 on expressions of scorch-related proteins in lung tissue of PF rats (,n=6)
4 讨论
PF 是一种不可逆且致命的肺部疾病,并伴有组织炎症及肺泡结构破坏等特征。现代医学认为炎症调节失衡是PF 主要的发病机制之一,PF 前期会发生明显的肺泡炎症,导致巨噬细胞以及中性粒细胞在下呼吸道大量聚集,从而引起肺泡上皮细胞凋亡增加,并最终导致肺结构破坏,渐进性形成PF[13]。虽然早期诊断和治疗对于PF 临床症状改善至关重要,但是目前尚未有良好的治疗药物。尼达尼布和吡非尼酮被推荐为临床治疗PF 的一线用药,但是由于其诱发严重不良反应发生率高,限制了上述药物临床应用。因此,寻找安全有效的治疗药物已经成为众多学者研究的重点。
中医药替代疗法在PF 中逐渐被广泛接受,人参皂苷Rg1是人参皂苷中的主要活性成分之一,具有抗炎、抗氧化、抗肿瘤[14]等药理学作用。研究发现,人参皂苷Rg1能够改善PF 肺组织结构破坏,具有潜在的PF 治疗价值[4]。但是目前有关人参皂苷Rg1对PF 的作用机制尚不完全清楚。为此本研究首先通过博来霉素诱导大鼠PF 模型,观察人参皂苷Rg1对其作用。结果显示,模型组大鼠肺功能FVC、FEV0.3/FVC、PEF 和MVV 指标均显著降低,肺指数、肺组织胶原沉积现象及纤维化程度增加,肺组织结构出现明显损伤,提示PF 大鼠模型构建成功。细胞外基质的合成与分解的动态平衡是维持肺组织正常结构和功能的关键。collagen I 作为PF 时细胞外基质的主要组成成分,由成纤维细胞和肌成纤维细胞合成分泌,而当肺组织损伤时,成纤维细胞大量增殖并向肌成纤维细胞转化,从而合成大量细胞外基质,导致肺实质性损伤与结构重塑,诱导PF[15]。α-SMA 是成纤维细胞转化为肌成纤维细胞时的标志物,PF 时α-SMA 表达明显增加[16]。肺指数和Hyp是反映肺纤维化的重要指标。Hyp 作为胶原中特定氨基酸,其含量高低是评估胶原含量的重要指标[17]。因此,通过检测肺系数、肺组织Hyp 含量以及collagen I、α-SMA 蛋白表达能够准确反映肺组织胶原沉积情况,评价PF 时组织损伤程度。研究显示,在PF 大鼠模型中肺指数、肺组织Hyp 含量以及collagen I、α-SMA 蛋白表达均显著升高,而抑制上述指标变化能够显著改善PF肺组织损伤程度[18]。本研究结果显示,模型组大鼠肺指数、肺组织Hyp含量以及collagen I、α-SMA 蛋白表达升高,给予人参皂苷Rg1干预后肺指数、肺组织Hyp 含量以及collagen I、α-SMA 蛋白表达均显著降低,表明人参皂苷Rg1能够有效降低胶原蛋白沉积,减轻PF。PF时肺泡上皮细胞释放大量炎性细胞因子如TNF-α、IL-6、IL-1β 等,高炎症反应会导致肺成纤维细胞过度增殖以及转向肌成纤维细胞,导致胶原合成增加[19]。本研究结果显示,模型组肺组织TNF-α、IL-6、IL-1β 和IL-18 水平明显升高,人参皂苷Rg1能够显著降低肺组织TNF-α、IL-6、IL-1β 和IL-18 水平,表明人参皂苷Rg1能够通过抑制炎症反应,改善PF。
细胞焦亡是一种新的程序性死亡,也被称为炎症性调节性坏死,主要表现为细胞膜胀大破裂导致内容物释放,诱导炎症反应,在PF 中发挥重要作用。NLRP3 炎性小体是焦亡启动的关键,当NLRP3被激活时会促进NLRP3 炎症小体组装形成复合物,继而激活pro Caspase-1 形成具有活性的cleaved Caspase-1,诱导焦亡执行蛋白GSDMD 形成具有细胞毒性的GSDMD-N,并使其募集至细胞膜上形成焦亡小孔,促进炎症因子IL-1β 和IL-18 表达,诱导细胞焦亡[20]。研究显示,NLRP3 炎性小体参与PF疾病进展的各个阶段,其活化后能够激活IL-1β 和IL-18,而IL-1β 能够刺激TGF-β1 合成,诱导肺泡上皮细胞间质转化,从而加剧PF 形成,抑制NLRP3能够明显改善PF[21],表明NLRP3 炎性小体可能成为治疗PF 的关键靶点。AMPK 被认为是细胞能量和代谢的调节剂,参与调节炎症、氧化应激、自噬等途径,在PF 肺组织损伤中发挥保护作用[22]。本研究结果显示,模型组大鼠肺组织p-AMPK/AMPK表达降低,NLRP3 表达增加,焦亡相关蛋白(cleaved Caspase-1/pro Caspase-1、GSDMD-N/GSDMD、IL-1β、IL-18)表达增加,而人参皂苷Rg1能够上调p-AMPK/AMPK 表达,下调NLRP3 及焦亡相关蛋白表达。抑制AMPK 活性可以通过激活NLRP3 炎性小体,促进细胞焦亡,二甲双胍可以通过AMPK 途径抑制NLRP3 炎性小体活化,抑制心肌细胞焦亡,从而发挥心肌缺血再灌注损伤的保护作用,且此保护作用可显著被AMPK 抑制剂Compound C 阻断[23]。本研究结果显示,AMPK 激动剂组与人参皂苷Rg1发挥同向抗PF 作用,肺组织NLRP3 及焦亡相关蛋白表达均明显降低,炎症因子TNF-α、IL-6、IL-1β、IL-18 水平降低,提示AMPK/NLRP3 途径可能是人参皂苷Rg1抗PF 的重要调节通路。为进一步确证AMPK/NLRP3 在人参皂苷Rg1抗PF 中保护机制(图5),同时给予人参皂苷Rg1和AMPK 抑制剂Compound C,发现人参皂苷Rg1对博来霉素诱导的大鼠PF 保护作用被逆转,炎症因子及焦亡相关蛋白表达均明显升高,提示人参皂苷Rg1可以通过促进AMPK 表达,抑制NLRP3 介导细胞焦亡发挥PF肺组织损伤的保护作用。
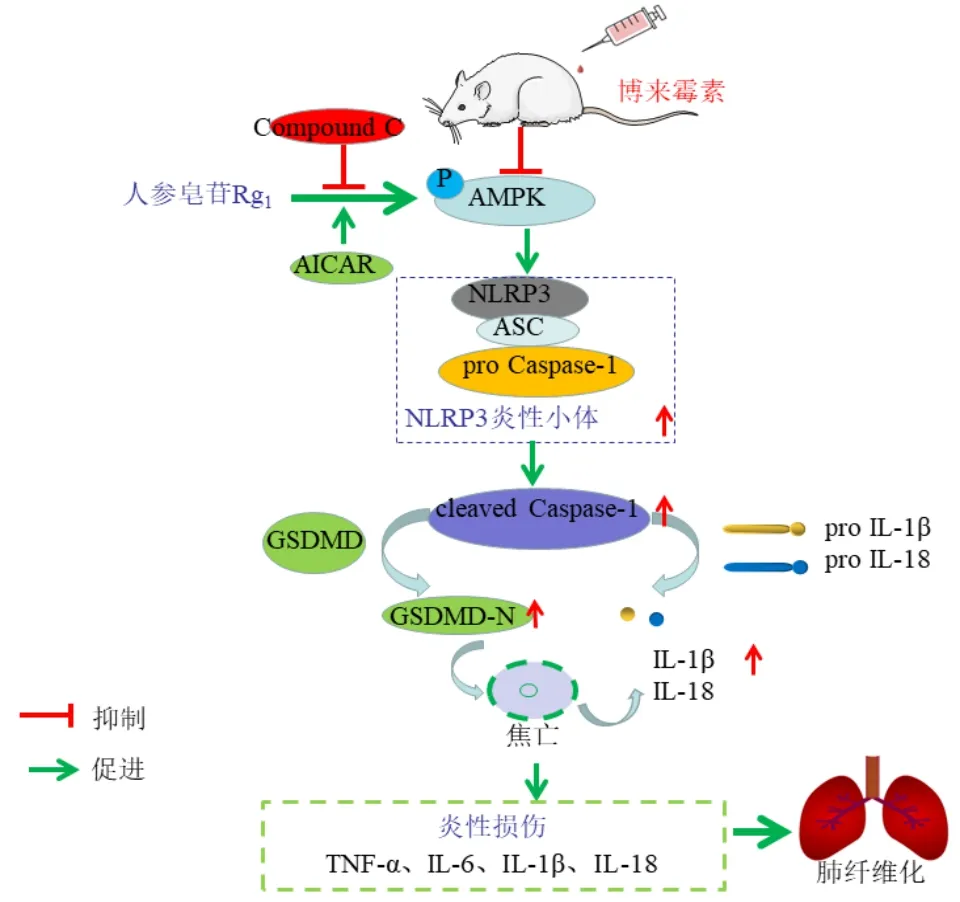
图5 人参皂苷Rg1通过调控AMPK/NLRP3 通路抑制细胞焦亡减轻博来霉素诱导的PFFig.5 Ginsenoside Rg1 inhibits pyroptosis by regulating AMPK/NLRP3 pathway to reduce bleomycin-induced PF
综上所述,本研究发现人参皂苷Rg1能够改善博来霉素诱导的PF,其作用机制与抑制AMPK/NLRP3 通路介导的细胞焦亡相关。
利益冲突所有作者均声明不存在利益冲突

