茶藤生物碱成分的分离鉴定及抗肿瘤活性研究
何琴慧 ,姜雨辰,王文玲,李丽梅
1.西南民族大学药学院,四川 成都 610041
2.成都医学院,四川 成都 610500
茶藤Melodinus magnificusTsiang 是夹竹桃科(Apocynaceae)山橙属MelodinusJ.R.Forst.&G.Forst.的攀援木质藤本植物,俗称大山橙。主要分布在中国广西等地,多生长于山地疏林或山坡向阳处,为我国特有植物,其叶揉制作茶饮料,有兴奋作用[1],也具有清热排毒、利喉消肿、抗菌消炎等作用[2]。目前仅见1 篇文献报道从广西壮族自治区上思县的茶藤中分离得到4 个单萜吲哚生物碱[2]。本研究组在预实验中发现茶藤的总生物碱浸膏对肿瘤细胞(人肝癌HepG2 细胞、乳腺癌MCF7 细胞和人肺癌A549 细胞)增殖有一定的抑制作用,因此,为进一步在该植物中发现结构各异且潜在的具有抗肿瘤活性的生物碱成分,本研究通过常规的天然药物化学方法提取分离纯化茶藤生物碱成分,采用核磁、质谱等波谱技术鉴定化合物的结构,得到的10 个化合物分别为strictamine(1)、deacetylakuammiline(2)、19-(Z)-akuammidine(3)、14,15-didehydrovincamine(4)、14,15-didehydro-16-epi-vincamine(5)、19-(S)-methoxy tubotaiwine(6)、19-(R)-methoxy-tubotaiwine(7)、rhazimine(8)、rhazicineN4-oxide(9)和rhazicine(10);所有化合物均为首次从该植物中分离得到,化学结构见图1。并采取MTT 法筛选化合物的抗肿瘤活性,以及结合网络药理学和分子对接技术预测具有抗肿瘤活性的生物碱的靶点和通路。
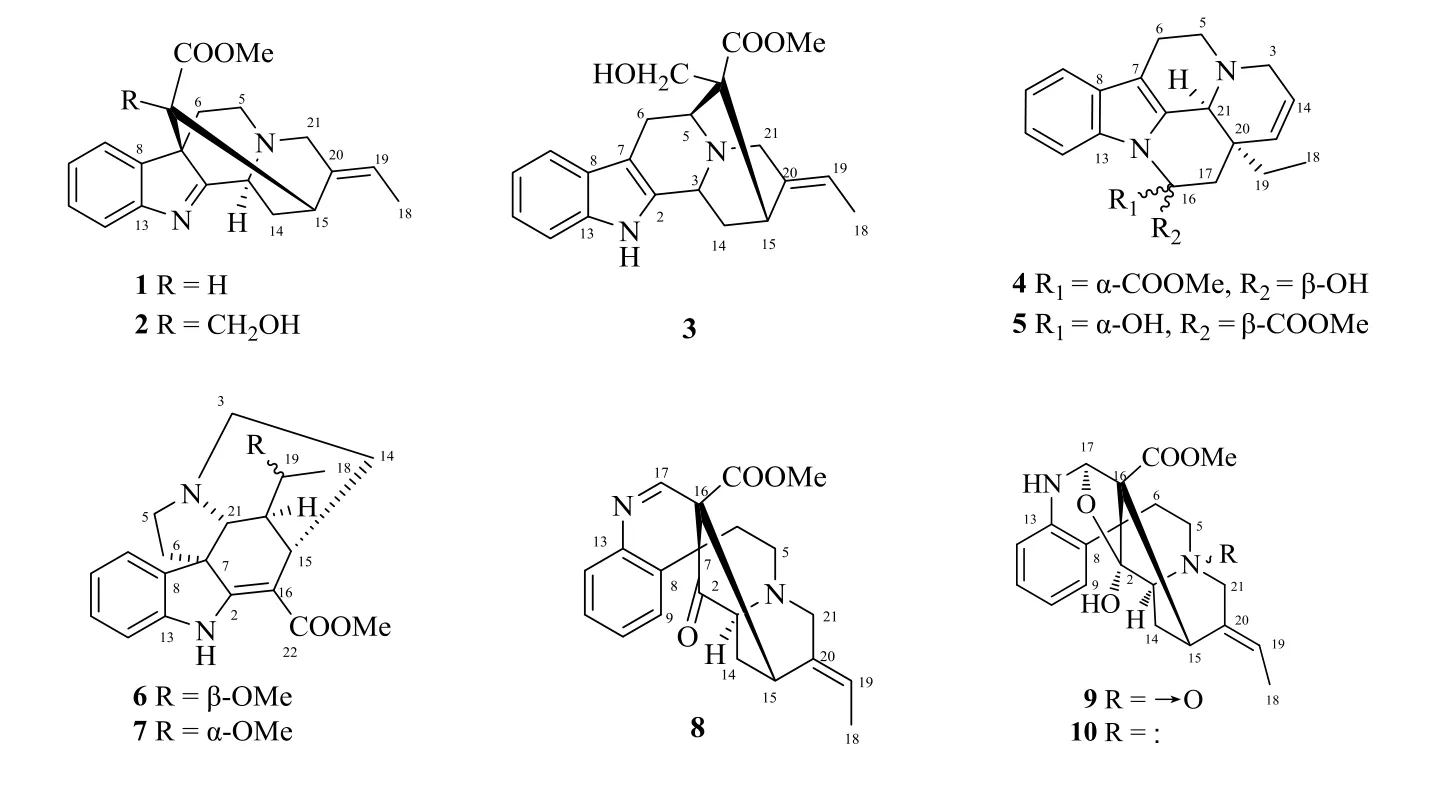
图1 化合物1~10 的结构Fig.1 Chemical structures of compounds 1—10
1 仪器与材料
Brucker AV 400 核磁共振仪(瑞士Bruker 公司);Bruker Micro TOF QII 质谱仪(瑞士Bruker 公司);薄层色谱硅胶板(GF254,青岛海洋化工有限公司);正相硅胶(100~200、200~300 目,青岛海洋化工有限公司);反相硅胶(RP-18,德国Merck公司);碱性氧化铝硅胶(100~200、200~300 目,国药集团化学试剂有限公司);葡聚糖凝胶(Sephadex LH-20 gel,美国GE 公司);紫杉醇(PTX,购自Sigma 公司)。
植物样品于2018 年8 月采自云南省文山州,由昆明植分生物技术有限公司张君高级工程师鉴定为夹竹桃科山橙属植物茶藤M.magnificusTsiang 枝叶,标本(LMMM1808)保存在西南民族大学药学院。
2 提取与分离
茶藤枝叶干质量50 kg,粉碎后,选用100 L 工业级甲醇60 ℃提取3 次,每次3 h,将提取液进行合并和滤过,并减压浓缩直至无醇后得到醇提物。醇提物经10 L 反渗水稀释后,用5% HCl 将pH 值调至1~2,并使用等体积的醋酸乙酯萃取3 次,水层用NaOH 将pH 值调至9~10,并使用等体积的氯仿连续萃取4 次,减压浓缩氯仿层,得到总生物碱53 g。
称取总生物碱约50 g,通过200~300 目碱性氧化铝硅胶柱,用氯仿-甲醇(100∶0~0∶100)梯度洗脱,合并称取总生物碱约50 g,通过200~300目碱性氧化铝硅胶柱,用氯仿-甲醇(100∶0~0∶100)梯度洗脱,合并相同组分后分为3 个组分Fr.1~3。组分Fr.1(21.7 g)以甲醇-水(10%~60%)进行反相柱色谱梯度洗脱,10%~20%甲醇部分记为Fr.1.1(3.0 g),30%甲醇部分记为Fr.1.2(1.8 g),40%甲醇部分记为Fr.1.3(1.4 g),50%~60%甲醇部分记为Fr.1.4(7.0 g)。Fr.1.1 经过Sephadex LH-20(甲醇)柱色谱,得到化合物4(20 mg)。Fr.1.2 经过醋酸乙酯-甲醇(5∶1~1∶1)正相硅胶柱分离得到合物9(394胶柱色谱 [石油醚-醋酸乙酯(15∶1~1∶1)],接着采用制备薄层色谱法[氯仿-甲醇(10∶1)]得到化合物5(12 mg)。
3 结构鉴定
化合物1:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 323 [M+H]+,分子式C20H22N2O2。1H-NMR (400 MHz,CDCl3)δ: 1.54 (3H,dd,J=7.0,2.3 Hz,H-18),1.73 (1H,dd,J=13.8,2.6 Hz,H-6b),2.01 (1H,dd,J=14.7,4.8 Hz,H-14b),2.07 (1H,d,J=3.8 Hz,H-16),2.57 (1H,m,H-14a),2.64~2.76 (3H,m,H-5,6a),3.11 (1H,d,J=17.0 Hz,H-21b),3.71 (1H,m,H-15),3.73 (3H,s,22-OMe),4.05 (1H,d,J=17.0 Hz,H-21a),4.68 (1H,d,J=5.1 Hz,H-3),5.51 (1H,q,J=6.9 Hz,H-19),7.16 (1H,t,J=7.6 Hz,H-10),7.33 (1H,t,J=7.5 Hz,H-11),7.42(1H,d,J=7.4 Hz,H-12),7.62 (1H,d,J=7.7 Hz,H-9);13C-NMR (100 MHz,CDCl3) 数据见表1。上述结果与文献报道数据基本一致[3-4],故鉴定化合物1 为strictamine。
化合物2:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察示暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 353 [M+H]+,分子式C21H24N2O3。1H-NMR (400 MHz,CDCl3)δ: 1.62 (3H,dd,J=7.1,2.2 Hz,H-18),1.88 (1H,dd,J=14.4,4.4 Hz,H-14b),2.02 (1H,dd,J=14.7,3.9 Hz,H-5b),2.41 (1H,ddd,J=14.4,4.8,2.5 Hz,H-14a),2.66 (2H,ddd,J=17.8,14.2,5.1 Hz,H-6),2.86,2.98 (各1H,d,J=12.3 Hz,H-17),3.11 (1H,d,J=17.0 Hz,H-21b),3.63 (1H,m,H-15),3.66 (1H,m,H-5a),3.82 (3H,s,mg)。Fr.1.3 经过醋酸乙酯-甲醇(50∶1~1∶1)正相硅胶柱得到化合物1(196 mg)、6 和7(27 mg)。Fr.1.4 利用石油醚-丙酮(4∶1~1∶2)正相硅胶柱分离得到Fr.1.4.1(20 mg)和Fr.1.4.2(20 mg)2个部分。Fr.1.4.1 采用氯仿-甲醇(10∶1)制备薄层色谱法得到化合物3(12 mg),Fr.1.4.2 采用醋酸乙酯-甲醇(10∶1)制备薄层色谱法得到生物碱类化合物2(10 mg)。组分Fr.2(4.0 g)经过Sephadex LH-20(甲醇)柱色谱得到Fr.2.1(2.8 g)和Fr.2.2(1.0 g)。Fr.2.1 经过醋酸乙酯-甲醇(100∶0~50∶1)硅胶柱色谱,得到化合物10(100 mg)。Fr.2.2经过制备薄层色谱 [醋酸乙酯-甲醇(10∶1)]得到合物8(134 mg)。组分Fr.3(8.0 g)先经过正相硅22-OMe),4.10 (1H,brd,J=17.0 Hz,H-21a),4.57(1H,d,J=4.5 Hz,H-3),5.44 (1H,q,J=6.9 Hz,H-19),7.16 (1H,t,J=7.5 Hz,H-10),7.32 (1H,t,J=7.6 Hz,H-11),7.51 (1H,d,J=7.5 Hz,H-12),7.61(1H,d,J=7.7 Hz,H-9);13C-NMR (100 MHz,CDCl3)数据见表1。上述结果与文献数据基本一致[3,5],故鉴定化合物2 为deacetylakuammiline。
化合物3:白色无定形粉末,不溶于三氯甲烷,易溶于甲醇;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 353 [M+H]+,分子式C21H24N2O3。1H-NMR (400 MHz,MeOH-d4)δ: 1.68 (3H,d,J=6.8 Hz,H-18),1.90 (1H,t,J=11.6 Hz,H-14b),2.69 (1H,dd,J=11.6,2.4 Hz,H-14a),2.80 (1H,brs,H-5),2.81 (1H,m,H-6a),2.94 (3H,s,22-OMe),3.31 (1H,d,J=3.2 Hz,H-15),3.40 (1H,m,H-6b),3.51 (1H,d,J=16.9 Hz,H-21b),3.60 (1H,m,H-21a),3.66 (1H,d,J=9.7 Hz,H-17b),3.78 (1H,d,J=9.7 Hz,H-17a),4.22 (1H,d,J=9.8 Hz,H-3),5.45(1H,q,J=6.5 Hz,H-19),6.96 (1H,t,J=7.5 Hz,H-10),7.04 (1H,t,J=7.5 Hz,H-11),7.27 (1H,d,J=8.0 Hz,H-12),7.37 (1H,d,J=7.7 Hz,H-9);13C-NMR (100 MHz,MeOH-d4) 数据见表1。上述结果与文献数据基本一致[6],故鉴定化合物3 为19-(Z)-akuammidine。

表1 化合物1~3、5~10 的13C-NMR 波谱数据Table 1 13C-NMR data of compounds 1—3,5—10
化合物4:白色无定形粉末;在紫外波长254 nm下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z:353 [M+H]+,分子式C21H24N2O3。1H-NMR (400 MHz,DMSO-d6)δ: 0.92 (3H,t,J=7.5 Hz,H-18),1.52 (1H,dq,J=14.7,7.4 Hz,H-19b),1.84 (1H,dq,J=14.7,7.4 Hz,H-19a),2.15 (1H,d,J=14.2 Hz,H-17b),2.36 (1H,d,J=14.2 Hz,H-17a),2.44 (1H,dd,J=15.8,5.2 Hz,H-6b),2.84 (1H,d,J=17.3 Hz,H-3b),2.95 (1H,m,H-3a),3.02 (1H,m,H-6a),3.25(2H,m,H-5),3.72 (3H,s,22-OMe),3.97 (1H,s,H-21),5.38 (1H,dt,J=10.3,2.8 Hz,H-14),5.67 (1H,d,J=10.3 Hz,H-15),6.56 (1H,s,OH),6.97~7.04(3H,m,H-10~12),7.37 (1H,m,H-9);以上数据与文献数据基本一致[7],故鉴定化合物4 为14,15-didehydrovincamine。
化合物5:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 353 [M+H]+,分子式C21H24N2O3。1H-NMR (400 MHz,CDCl3)δ: 0.93 (3H,t,J=7.5 Hz,H-18),1.44 (1H,dd,J=13.7,7.3 Hz,H-19a),1.78 (1H,dd,J=13.7,7.3 Hz,H-19b),2.01(1H,d,J=14.2 Hz,H-17a),2.50 (1H,m,H-6a),2.60(1H,m,H-17b),3.01 (1H,m,H-3a),3.04 (1H,m,H-6b),3.17 (1H,m,H-3b),3.24 (1H,m,H-5a),3.38(1H,dd,J=13.8,6.9 Hz,H-5b),3.47 (3H,s,22-OMe),3.77 (1H,s,H-21),5.24 (1H,d,J=10.2 Hz,H-15),5.46 (1H,dt,J=10.2,3.0 Hz,H-14),7.07(1H,m,H-10),7.13 (1H,m,H-11),7.39 (1H,m,H-9),7.50 (1H,m,H-12);13C-NMR (100 MHz,CDCl3) 数据见表1。以上数据与文献数据基本一致[8],故鉴定化合物5 为14,15-didehydro-16-epi-vincamine。
化合物6:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 355 [M+H]+,分子式C21H26N2O3。1H-NMR (400 MHz,CDCl3)δ: 0.94 (3H,d,J=6.0 Hz,H-18),1.80 (2H,m,H-14),1.89 (1H,m,H-6a),2.04 (1H,m,H-20),2.50 (2H,m,H-3a,19),2.86 (2H,m,H-5b,6b),2.99 (3H,s,19-OMe),3.08(2H,m,H-3b,5a),3.46 (1H,brs,H-15),3.85 (3H,s,22-OMe),3.96 (1H,brs,H-21),6.81 (1H,d,J=7.7 Hz,H-12),6.89 (1H,t,J=7.1 Hz,H-10),7.10 (1H,m,H-11),7.16 (1H,d,J=7.4 Hz,H-9),8.93 (1H,s,NH);13C-NMR (100 MHz,CDCl3) 数据见表1。以上数据与文献报道基本一致[9],故鉴定化合物6 为19-(S)-methoxytubotaiwine。
化合物7:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z355 [M+H]+,分子式C21H26N2O3。1H-NMR (400 MHz,CDCl3)δ: 0.89 (3H,d,J=5.9 Hz,H-18),1.80 (2H,m,H-14),1.89 (1H,m,H-6a),2.04 (1H,m,H-20),2.40 (1H,m,H-19),2.50(1H,m,H-3a),2.65 (3H,s,19-OMe),2.86 (2H,m,H-5b,6b),3.07 (1H,brs,H-15),3.08 (2H,m,H-3b,5a),3.85 (3H,s,22-OMe),4.37 (1H,brs,H-21),6.81(1H,d,J=7.7 Hz,H-12),6.89 (1H,t,J=7.1 Hz,H-10),7.10 (1H,m,H-11),7.22 (1H,d,J=7.3 Hz,H-9),8.82 (1H,s,NH);13C-NMR (100 MHz,CDCl3)见表1。化合物7 与6 的核磁数据相似,推测其互为差向异构体,且与文献数据基本一致[9],故鉴定化合物7 为19-(R)-methoxytubotaiwine。
化合物8:白色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z: 351 [M+H]+,分子式C21H22N2O3。1H-NMR (400 MHz,CDCl3)δ: 1.58 (3H,dd,J=7.1,2.3 Hz,H-18),2.10 (1H,d,J=14.9 Hz,H-14b),2.48 (1H,ddd,J=14.9,5.4,2.7 Hz,H-14a),2.80 (1H,dd,J=15.7,3.2 Hz,H-5b),2.94~3.12 (2H,m,H-6),3.24 (1H,d,J=17.3 Hz,H-21b),3.52 (3H,s,22-OMe),3.76 (1H,m,H-15),3.77 (1H,m,H-5a),3.90 (1H,d,J=5.1 Hz,H-3),4.11 (1H,d,J=17.3 Hz,H-21a),5.57 (1H,q,J=6.6 Hz,H-19),7.32~7.43 (4H,m,H-9-12),7.70 (1H,s,H-17);13C-NMR(100 MHz,CDCl3) 数据见表1。以上数据与文献报道基本一致[3-4],故鉴定化合物8 为rhazimine。
化合物9:黄色无定形粉末,易溶于甲醇;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z385 [M+H]+,分子式C21H24N2O5。1H-NMR (400 MHz,MeOH-d4)δ: 1.57 (3H,dd,J=7.0,2.3 Hz,H-18),2.37 (1H,d,J=14.6 Hz,H-6a),2.64 (2H,m,H-6b,14a),3.00 (1H,m,H-14b),3.48(1H,dd,J=11.5,4.5 Hz,H-5a),3.58 (3H,s,22-OMe),3.77 (1H,m,H-15),3.83 (1H,m,H-3),4.05 (1H,d,J=15.5 Hz,H-5b),4.20 (1H,t,J=14.5 Hz,H-21a),4.30 (1H,d,J=14.5 Hz,H-21b),5.06 (1H,s,H-17),5.67 (1H,q,J=6.7 Hz,H-19),6.57 (1H,m,H-10),6.79(1H,m,H-11),7.07 (1H,d,J=7.1 Hz,H-12),7.28 (1H,d,J=7.8 Hz,H-9);13C-NMR (100 MHz,MeOH-d4) 见表1。以上数据与文献基本一致[10],故鉴定化合物9为rhazicineN4-oxide。
化合物10:黄色无定形粉末,易溶于三氯甲烷;在紫外波长254 nm 下观察到暗斑,碘化铋钾反应呈阳性。ESI-MSm/z369 [M+H]+,分子式C21H24N2O4。1H-NMR (400 MHz,CDCl3)δ: 1.48 (3H,m,H-18),1.95 (1H,d,J=18.0 Hz,H-14a),2.40 (2H,m,H-6b,14b),2.92 (1H,d,J=11.9 Hz,H-6a),2.97(1H,m,H-5b),3.15 (1H,d,J=16.4 Hz,H-21a),3.53(3H,s,22-OMe),3.63 (2H,m,H-5a,15),3.71 (1H,m,H-3),4.04 (1H,d,J=16.4 Hz,H-21b),4.91 (1H,s,H-17),5.47 (1H,m,H-19),6.56 (1H,d,J=7.6 Hz,H-12),6.79 (1H,m,H-10),7.07 (1H,m,H-11),7.19(1H,d,J=7.4 Hz,H-9);13C-NMR (100 MHz,CDCl3)数据见表1。以上数据与文献基本一致[3-4],故鉴定化合物10 为rhazicine。
4 抗肿瘤活性
4.1 肿瘤细胞毒活性筛选
用胰酶消化对数生长期的细胞,离心收集细胞(离心条件是5 min、800 r/min),弃去上清液,稀释细胞悬液25 倍,并计数,于96 孔培养板中以5×103个/孔的细胞密度接种,每孔的体积为200 μL。在培养箱中放置接种好的96 孔培养板并培养24 h,加入PBS 进行清洗,更换为含1%胎牛血清的RPMI 1640 培养基并加入待测化合物。实验组化合物和阳性对照药物紫杉醇(PTX,购自Sigma 公司)的浓度设置为31.25、62.50、125.00、250.00、1 000.00 nmol/L,对照组加等体积的空白培养基,并设置空白组以扣除背景影响,重复实验3 次,各组分别设定6 个复孔。
按上述实验分组处理培养48 h,紧接着每孔加入5 mg/mL 的 MTT 溶液10 μL,用手振荡30 s,然后转入培养箱中继续培养4 h,缓慢的吸去培养液中的上清液,并向96 孔培养板中每孔加入100 μL的DMSO,常温避光振摇5 min,等甲臜结晶完全溶解后,用酶标仪在490 nm/570 nm 处检测吸光度(A)值。根据检测到的A值计算细胞存活率,最后利用细胞存活率作为纵坐标(Y),浓度的对数值作为横坐标(X),作回归曲线,计算IC50值。
细胞存活率=(A实验-A空白)/(A对照-A空白)
实验结果显示,化合物1 和9 对A549 和HepG2细胞有显著的抑制作用,化合物4 对MCF7 细胞有显著的抑制作用,化合物5 对A549 和MCF7 细胞有明显的抗增殖活性,化合物6 和7 对A549 细胞有明显的抗增殖活性,化合物8 对A549、HepG2和MCF7 细胞有明显的抗增殖活性。其中化合物8对MCF7 细胞的细胞毒活性最强,IC50值为0.40 μmol/L。如表2 所示,以上对肿瘤细胞有抑制作用的化合物的IC50值均小于阳性对照PTX。其他化合物没有抑制肿瘤细胞增殖活性(IC50>50 μmol/L)。
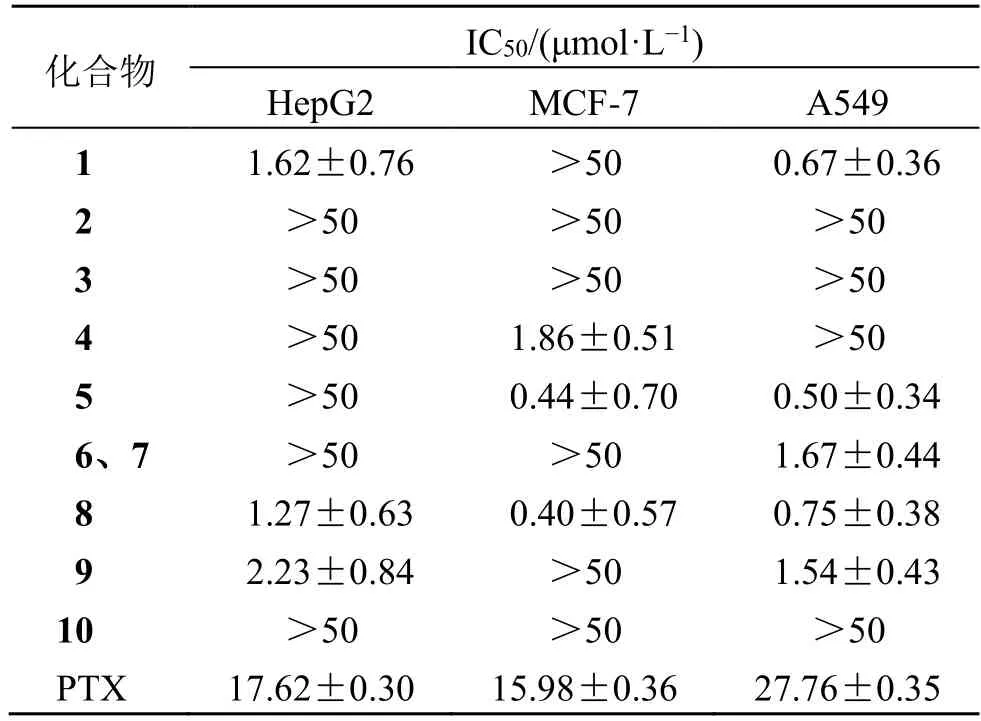
表2 生物碱化合物肿瘤细胞毒活性结果 (n=3)Table 2 Cytotoxicity results of compounds against tumor cells (n=3)
4.2 抗肿瘤潜在靶点和通路
4.2.1 网络药理学分析 将化合物导入Pharmmaper 网站进行反向找靶的初步筛选,紧接着使用String 数据库进行靶标蛋白相互作用网络也就是PPI 网络的构建,接着利用Metascape 网站进行GO 分析和KEGG 通路富集,然后采用Cytoscape软件进行网络拓扑参数分析以及构建“化合物-靶点-通路”网络并对结果进行分析[11-13]。
4.2.2 分子对接 利用AutoDock Vina 进行分子对接模拟,并采用PyMol 制作化合物4 与蛋白RXRA的结合模式图[11,14]。
4.2.3 化合物-靶点-通路网络构建图 “化合物-靶点-通路”网络图中节点颜色由绿到红表示Degree逐步升高,Degree 越高说明该靶点蛋白在网络中占有较大比例,分别调控多条癌症通路[13]。根据网络分析可知靶点蛋白RXRA(degree=8)、SRC(degree=7)、MAPK1(degree=6)和PIK3R1(degree=6)是该网络中占主要地位的靶点蛋白,是化合物发挥抗肿瘤作用的最关键靶点蛋白(图2)。

图2 化合物1、4~9 的化合物-靶点-通路网络图Fig.2 Compound-target-pathway network of compounds 1 and 4—9
4.2.4 分子对接结果 分子对接结果显示,在化合物和蛋白质对接过程中均进入活性位点,并且形成1~3 个氢键。化合物1、4~9 分别对蛋白RXRA、SRC、MAPK1、PIK3R1 均具有较好的结合能力,表明化合物可能通过作用于这4 个蛋白发挥抗肿瘤作用。其中化合物4 与蛋白RXRA 的结合能最低,结合能为-46.75 kJ/mol,表明化合物4 与蛋白RXRA的结合能力最强。
利用PyMol 制作化合物4 与蛋白RXRA 的结合模式图,见图3。灰色部分是蛋白RXRA,黄色部分是化合物4。蛋白RXRA 与化合物4 通过氢键结合,分析表明化合物与RXRA 共形成2 个氢键:RXRA 蛋白上LYS-175 的羰基和化合物4 上的羟基形成1 个氢键,键长为0.27 nm;TYR-189 的羟基与化合物4 上的羰基形成1 个氢键,键长为0.23 nm。

图3 化合物4 和蛋白RXRA 分子对接结果Fig.3 Molecular docking results of compound 4 and RXRA
5 讨论
本研究通过常规天然药物化学方法从茶藤中分离鉴定10 个生物碱化合物,并且通过MTT 法和网络药理学方法筛选出7个具有抗肿瘤活性的生物碱化合物。“化合物-靶点-通路”网络结果显示化合物1 和化合物4~9 主要通过基因RXRA、SRC、MAPK1和PIK3R1作用于非小细胞肺癌、肝癌和乳腺癌3 条肿瘤通路。RXRA、SRC、MAPK1 和PIK3R1 蛋白都能够参与细胞的分化、生长与发育等许多关键的生理过程,从而调控肿瘤的发生与发展[15-18]。
吲哚环结构可能是茶藤生物碱化合物发挥抗肿瘤活性的必要结构,不同类型的取代基可能会对吲哚环发挥体外抗肿瘤活性产生不同的影响[19-20]。给电子基,如羟基、甲氧基等,减弱化合物对肿瘤细胞的抗增殖活性;吸电子基,如羰基、酯基等,增强化合物对肿瘤细胞的抗增殖活性[21]。化合物4 由于具有吸电子作用的酯基和平面的五元环结构使得抗肿瘤活性增强,且与蛋白质结合的能量最低,是最具有潜在抗肿瘤活性的化合物。
本研究中所有单萜吲哚生物碱成分均为首次从茶藤中分离得到,丰富了该植物化学成分的多样性。另外,从细胞水平和网络药理学层面初步探讨了这些生物碱化合物的抗肿瘤活性,研究结果为茶藤中抗肿瘤活性成分的发现奠定了基础。后续将在此基础上进行更深入的体外、体内作用机制研究。
利益冲突所有作者均声明不存在利益冲突

