大孔吸附树脂结合斑马鱼评价富集纯化补骨脂总黄酮的工艺研究
罗利霞 ,葛 静 #,李佳妍,李彦东,宋 捷,石子琪,宁 青*,韦英杰*
1.南京中医药大学第三临床医学院,江苏 南京 210028
2.江苏省中医药研究院,国家中医药管理局中药释药系统重点研究室,江苏 南京 210028
3.南京中医药大学附属中西医结合医院,江苏 南京 210028
4.烟台毓璜顶医院药学部,山东 烟台 264000
补骨脂PsoraleaeFructus为豆科补骨脂属植物补骨脂Psoralea corylifoliaLinn.的干燥成熟果实[1],在医药和保健等多领域被广泛应用,临床上用来治疗骨质疏松、白癜风和牛皮癣等病[2],补骨脂化学成分复杂,主要含香豆素类、黄酮类和单萜酚类。目前,从补骨脂中已分离50 余种黄酮类化合物[3],具有抗炎、神经保护作用、肥胖干预和骨质疏松改善等多种生物活性,如补骨脂甲素抑制缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)信号转导产生抗炎作用;新补骨脂异黄酮调节雌激素受体α/β(estrogen receptor α/β,ERα/β)和Runt 相关转录因子2(Runt-related transcription factor 2,Runx2)促进成骨细胞分化;补骨脂二氢黄酮甲醚激动过氧化物酶体增殖物激活受体 γ(peroxisome proliferators-activated receptors γ,PPARγ)以改善胰岛素抵抗和肥胖;corylifol A 抑制人羧酸酯酶2,减少毒性水解代谢物的水解[4-5];补骨脂黄酮提取物能显著提高去卵巢骨质疏松大鼠的股骨松质骨的骨密度[6],能通过激活棕色脂肪细胞中的产热、改善葡萄糖稳态和保护肝脏脂肪变性等来预防肥胖[7-8]。因此,补骨脂黄酮具有较好的应用和研究前景。
现有补骨脂总黄酮纯化方法主要为高速逆流色谱法[9]、聚酰胺柱色谱法[7]、硅胶柱色谱法[7]和大孔吸附树脂法[10-11]:高速逆流色谱法纯化补骨脂黄酮需用到苯、氯仿、正已烷、醋酯乙酯、甲醇等多种有机溶剂,实验设备条件要求高,难于普及,也不适于工业化生产[9]。刘静雯[7]采用聚酰胺柱色谱法和硅胶柱色谱法富集纯化补骨脂总黄酮,除使用乙醇外,尚用到石油醚或醋酸乙酯,工业生产污染大,此外聚酰胺和硅胶填料不能重复利用,生产成本大。大孔吸附树脂法因选择性好、吸附量大、热稳定性好和绿色环保等优点,在总黄酮分离和纯化中被广泛应用[12],孙丽娟等[10]和张晓曦等[11]采用ZTC-1 或LSA-21 大孔吸附树脂色谱法纯化补骨脂总黄酮,筛选的洗脱剂乙醇体积分数差异较大(50%、90%乙醇),此外,2 篇报道均未优选大孔吸附树脂厂家,均未测定终产品总黄酮含量,文献考查因素较少[10](仅上样液体积流量、质量浓度、洗脱液体积流量及醇体积分数)。补骨脂所含黄酮类成分多,结构类型多样(异黄酮、二氢黄酮、黄酮和查耳酮)[3],检测黄酮类代表成分可更确切地反映纯化效果。大孔吸附树脂有机溶剂残留对产品的安全性至关重要,不同厂家大孔吸附树脂的有机溶剂残留存在差异,故有必要优选大孔吸附树脂厂家并考虑其安全性。可见,大孔吸附树脂法纯化补骨脂总黄酮有待进一步深入系统研究。
大孔吸附树脂有机溶剂残留(如苯、甲苯、二甲苯、苯乙烯和二乙基苯等)的安全性问题至关重要,国家药品监督管理局规定需进行相关检测及控制[13]。现有检测方法主要为顶空气相色谱法、气相色谱与质谱联用法,普通实验室常不具备条件,实验所需易致毒对照品的购买和使用不便。生物效应法可直观反应毒/效,但相关研究未见用于大孔吸附树脂有机溶剂残留的安全性评价。斑马鱼具有发育快、个体小、易繁殖、胚胎透明、试验周期短、可在微板中实时动态观察毒性等优点[14],作为一种较理想的模式生物,早在上世纪便应用于毒性评价,广泛用于水质检测、药物毒性评价[15-16]。本研究拟引入斑马鱼评价不同来源大孔吸附树脂醇浸物的安全性,为大孔吸附树脂安全性评价提供快速生物检测方法[16-19]。本研究针对前期大孔吸附树脂纯化补骨脂黄酮相关研究的不足,以补骨脂的黄酮类代表成分(新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚和corylifol A)为指标,优选不同型号大孔吸附树脂,用斑马鱼的形态变化和致死率评价其安全性以优选不同厂家的大孔吸附树脂;进一步系统考察上样药液质量浓度、体积流量、上样量、吸附时间、洗脱剂乙醇体积分数和用量等因素对补骨脂黄酮纯化工艺的影响,比较优选工艺纯化前后黄酮、香豆素和补骨脂酚的含量,以确定所得组分纯度高、生产安全性好、成本低且具有产业化可行性的大孔吸附树脂富集纯化补骨脂总黄酮的生产工艺。
1 仪器与材料
1.1 仪器
Agilent Technologies 1260 高效液相色谱仪,美国Agilent 公司,配DAD 检测器和Agilent Chemstation工作站;AT201 分析天平,瑞士Mettler Toledo 公司;SPX-80 生化培养箱,宁波海曙赛褔实验仪器厂;16 mm×200 mm 玻璃色谱柱,上海禾汽玻璃仪器有限公司;Nikon Eclipse E100 显微镜,日本Nikon 公司;Olympus TG-4 相机,日本Olympus 公司;Spectra MAX190 酶标仪,Molecular Devices 公司。
1.2 实验动物
斑马鱼成鱼,南京尧顺禹生物科技有限公司,来自德国Tuebingen 品系。
1.3 药品与试剂
盐补骨脂,批号160804,购买于南京海源中药饮片有限公司,经江苏省中医药研究院韦英杰研究员鉴定,为豆科补骨脂属植物补骨脂P.corylifoliaLinn.的干燥成熟果实。
对照品补骨脂素(批号110739-201617,质量分数99.7%)和异补骨脂素(批号110738-201614,质量分数99.7%)购自中国食品药品检定研究院;对照品新补骨脂异黄酮(批号DST170522-055,质量分数>98%)、corylifol A(批号DST170522-073,质量分数>98%)、4'-O-甲基补骨脂查耳酮(批号DST170522-052,质量分数>98%)均购自成都德思特生物技术有限公司;补骨脂甲素(又名补骨脂二氢黄酮,批号JZ17031802,质量分数>98%)、补骨脂乙素(又名异补骨脂查耳酮,批号JZ1703180,质量分数>98%)、补骨脂二氢黄酮甲醚(批号JZ16071904,质量分数>98%)、补骨脂定(批号JZ16110406,质量分数>98%)、补骨脂宁(又名补骨脂异黄酮,批号JZ16091204,质量分数>98%)、补骨脂酚(批号JZ16092103,质量分数>98%)均购自南京景竹生物科技有限公司;对照品芦丁(批号100080-201811,质量分数91.7%)购自中国食品药品检定研究院;甲醇(批号21010355,色谱纯)、乙腈(批号17055081,色谱纯)购自美国Tedia 公司;甲酸(批号G1826012,色谱纯)购自阿拉丁试剂有限公司;乙醇(批号P1383736)购买于General-Reagent;NaNO2(批号C10070967)购自上海麦克林试剂有限公司;Al(NO3)3(批号1818048)购自阿拉丁试剂有限公司;NaOH(批号20140510)购自天津博迪化工股份有限公司;大孔吸附树脂D101(批号T02J9x64575)、HPD100(批号T24A9X59689)、AB-8(批号 T02J9X64576)、DM130(批号T11D8X50200)和S-8(批号T13J9X63397)均购买于上海源叶生物科技有限公司。D101 大孔吸附树脂D1~D10 依次来源于上海源叶生物科技有限公司、天津浩聚树脂科技有限公司、国药试剂集团、南开大学化工厂(天津市光复精细化工研究所)、酷尔化学科技(北京)有限公司、郑州和成新材料科技有限公司、陕西乐博生化科技有限公司、沧州宝恩吸附材料科技有限公司、上海麦克林生化科技有限公司和东鸿化工有限公司。
2 方法与结果
2.1 供试液的制备
2.1.1 补骨脂药材提取液的制备 取盐补骨脂(800 g)经水煎后的药渣,加4 倍体积的70%乙醇回流提取2 次,每次1.5 h,滤过,合并滤液,减压回收乙醇至无醇味(约含生药1 g/mL),静置过夜,取沉淀物适量,用30%乙醇溶解,分别制成含生药0.25、0.50、0.75、1.00 g/mL,供大孔吸附树脂纯化用。
2.1.2 大孔吸附树脂优化供试液的制备 取不同条件大孔吸附树脂优化后的样品适量(相当于20 mg生药),加甲醇至1 mL,供大孔吸附树脂工艺优化检测4 种黄酮指标成分(新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚和corylifol A)用。
2.1.3 大孔吸附树脂浸提液的制备 分别称取不同厂家D101 大孔吸附树脂10 g,加40 mL 95%乙醇浸泡,摇匀,1 h 后吸取4 mL 乙醇浸液于试管中,空气吹干备用。临用前加DMSO 适量使溶解,加培养基分别稀释成高(大孔吸附树脂0.5 g/mL)、中(大孔吸附树脂0.25 g/mL)和低(大孔吸附树脂0.125 g/mL)质量浓度溶液,供斑马鱼毒性评价用。
2.2 指标成分含量的测定
2.2.1 色谱条件 色谱柱为Zorbax C18柱(250 mm×4.6 mm);进样量10 μL;体积流量1 mL/min;柱温25 ℃;检测波长246 nm;流动相为0.1%甲酸水溶液-乙腈,梯度洗脱:0~30 min,10%~50%乙腈;30~45 min,50%~60%乙腈;45~50 min,60%~70%乙腈;50~55 min,70%~80%乙腈;55~65 min,80%乙腈。补骨脂醇提液、补骨脂总黄酮提取物和混合对照品的HPLC 色谱图如图1 所示。

图1 补骨脂醇提液 (A)、补骨脂总黄酮提取物 (B) 和混合对照品 (C) 的HPLC 图Fig.1 HPLC of ethanol extract of Psoraleae Fructus (A),total flavonoids extract of Psoraleae Fructus (B),and mixed standards (C)
2.2.2 线性关系考察 分别精密称取补骨脂素、异补骨脂素、新补骨脂异黄酮、补骨脂甲素、补骨脂宁、补骨脂定、补骨脂乙素、补骨脂二氢黄酮甲醚、corylifol A、4'-O-甲基补骨脂查耳酮和补骨脂酚适量,加甲醇分别配制质量浓度为95.00、108.00、96.30、60.80、51.00、48.00、55.10、53.63、72.88、26.13、300.00 μg/mL 的对照品母液,用2 倍稀释法依次稀释对照品母液,得质量浓度相当于母液质量浓度1/2、1/4、1/8、1/16、1/32、1/64、1/128、1/256的系列对照品溶液,分别精密吸取对照品母液10、20、40 µL 以及系列对照品溶液10 µL,注入液相色谱仪,按照“2.2.1”项色谱条件测定。根据对照品质量浓度(X)与检测峰面积(Y)得到回归方程及线性范围分别为新补骨脂异黄酮[18]Y=38.798X+26.505,r=0.999 6,线性范围0.75~192.60 μg/mL;补骨脂甲素[18]Y=22.580X+20.061,r=0.999 7,线性范围1.90~243.20 μg/mL;补骨脂二氢黄酮甲醚[18]Y=24.269X+7.691,r=0.999 8,线性范围1.68~214.52 μg/mL;corylifol A[18]Y=36.361X+19.620,r=0.999 8,线性范围1.14~291.52 μg/mL;补骨脂宁Y=89.313X-67.917,r=0.999 8,线性范围3.19~51.00 μg/mL;补骨脂定Y=17.456X-10.242,r=0.999 8,线性范围3.00~48.00 μg/mL;补骨脂乙素Y=28.72X-44.342,r=0.998 8,线性范围3.44~55.10 μg/mL;4'-O-甲基补骨脂查耳酮Y=21.016X-20.713,r=0.995 0,线性范围1.63~26.13 μg/mL;补骨脂素[18]Y=57.701X+32.075,r=0.999 6,线性范围0.74~95.00 μg/mL;异补骨脂素[18]Y=54.822X+71.640,r=0.999 7,线性范围0.84~216.00 μg/mL;补骨脂酚[18]Y=19.427X+113.510,r=0.999 2,线性范围2.34~600.00 μg/mL。
2.2.3 方法学考察结果 补骨脂素、异补骨脂素、新补骨脂异黄酮、补骨脂甲素、补骨脂宁、补骨脂定、补骨脂乙素、4'-O-甲基补骨脂查耳酮、补骨脂二氢黄酮甲醚、corlyfol A 和补骨脂酚的RSD,在重复性试验中分别为3.3%、1.7%、2.9%、3.1%、5.8%、5.5%、4.7%、5.3%、2.9%、2.9%、3.0%;在精密度试验中分别为0.6%、0.8%、1.5%、2.2%、3.8%、5.0%、2.8%、5.7%、0.8%、2.8%、0.2%;在稳定性试验中分别为2.9%、2.4%、2.3%、2.9%、3.2%、3.7%、3.3%、3.3%、1.9%、2.7%、0.9%;在准确度试验中分别为3.8%、2.5%、8.4%、2.2%、8.7%、2.2%、3.5%、10.0%、5.6%、10.2%、6.4%;在准确度试验中平均加样回收率分别为108.8%、106.5%、103.2%、103.1%、91.0%、91.2%、96.4%、110.9%、93.3%、90.9%、99.6%。
2.3 总黄酮含量的测定
精密称定芦丁对照品10 mg,加乙醇制成0.40 mg/mL 的溶液,分别取适量体积于25 mL 量瓶中,加水稀释至不同质量浓度的对照品溶液(总体积为6 mL),加5% NaNO2溶液1 mL 混匀,静置6 min,加10% Al(NO3)3溶液1 mL 混匀,静置6 min,加NaOH 试液(取氢氧化钠4.3 g,使溶解成100 mL,即得)10 mL,加水定容摇匀,静置15 min,在500 nm 波长处测定吸光度(A)值,以A值与对照品质量浓度(X)进行线性回归,得回归方程A=0.007 2X-0.027 3,r=0.999 2,线性范围为16.94~84.70µg/mL。
2.4 总黄酮富集纯化工艺优化
2.4.1 大孔吸附树脂类型的筛选
(1)静态吸附和解吸附实验:95%乙醇浸泡D101、AB-8、DM130、S-8、HPD100 大孔吸附树脂24 h 后,95%乙醇淋洗,再用蒸馏水淋洗至洗出液无醇味和不显浑浊。分别取预处理好的5 种大孔吸附树脂各10 mL,置三角瓶中,加入质量浓度为0.5 g/mL 的补骨脂提取液10 mL,每隔30 min 振摇10 s,使大孔吸附树脂与补骨脂提取液充分接触,2 h 后取未吸附上清液;弃去未吸附液,加入90%乙醇10 mL,振荡器中振摇2 h 进行解吸附,取解吸附上清液。取样未吸附液和解吸附液适量(20 mg 生药量),进样10 µL,进行HPLC 测定,记录4 种黄酮类代表成分(新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚和corylifol A)的峰面积,计算静态吸附率和静态解吸附率。
静态吸附率=(上样溶液中某成分峰面积-未吸附液中某成分峰面积)/上样溶液中某成分峰面积
静态解吸附率=解吸附液中某成分峰面积/(上样溶液中某成分峰面积-未吸附液中某成分峰面积)
5 种不同型号大孔吸附树脂静态吸附和解吸能力结果见表1,D101、AB-8 与DM130 大孔吸附树脂对4 种黄酮类代表成分的静态吸附率均较高(94%以上),平均值均大于97%,吸附能力均较好且相近;HPD100 大孔吸附树脂对补骨脂甲素的吸附能力较弱(76.1%);S-8 对4 种黄酮的静态吸附率均相对较低(84.4%~95.3%)。3 种吸附力较好的大孔吸附树脂D101、AB-8 与DM130 对4 种黄酮的解吸附力以D101 与DM130 为优。

表1 不同型号大孔吸附树脂对黄酮类代表成分的静态吸附率与静态解吸附率Table 1 Static adsorption rate and desorption rate of representative components of flavonoids with different types of macroporous adsorption resins
(2)动态吸附和解吸附实验:取预处理好的D101、AB-8、DM130、S-8 和HPD100 大孔吸附树脂各10 mL,装入不同色谱柱,以0.5 g/mL 补骨脂提取液10 mL 上样,30%乙醇清洗树脂中未被吸附成分,一并收集流出液。后用2 倍柱体积(BV)90%乙醇洗脱,收集洗脱液。取流出液和洗脱液适量(20 mg 生药量),HPLC 测定并记录4 种黄酮类代表成分的峰面积,计算动态吸附率和动态解吸附率。
动态吸附率=(上样溶液中某成分峰面积-上样流出液中某成分峰面积)/上样溶液中某成分峰面积
动态解吸附率=90%乙醇洗脱液中某成分峰面积/(上样溶液中某成分峰面积-上样流出液中某成分峰面积)
5 种不同型号大孔吸附树脂对补骨脂黄酮类代表成分的动态吸附率与动态解吸附率见表2,D101、DM130 和HPD100 大孔吸附树脂对黄酮类成分的动态吸附率均较高(大于95%),其次为AB-8 和S-8;S-8 的动态解吸附率最高,其次是解吸附能力相近的D101 和AB-8,HPD100 和DM130 相对较低。
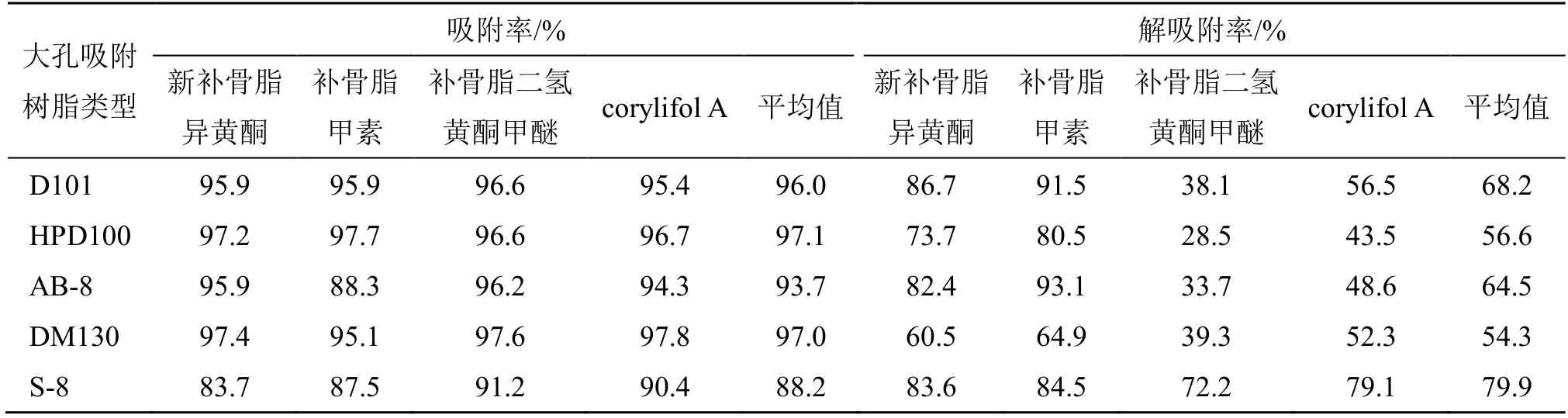
表2 不同型号大孔吸附树脂对黄酮类代表成分的动态吸附率与动态解吸附率Table 2 Dynamic adsorption rate and desorption rate of representative components of flavonoids with different types of macroporous adsorption resins
静态和动态的吸附与解吸附实验结果表明,D101 兼具较好的吸附和解吸附能力,且价低易得,应用范围广,故选择D101 为最佳吸附树脂。
2.4.2 D101 大孔吸附树脂厂家的筛选 不同厂家来源的大孔吸附树脂有化学纯和分析纯等级别,常见的苯、甲苯、二甲苯、苯乙烯和二乙烯苯等致癌有机溶剂残留不同,通常导致终产品的有机溶剂残留不同,常用GC-MS 法测定。本研究通过比较斑马鱼致畸和致死效果快速评价不同厂家D101 大孔吸附树脂的相对安全性。收集斑马鱼成鱼自然交配产生的胚胎,置培养基中于28 ℃培养箱中培养24 h。取受精后1 d(days after fertilization,dpf)斑马鱼胚胎(1 dpf),置24 孔板中,每孔8 个胚胎,每组平行2 孔,分别暴露于不同质量浓度的大孔吸附树脂浸提液中,用95%乙醇按“2.1”项大孔吸附树脂浸提液的制备方法制备得的培养基(含4 mL 95%乙醇挥干物/mL)作对照组。每天计数鱼死亡数量并计算死亡率,显微镜观察并记录3~6 dpf 鱼的形态。参考文献报道方法评价斑马鱼形态[20],见表3。

表3 斑马鱼形态变化评价Table 3 Evaluation of morphological changes in zebrafish
(1)不同厂家D101 大孔吸附树脂浸液对斑马鱼形态影响:结果见表4 和图2,培养基对照组斑马鱼幼鱼(3 dpf)正常孵出,体节明显可见,心包无水肿;与对照组相比,经不同厂家D101 大孔吸附树脂醇浸液培养后,斑马鱼中毒程度基本呈浓度相关性,出现的畸形特征有心包水肿、卵黄囊肿胀或发黑和身体弯曲等。

图2 不同厂家大孔吸附树脂醇浸提液对斑马鱼幼鱼 (3 dpf) 形态的影响Fig.2 Effects of ethanol extracts of macroporous adsorptive resin from different manufacturers on morphology of zebrafish(3 dpf)

表4 不同厂家大孔吸附树脂不同质量浓度浸提液对斑马鱼幼鱼 (3 dpf) 形态的影响Table 4 Effects of different mass concentrations of macroporous adsorptive resins extracts from different manufacturers on morphology of zebrafish (3 dpf)
D2、D5、D6 大孔吸附树脂的低(大孔吸附树脂0.125 g/mL)和中(大孔吸附树脂0.250 g/mL)质量浓度组斑马鱼未显示或显示轻微变化,高(大孔吸附树脂0.500 g/mL)质量浓度组斑马鱼显示轻度或中度畸形;D10 大孔吸附树脂的低与中质量浓度组、D7、D8、D9 大孔吸附树脂不同质量浓度组的斑马鱼幼鱼未孵化出,提示发育迟缓或异常;D3大孔吸附树脂浸液对斑马鱼的致畸性呈较明显的质量浓度相关性;中和高质量浓度的D1 和D4 的大孔吸附树脂浸液都致斑马鱼3 d 全部死亡,提示对斑马鱼胚胎有较大的发育毒性。
(2)不同厂家D101 大孔吸附树脂浸液对斑马鱼胚胎的时-量-毒关系:结果如表5 所示。D5 大孔吸附树脂醇浸液在考察质量浓度范围内未致斑马鱼胚胎死亡,D2、D6、D10 大孔吸附树脂各质量浓度对斑马鱼胚胎累积死亡率均小于20%,为安全质量浓度[21];D7、D8、D9 大孔吸附树脂给药期间致斑马鱼死亡率为20%~75%;D1、D3(除低质量浓度外)、D4 大孔吸附树脂致斑马鱼死亡率均达100%,呈时间相关性。综合斑马鱼形态变化和存活率的结果,不同厂家大孔吸附树脂醇浸液对斑马鱼胚胎发育的急性毒性由大到小顺序初步为D1>D4>D3>D7、D9>D8>D10>D6>D2、D5。提示D2 和D5厂家的D101 大孔吸附树脂安全性最好。
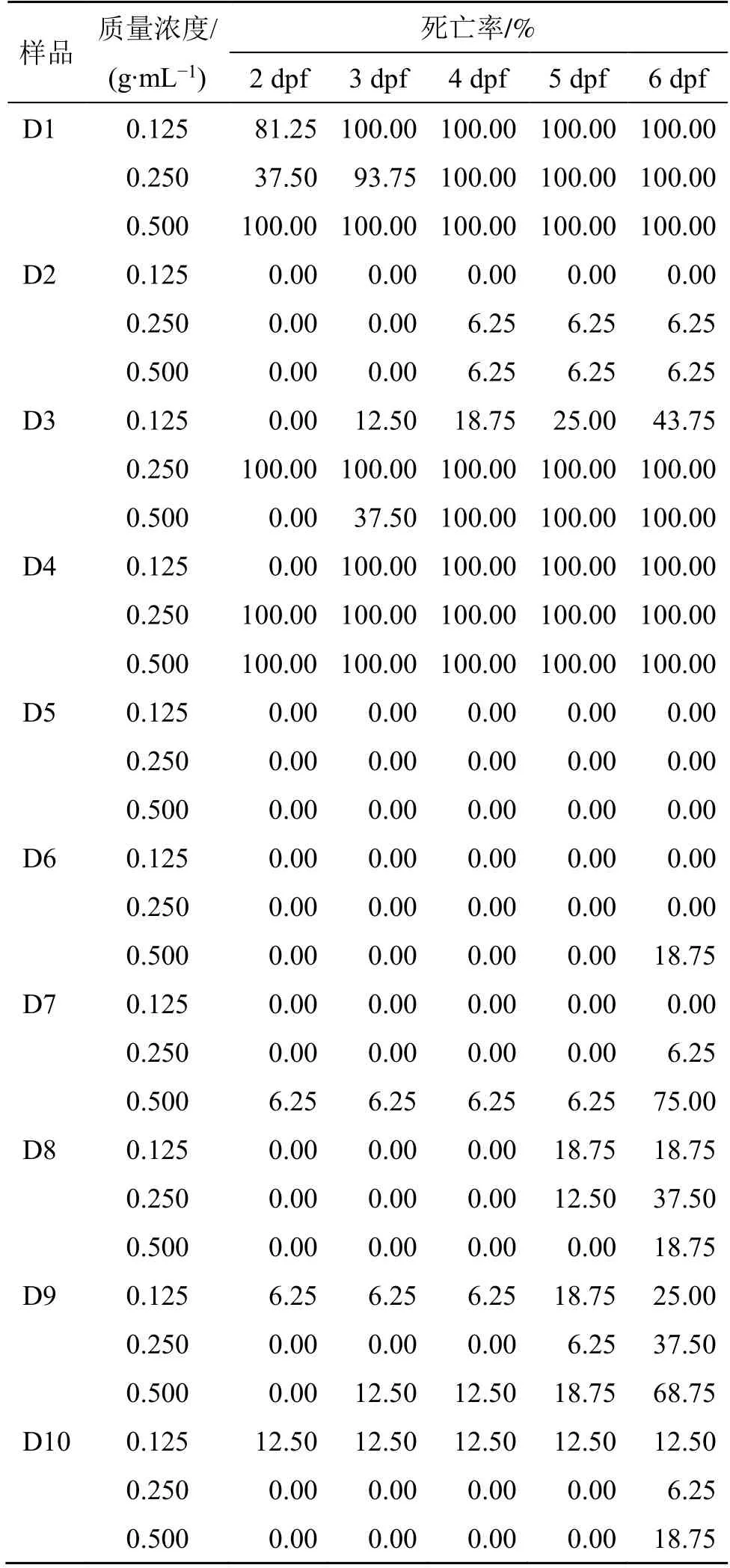
表5 不同厂家D101 大孔吸附树脂不同质量浓度醇浸提液致斑马鱼死亡的时-量-毒关系Table 5 Time-quantity-toxicity relationship of zebrafish death caused by ethanol extracts of D101 macroporous adsorptive resin from different manufacturers with different mass concentrations
2.4.3 大孔吸附树脂纯化补骨脂总黄酮工艺参数考察
(1)吸附时间考察:取D101 大孔吸附树脂(天津浩聚树脂科技有限公司,下同)10 mL 湿法装柱,加0.5 g/mL 补骨脂提取液10 mL,以1 mL/min 体积流量上样,分别吸附0、0.5、1.0、1.5、2.0 h,之后用30%乙醇清洗大孔吸附树脂中未被吸附的成分,收集流出液,取样(20 mg 生药量,进样10 μL,下同)测定4 种黄酮成分,记录峰面积,计算吸附率。结果如表6 所示,D101 大孔吸附树脂在不同吸附时间对4 种黄酮指标成分的吸附率均大于92%,相差不大。在动态吸附过程中,黄酮成分平均吸附率随时间增加逐步增大,在1.5 h 时吸附率最高,故确定最佳吸附时间为1.5 h。

表6 不同吸附时间的黄酮类代表成分吸附率Table 6 Adsorption rate of representative components of flavonoids with different adsorption time
(2)上样药液质量浓度考察:取D101 大孔吸附树脂10 mL 湿法装柱,分别以1 mL/min 的体积流量各质量浓度(0.25、0.50、0.75、1.00 g/mL)的补骨脂提取液10 mL 进行动态吸附,后用等量的30%乙醇以等体积流量清洗大孔吸附树脂中未被吸附的成分,一并收集流出液,取样测定4 种黄酮成分,记录峰面积,计算吸附率。结果如表7 所示,D101 大孔吸附树脂对0.25~1.00 g/mL 药液的4 种黄酮指标成分吸附率均在85%以上,其中黄酮成分平均吸附率随质量浓度增大而先上升后下降,0.50 g/mL 时的平均吸附率较高。

表7 不同药液质量浓度的黄酮类代表成分吸附率Table 7 Adsorption rate of representative components of flavonoids by different mass concentration solution
(3)上样药液体积流量考察:以0.5 g/mL 补骨脂提取液1 BV 分别控制体积流量为0.5、1.0、2.0、4.0 mL/min 进行吸附。之后用等量的30%乙醇以等体积流量清洗大孔吸附树脂中未被吸附的成分,收集流出液,取样测定4 种黄酮成分,记录峰面积,计算吸附率。如表8 所示,吸附体积流量在0.5~4.0 mL/min 时,4 种黄酮指标成分吸附率均较高(大于92%),在0.5、1.0 mL/min 时黄酮成分平均吸附率均大于97%,体积流量大于1.0 mL/min 时,各成分吸附率均降低。综合各成分的吸附效果及提高生产效率,拟确定体积流量为1.0 mL/min。

表8 不同吸附体积流量的黄酮类代表成分吸附率Table 8 Adsorption rate of representative components of flavonoids by different flow rate
(4)洗脱剂乙醇体积分数考察:按照已经确定的条件湿法装柱及上样进行动态吸附。1 BV 30%乙醇洗去大孔吸附树脂柱中未被吸附的成分,再分别用2 BV 的不同体积分数乙醇(30%、50%、70%、90%)以相同的体积流量洗脱,收集洗脱液,取样测定4 种黄酮成分,记录峰面积,外标法计算含量,计算解吸附量。结果如表9 所示,30%~50%乙醇对目标黄酮成分的解吸附量基本为0,乙醇体积分数大于50%时,乙醇体积分数越高,目标黄酮成分的解吸附量越大,90%乙醇时解吸附量最大,提示以90%乙醇洗脱为优。
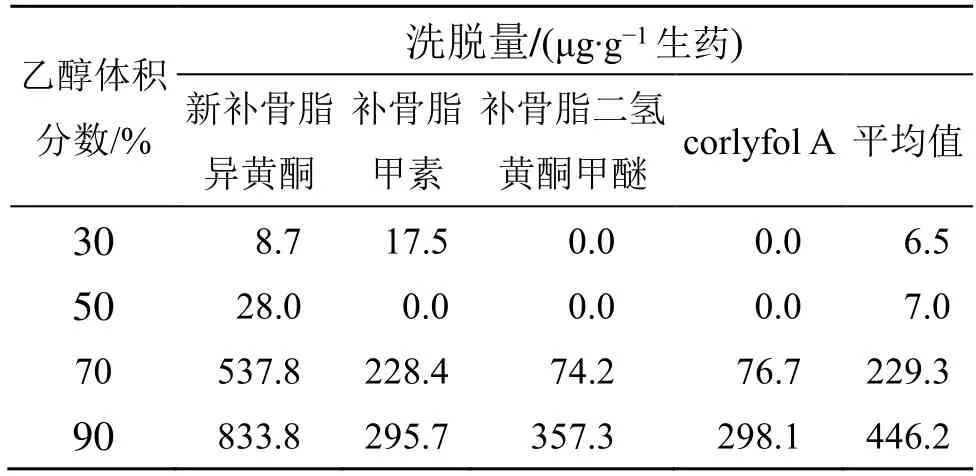
表9 不同乙醇体积分数的黄酮类代表成分洗脱量Table 9 Elution amount of representative components of flavonoids with different ethanol volume fraction
(5)最大上样量考察:取D101 大孔吸附树脂10 mL 湿法装柱,补骨脂提取液以1 mL/min 的体积流量上样,分别以0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0 BV 上样,收集泄漏流分,取样测定4 种黄酮成分,记录峰面积,外标法计算含量。结果如表10 所示,4 种黄酮类指标成分的泄露量随着上样量的增加呈增加趋势,上样量为0.6 BV 时泄漏量最低,增加至1.0~1.4 BV 时,平均泄漏量基本不变;大于1.4 BV 时,新补骨脂异黄酮和补骨脂甲素泄露量则显著上升,考虑到实际生产效率,选择上样量为1.0 BV(10 mL)。
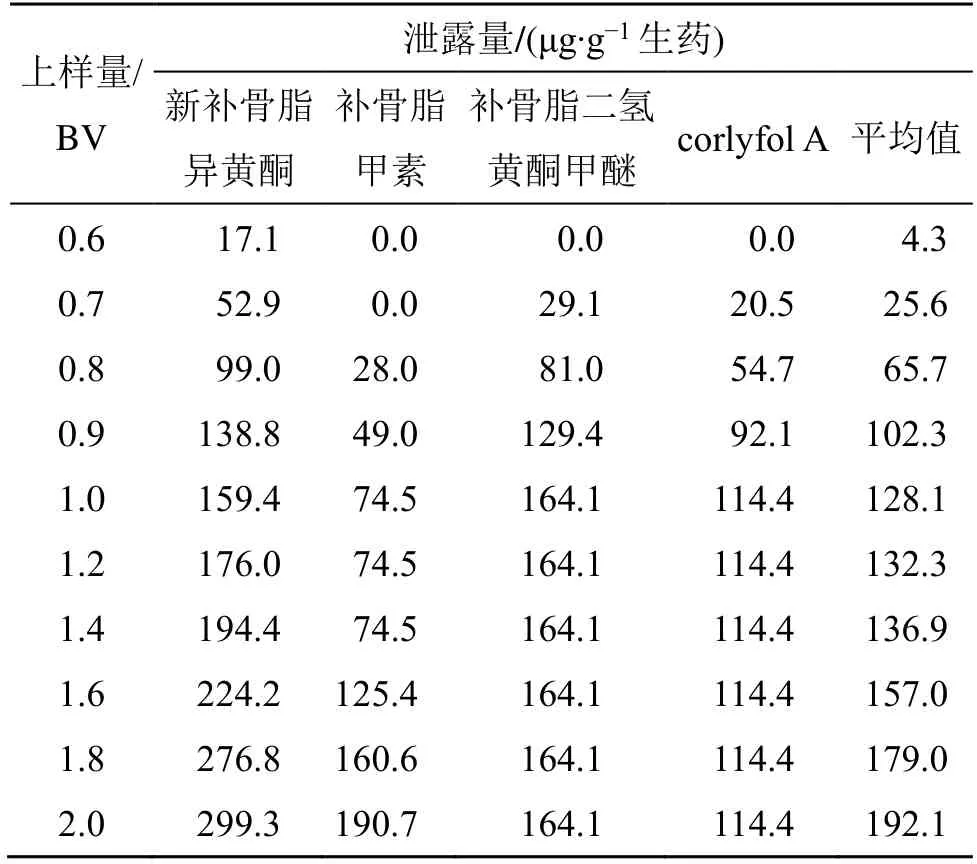
表10 不同上样量的黄酮类代表成分泄露量Table 10 Leakage amount of representative components of flavonoids with different sample volumes
(6)洗脱剂用量考察:按照已经确定的条件湿法装柱及上样,1 BV 30%乙醇洗去大孔吸附树脂中未被吸附的成分,用不同体积(1、2、3、4、5、6、7、8、9、10 BV)90%乙醇进行洗脱,收集洗脱液,取样测定4 种黄酮成分,记录峰面积,外标法计算含量。取4 BV 与7 BV 洗脱液浓缩和干燥,得补骨脂总黄酮提取物粉末,分别精密称取适量,加甲醇配制成200 μg/mL 的供试品溶液,HPLC 法测定4种黄酮成分,记录峰面积,外标法计算含量。
结果如表11 所示,洗脱剂用量在第1、2 个BV时,目标黄酮成分的洗脱量最大(120~650 μg/g 生药);后随着洗脱剂用量增加,洗脱量降低,在第4个BV 时降至30~110 μg/g 生药;至第7 BV 时,各黄酮类代表成分洗脱近完全。对4 BV 与7 BV 洗脱量进行比较,测定所得黄酮提取物干粉的 4 种指标成分含量和相当,分别为25.3%和25.8%,考虑节约成本,选择4 BV 进行洗脱。

表11 不同洗脱体积的黄酮类代表成分洗脱量Table 11 Elution amount of representative components of flavonoids with different elution volume
2.4.4 大孔吸附树脂纯化补骨脂总黄酮工艺验证实验 取预处理好的D101 大孔吸附树脂10 mL 湿法装柱,加0.5 g/mL 补骨脂提取液1 BV 上样,以1 mL/min 体积流量吸附,吸附1.5 h 后,用30%乙醇1 BV 洗去未被吸附的成分,用4 BV 90%乙醇洗脱,收集洗脱液,浓缩干燥得补骨脂总黄酮提取物。按以上工艺重复3 次。
精密称取大孔吸附树脂纯化前后提取物10 mg,加甲醇配制成200 μg/mL 的供试品溶液,进样10 μL,进行HPLC 测定,记录峰面积,外标法计算8 种黄酮类成分、补骨脂素、异补骨脂素和补骨脂酚含量。另以芦丁为对照品,精密量取补骨脂总黄酮提取物供试液2 mL(精密称取补骨脂总黄酮提取物10 mg,加乙醇制成2 mg/mL 的溶液)于25 mL量瓶中,加水4 mL,按“2.3”项下用紫外-可见分光光度法测定并计算提取中物总黄酮含量。
测定了大孔吸附树脂纯化验证试验总黄酮提取物中新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚、corylifol A、补骨脂宁、补骨脂定、补骨脂乙素、4'-O-甲基补骨脂查耳酮、补骨脂素和异补骨脂素(黄酮类和香豆素类),以及补骨脂酚的含量,并与树脂纯化前的醇提物进行比较,以各成分含量占所测成分含量总和的百分比作为相对百分含量。
结果(图1 和表12)表明,大孔吸附树脂纯化前,补骨脂醇提物中以补骨脂酚为主,相对百分含量约为60%,黄酮成分的相对百分含量约为33%,香豆素类含量最低,约为7%;大孔吸附树脂纯化可有效提高黄酮成分的含量,纯化后的新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚、corylifol A、补骨脂宁、补骨脂定、补骨脂乙素和4'-O-甲基补骨脂查耳酮的质量分数分别为9.39%、4.82%、6.03%、4.99%、0.68%、6.74%、5.36%、2.75%,各黄酮成分纯化后含量约是纯化前的1.3~5.1 倍,8 种黄酮成分含量和(平均值40.76%)约是纯化前(14.13%)的3 倍,黄酮成分总量的相对百分含量提高至约93.6%,同时有效去除补骨脂酚,香豆素类成分含量变化不大。以芦丁为对照品,通过紫外-可见分光光度法测得总黄酮含量约为54%。结果表明,采用D101 大孔吸附树脂富集纯化补骨脂总黄酮的工艺稳定可行。
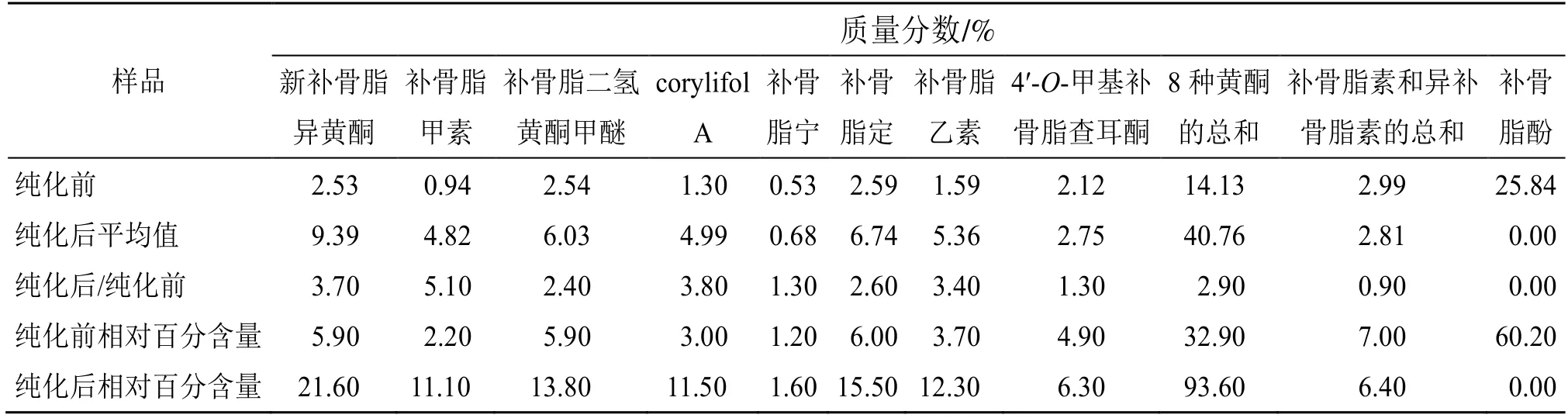
表12 大孔吸附树脂分离纯化前后补骨脂提取物中黄酮类代表成分、香豆素及补骨脂酚含量Table 12 Contents of representative components of flavonoids,coumarins and bakuchiol of Psoraleae Fructus before and after purification with macroporous adsorptive resin
3 讨论
通过比较极性(S-8)、弱极性(AB-8 和DM130)和非极性(D101 和HPD100)5 种型号大孔吸附树脂对补骨脂的黄酮类代表成分(新补骨脂异黄酮、补骨脂甲素、补骨脂二氢黄酮甲醚和corylifol A)的静态、动态吸附率和解吸附率,优选出非极性D101大孔吸附树脂,该型号树脂价廉易得,普适性强,易于推广应用。
不同厂家D101 大孔吸附树脂醇浸物对斑马鱼的形态和死亡率影响不同,能直观和客观反应毒性大小,实验在微孔板中进行,周期短(6 d),可实时动态观察,简单高效。不同来源大孔吸附树脂安全性差异与其有机溶剂残留密切相关,斑马鱼评价为大孔吸附树脂安全性提供生物检测法依据。
异黄酮和二氢黄酮均为补骨脂主要黄酮结构类型,本研究以2 种二氢黄酮(补骨脂甲素和补骨脂二氢黄酮甲醚)和2 种异黄酮(新补骨脂异黄酮和corylifol A)为指标,含量相对较高,极性差异较大,具有代表性,较紫外-可见分光光度法测定总黄酮指标更明确。补骨脂醇提物主要含有补骨脂酚(约60%)、黄酮类(约33%)和少量香豆素(约7.0%),其中补骨脂酚是补骨脂致毒关键成分[18],有必要比较3 类成分纯化前后的含量。用HPLC 法测定8 种黄酮、2种香豆素和补骨脂酚的含量,结果表明D101大孔吸附树脂纯化可有效提高黄酮成分含量同时去除高毒成分补骨脂酚,纯化后8 种黄酮成分含量和(平均值40.76%)约是纯化前(14.13%)的3 倍,各黄酮成分纯化后含量约是纯化前的1.3~5.1 倍,黄酮成分总量占所测成分的百分量由32.9%提高至约93.6%,2 种香豆素含量(补骨脂素和异补骨脂素)在纯化前后的相对量均较低(7.0%和6.4%)。另用紫外-可见分光光度法测定纯化后总黄酮含量约为54%。
综上,本研究选择D101 大孔吸附树脂纯化补骨脂总黄酮成本低,安全性好,制备总黄酮含量高,大孔吸附树脂吸附和洗脱过程中仅用无毒乙醇做溶媒,产业化前景好,为中药黄酮成分的富集纯化提供参考。
利益冲突所有作者均声明不存在利益冲突

