基于HPLC 指纹图谱和LC-Q-TOF/MS 的加味黄芪桂枝五物汤化学成分研究
汤书婉,李新亮,马 莉,郑云枫*,李存玉,成小兰,曹 鹏,,彭国平*
1.南京中医药大学,江苏 南京 210000
2.南京中医药大学附属中西医结合医院,江苏 南京 210000
加味黄芪桂枝五物汤(Jiawei Huangqi Guizhi Wuwu Decoction,JHD)是由经典名方黄芪桂枝五物汤与芍药甘草汤衍化而来,由黄芪、桂枝、生姜、大枣、白芍、甘草6 味药组成。具有益气温经、和血通痹之功效,主治血痹阴阳俱微、寸口关上微、尺中小紧、外证身体不仁,如风痹状[1]。现代研究表明,该方能显著预防化疗药物奥沙利铂引起的外周神经病变,有效保护外周神经元线粒体稳态,降低化疗引起的神经元损伤[2-3],减轻肿瘤患者在临床治疗时的疼痛,具有良好的临床应用前景。
JHD 组方中涉及的药味较多,成分复杂[4-5],增加了质量控制标准建立的难度。物质基础是制剂质量控制的关键[6],通过指标成分的含量检测或特征图谱的单一手段,难以体现复方制剂质量控制体系的科学性和全面性[7-8]。液质联用技术具有高效、高分辨率、高灵敏度等优点,已广泛应用于中药复方的化学成分分析。本研究基于HPLC 建立了JHD 的指纹图谱,同时采用LC-Q-TOF/MS 技术,结合对照品指认与文献报道,对指纹图谱中的共有峰进行定性鉴别,进一步对各共有成分的归属进行了解析,以期为JHD 的新药开发奠定基础。
1 仪器与材料
1.1 仪器
Waters e2695 型高效液相色谱仪、2998 PDA 检测器(美国Waters 公司);AB SCIEX Triple TOFTM5600 型高分辨质谱仪(美国AB SCIEX 公司);SCIENTZ-10ND 型真空冷冻干燥机(宁波新芝生物科技股份有限公司);梅特勒MS-105DU 1/10 万电子天平(梅特勒-托利多仪器有限公司);TG16 A-WS型离心机(南京以马内利仪器设备有限公司);DW-0.25K 型智能数显恒温电热套(南通市通州畅通电热器厂)。
1.2 材料
对照品毛蕊异黄酮苷(批号111920-201606,质量分数97.6%)、芒柄花素(批号111703-201504,质量分数97.5%)、黄芪甲苷(批号110781-201717,质量分数96.9%)、桂皮醛(批号110710-201821,质量分数99.6%)、甘草苷(批号111610-201908,质量分数95.0%)、甘草酸铵(批号110731-201619,质量分数93.0%)、6-姜辣素(批号111833-201806,质量分数99.9%)、8-姜酚(批号111993-201601)、10-姜酚(批号111994-201501)、芍药苷(批号110736-201943,质量分数95.1%)均购自中国食品药品检定研究院;对照品毛蕊异黄酮(批号JBZ-0786)、芒柄花苷(批号JBZ-0778)、黄芪皂苷I(批号JBZ-0501)、异甘草苷(批号JBZ-1503)、芹糖甘草苷(批号JBZ-1725)、芹糖异甘草苷(批号JBZ-0996)均购自南京金益柏生物科技有限公司(质量分数≥98%);丙二酰毛蕊异黄酮苷、丙二酰芒柄花苷、丙二酰黄芪皂苷I、乌拉尔皂苷B、甘草皂苷G2 均由实验室前期分离纯化获得[9-10],经HPLC 分析,质量分数≥98%。乙腈(色谱纯,美国Tedia 公司);甲酸(色谱纯,德国Merck公司);超纯水(Milli-Q超纯水系统制备);其余试剂均为分析纯。
6 种饮片均经南京中医药大学严辉副教授鉴定,黄芪为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus (Bge.)Hsiao 的干燥根;桂枝为樟科植物肉桂Cinnamomum cassiaPresl 的干燥嫩枝;白芍为毛茛科芍药属植物芍药Paeonia lactifloraPall.的干燥根;生姜为姜科植物姜Zingiber officinaleRose.的新鲜根茎;大枣为鼠李科植物枣Ziziphus jujubeMill.的干燥成熟果实;甘草为豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎。并依照《中国药典》2020 年版各项下方法检测,饮片质量均符合规定,样品信息见表1。

表1 药材产地及批号Table 1 Batch number of origin of medicinal materials
2 方法与结果
2.1 色谱与质谱条件
2.1.1 色谱条件 采用Hypersil ODS 色谱柱(250 mm×4.6 mm,5 μm);以乙腈(A)-0.2%甲酸(B)为流动相,梯度洗脱程序为:0~25 min,15%~32%A;25~60 min,32%~70% A;检测波长250 nm,体积流量1.0 mL/min,柱温30 ℃,进样量10 μL。
2.1.2 质谱条件 离子源为电喷雾离子化源(ESI),采用正、负离子模式检测;扫描范围m/z50~1500;喷雾电压5500 V;离子喷雾空载电压5500 V;解簇电压100 V;碰撞能量10 V;离子源温度550 ℃;雾化器压力413 kPa;辅助加热器压力413 kPa;气帘气压力275 kPa。
2.2 对照品溶液的制备
取对照品毛蕊异黄酮、毛蕊异黄酮苷、芒柄花素、芒柄花苷、丙二酰毛蕊异黄酮苷、丙二酰芒柄花苷、丙二酰黄芪皂苷I、黄芪皂苷I、黄芪甲苷、桂皮醛、甘草苷、甘草酸铵、6-姜辣素、8-姜酚、10-姜酚、芍药苷、异甘草苷、芹糖甘草苷、芹糖异甘草苷、乌拉尔皂苷B、甘草皂苷G2 适量,精密称定,加甲醇适量,混匀,配制成混合对照品母液。
2.3 供试品溶液的制备
称取黄芪90 g、生姜45 g、桂枝45 g、白芍45 g、大枣45 g、甘草30 g,回流提取2 次,第1 次加入10 倍量水,提取2 h,滤过;第2 次加入8 倍量水,提取1 h,滤过,合并滤液。60 ℃减压浓缩至含生药2 g/mL,真空冷冻干燥12 h,粉碎成中粉。精密称取冻干粉末1.0 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25 mL,密塞,称定质量,超声处理(功率240 W、频率45 kHz)15 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过。取续滤液,0.22 μm 微孔滤膜滤过,即得。
2.4 方法学考察
2.4.1 精密度试验 取S1 号样品,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件连续进样6次,以19号峰的保留时间和峰面积作为参考,计算各共有峰的相对保留时间和相对峰面积。20 个共有峰相对保留时间的RSD 小于1%,相对峰面积的RSD 小于3%,表明仪器和试验方法精密度良好。
2.4.2 重复性试验 取S1 号样品6 份,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别进样,以19 号峰的保留时间和峰面积作为参考,计算各共有峰的相对保留时间和相对峰面积。20 个共有峰相对保留时间的RSD 小于1%,相对峰面积的RSD 小于5%,表明该方法重复性良好。
2.4.3 稳定性试验 取S1 号样品,按“2.3”项下方法制备供试品溶液,分别在0、2、4、8、12、24 h 内按“2.1”项下色谱条件进行测定,以19 号峰的保留时间和峰面积作为参考,计算各共有峰的相对保留时间和相对峰面积。20 个共有峰相对保留时间的RSD 小于1%,相对峰面积的RSD 小于3%,说明供试品溶液在24 h 内稳定性良好。
2.5 指纹图谱的建立
2.5.1 共有峰标记 以“2.3”项下方法制备的10批JHD 供试品溶液,按“2.1”项下色谱条件测定,将数据导入“中药色谱指纹图谱相似度评价系统”2012 版软件进行分析,共选取20 个共有峰,对照图谱采用“中位数”法生成,使用多点校正对色谱峰进行匹配。JHD 的HPLC 对照指纹图谱见图1,10 批供试品溶液的指纹图谱见图2。

图1 JHD 的HPLC 对照指纹图谱Fig.1 Reference HPLC fingerprint of JHD

图2 10 批JHD 的HPLC 指纹图谱Fig.2 HPLC fingerprints of 10 batches of JHD
2.5.2 相似度评价 10 批JHD 与对照指纹图谱相似度分别为0.920~0.990,具体数据见表2。

表2 10 批JHD 的指纹图谱相似度Table 2 HPLC fingerprints of 10 batches of JHD
2.5.3 共有峰的指认及相关分析 按“2.3”项下方法制备的各单味药供试品溶液,以及缺少各单味药的阴性供试品溶液(S1 中各批次单味药及阴性样品),以“2.1”项下色谱条件进行测定,见图3,通过比对其保留时间、阴性样品色谱图,确定JHD 指纹图谱中的20 个特征峰在6 味药材中的归属,并与混合对照品溶液比对,确定了其中11 个成分,其中3(毛蕊异黄酮苷)、7(丙二酰毛蕊异黄酮苷)、11(芒柄花苷)号峰来源于黄芪;9、12、13、14(桂皮醛)、17 号峰来源于桂枝;1、2(芍药苷)、6、8号峰来源于白芍;4(芹糖甘草苷)、5(甘草苷)、10(芹糖异甘草苷)、15、16、18(甘草皂苷G2)、19(甘草酸)、20(乌拉尔甘草B)号峰来源于甘草。

图3 单味药与JHD 的HPLC 指纹图谱对比Fig.3 Comparison of HPLC fingerprints of single herb and JHD
2.6 质谱定性分析
为了更为全面地解析JHD中化学成分的组成,采用LC-Q-TOF/MS 正、负离子模式获得JHD 指纹图谱中化合物的质谱信息见图4,并采用对照品对色谱峰进行确认,同时结合处方中各药材化学成分研究相关文献报道[11-17],建立了各单味药成分的化合物数据库,共鉴定了70 个化合物,见表3。

图4 JHD 的正离子 (A) 和负离子 (B) BPI 图Fig.4 Base peak intensity (BPI) diagram of positive (A) and negative (B) of JHD
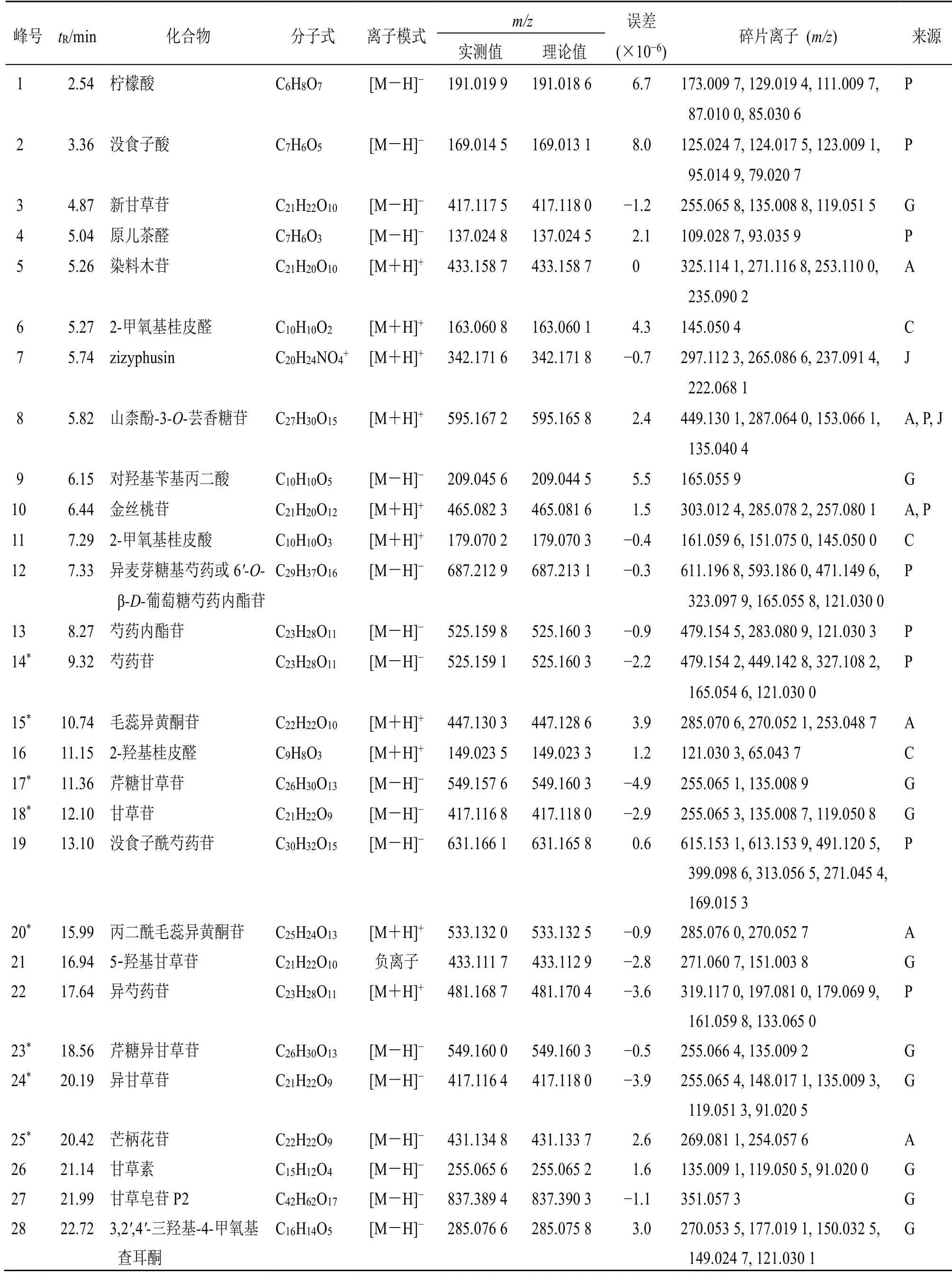
表3 JHD 中化学成分定性分析Table 3 Qualitative analysis of chemical constituents of JHD
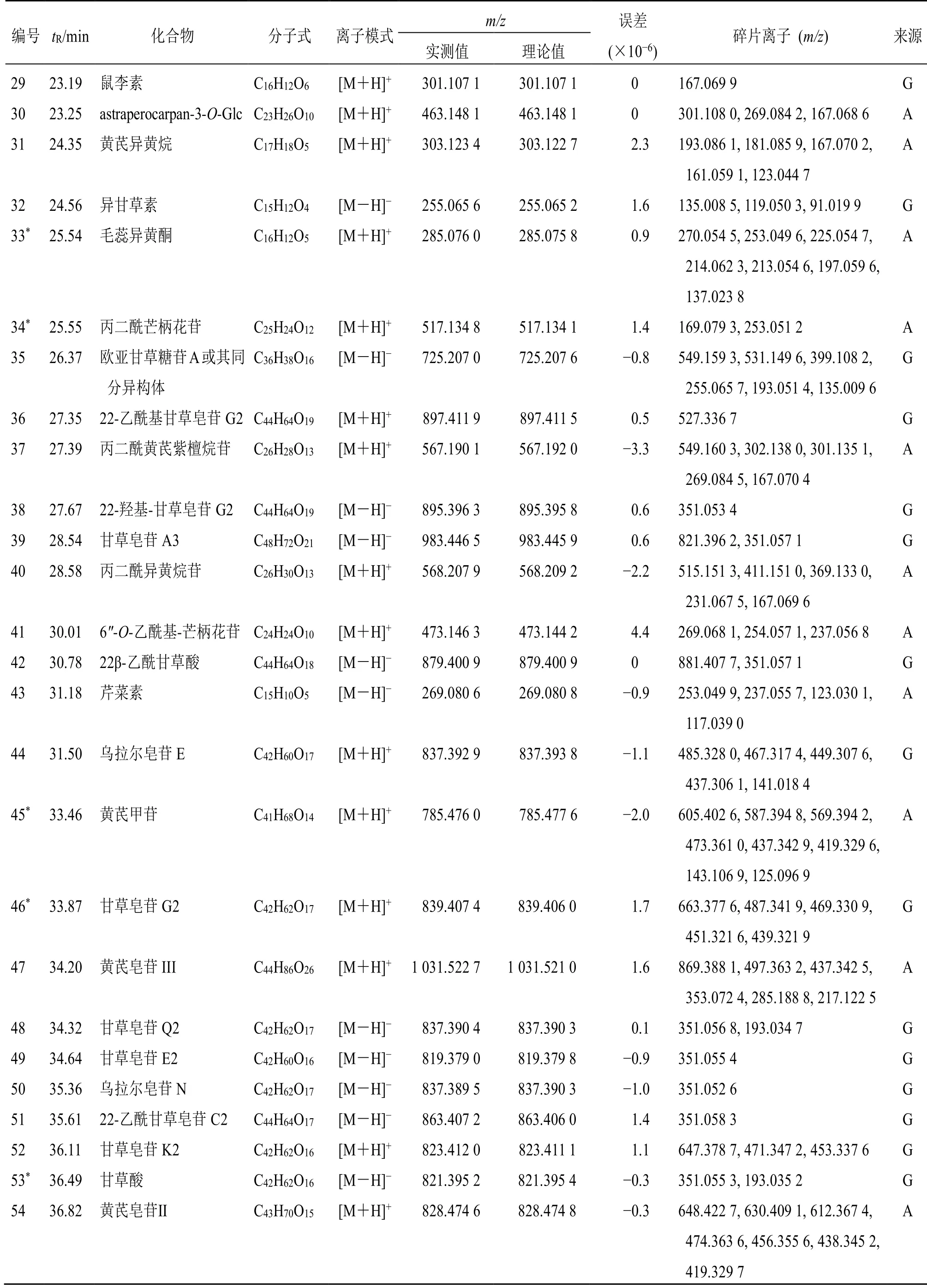
续表3

续表3
选择代表性化合物对成分结构鉴定过程进行解析。其中,黄酮类化合物在正离子模式下响应较高,同时可以检测到丰富二级碎片离子峰,进一步依据它们的准分子离子峰及碎片离子进行了结构鉴定。以15 号峰(tR=10.744 min)毛蕊异黄酮苷为例,其准分子离子峰为m/z447.130 3 [M+H]+,在误差范围内计算得到的分子式为C22H22O10,在二级质谱图中,可见碎片离子m/z285.070 6 [M+H-Glc]+,再失去B 环上CH3得到m/z270.052 1[M+H-Glc-CH3]+,或失去1 分子 -CH3OH 得到m/z253.048 7 [M+H-Glc-CH3OH]+,其裂解规律如图5 所示。

图5 毛蕊异黄酮苷在正离子模式下裂解规律图Fig.5 Fragmentation of mass spectra of calycosin-7-glucoside in positive ion mode
三萜皂苷类化合物具有多氢蒎的五环母核,以峰46 甘草皂苷G2 为例,在正离子模式下,其准分子离子峰为m/z839.407 4 [M+H]+,确定其分子式为C42H62O17,进一步在其二级质谱图中,从分子离子峰失去1 分子葡萄糖醛酸基及同时失去2 分子葡萄糖醛酸基,形成m/z663.377 6 [M+H-GlcA]+及苷元碎片离子m/z487.341 9 [M+H-2GlcA]+,苷元碎片离子m/z487.341 9 由于结构中3-OH 的性质活泼,很容易失去H2O 形成基峰 [B]+,相对分子质量为m/z469.330 9 [aglycone+H-H2O]+,进一步同时或连继丢失中性分子H2O 及CH2O,形成碎片离子m/z451.321 6 [B-H2O]+及m/z439.321 9 [BCH2O]+,其裂解规律见图6。
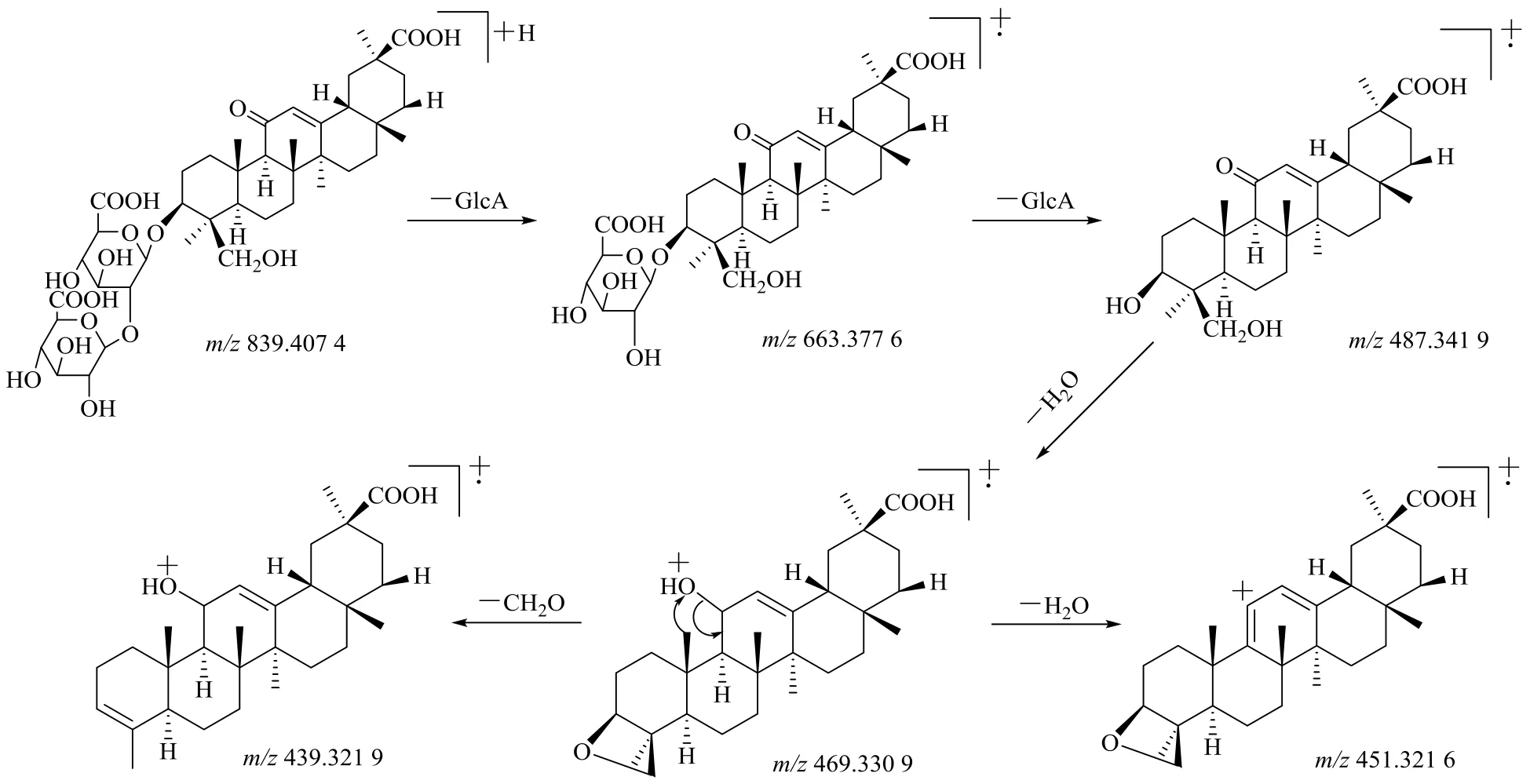
图6 甘草皂苷G2 在正离子模式下裂解规律Fig.6 Fragmentation of mass spectra of licorice saponin G2 in positive ion mode
芍药苷(峰14)是白芍中一类蒎烷单萜苷,在JHD 中含量相对较高,其在负离子模式下,呈现加甲酸的准分子离子峰m/z525.159 1 [M+HCOO]-,二级质谱图中见m/z479.154 2 [M-H]-,以及失去1 分子甲醛形成的碎片离子m/z449.142 8 [M-HCH2O]-,进一步可分别形成苯甲酸碎片离子峰m/z121.030 0 及失去苯甲酸的m/z327.108 2 [M-HCH2O-C7H6O2]-碎片离子;而m/z165.054 6 碎片离子则为蒎烷结构所形成的特征碎片离子,其裂解规律见图7。

图7 芍药苷在负离子模式下裂解规律Fig.7 Fragmentation of mass spectra of paeoniflorin in negative ion mode
3 讨论
10 批JHD 指纹图谱中,不同批次样品之间的相似度波动范围较大,从各样品的指纹图谱中,可以发现峰12、13 具有明显差异,成分归属结果显示峰12 与峰13 来源于桂枝。进一步分析样品来源发现,S1~S3 号样品中所用的桂枝来自广西省贵港市,其余样品中的桂枝均来自广西省北海市。除产地差异外,桂枝药材商品规格等级也不同,贵港市的为桂枝中粒,北海市的为桂枝小粒,而不同规格等级的药材,其活性成分的含量存在差异[18-19]。因此,在中药方剂以及中成药的质量标准的制定过程中,需要保证所用的原药材的质量稳定可靠[20],严格控制药材的来源以及所采用的规格等级,从而能够提高中药方剂与中成药药效的稳定性。
JHD 指纹图谱研究中标定出20 个共有峰,均明确了其相应药味的归属,其中源于桂枝的共有峰9、12、13、14(桂皮醛)、17 在质谱中未被检测到。这可能是因为桂皮醛等成分具有较强的挥发性,成分在进入质谱检测时经电喷雾离子化加热过程中因挥发而损失,因此未能体现在质谱信息中,相关文献也报道了类似的结果[21]。
在JHD 质谱鉴定的70 个成分中,来自黄芪和甘草饮片中的成分多为黄酮类(28 个)及三萜类(23个)化合物,白芍中以单萜苷类(5 个)及有机酸类化合物(5 个)为主,生姜中主要以姜辣素类(5个)成分为主,而大枣中鉴定出的化合物相对较少,可能是由于大枣中主要功效物质为大极性的糖类组分,质谱鉴定存在一定困难。此外,质谱图中一些响应较好的成分如黄芪甲苷由于结构中没有共轭体系,紫外吸光系数低,因而在HPLC-UV 指纹图谱中未能体现。黄芪为方中的君药,其皂苷类化合物具有抗菌、强心、免疫调节等作用[22],因此可针对这些皂苷类成分的结构特点,建立HPLC-ELSD 指纹图谱或多成分含量测定,完善对JHD 的质量控制。
本研究中采用的质谱检测方法其灵敏度高,依据丰富的质谱信息结合对照品及文献,能够鉴定出较多的化学成分,可以较为全面地反映JHD 中的化学成分信息;而HPLC 指纹图谱是目前控制中药复方整体质量的常用方法,仪器设备相对于质谱来说可及性较好,比较适用于常规分析与检验,二者相结合,既可从总体上反映JHD 中所含化学成分的信息,又体现了处方中各药味在方中的贡献,为其质量控制及药效物质基础提供依据。
利益冲突所有作者均声明不存在利益冲突

