甘草酸替代胆固醇构建载雷公藤甲素的脂质纳米粒的适宜性研究
徐资怡,陈佳美,钟雪梅,吴亿晗,章津铭
成都中医药大学药学院,西南特色中药资源国家重点实验室,中药材标准化教育部重点实验室,四川 成都 611137
雷公藤甲素(triptolide,Tr)是从卫矛科雷公藤属植物雷公藤Tripterygium wilfordiiHook f.中提取出的环氧二萜内酯化合物,具有广谱、高效的抗肿瘤作用,其抗肿瘤作用机制包括诱导细胞凋亡、干扰细胞周期、抑制血管生成、抑制端粒酶活性、诱导肿瘤细胞自噬等[1-2]。尤其对于在我国具有高发病率和高死亡率的肝癌,Tr 具有显著疗效,其抗肝癌活性在细胞模型和动物模型上甚至强于阿霉素、索拉非尼等临床一线药物,是目前极具潜力的候选药物[3-4]。然而,Tr 水溶性差、治疗窗窄,对肿瘤组织/细胞分布缺乏专属性,容易造成对肝肾组织、血液系统的毒副作用[5-7]。
纳米载体具有较强的载药能力、体内长循环、肿瘤组织被动/主动靶向、减少药物不良反应等优势[8]。课题组前期构建了多种纳米载体用于Tr 抗肿瘤的高效递送[9-11]。脂质体是目前应用最成熟和广泛的抗肿瘤药物递送载体,胆固醇是其重要组成部分,具有维持脂质体磷脂双分子层膜稳定性的作用,但胆固醇易受氧、光、金属等外界条件的影响,在加工储存过程中产生胆固醇氧化产物,具有一定的细胞毒性、致突变性和潜在致癌性[12-14];此外,摄入过量胆固醇可能引起高脂血症、动脉粥样硬化等疾病[15-16]。高胆固醇水平与肿瘤发生发展也有相关性,胆固醇还可能诱发“补体介导的假过敏反应”,导致肺动脉高压等心肺副作用[17-18]。
筛选与胆固醇结构相似,用以构建不含胆固醇的脂质纳米体系是目前研究热点之一,具有良好的研究和应用前景。植物中的甾醇和皂苷,如类胡萝卜素、大豆甾醇、人参皂苷等,已被证明具有类似于胆固醇的类固醇结构、热致相行为和抗脂质体氧化的作用,将其替代胆固醇构建脂质纳米载体,可以有效改善含胆固醇的磷脂双层理化性质[19]。研究者发现,部分中药三萜皂苷成分与胆固醇结构相似,且具有良好药理活性,用以替换胆固醇,既能保持脂质体载药性能,又赋予脂质体新的药效或靶向性能,体现出“药辅合一”的特点[14]。复旦大学王建新教授团队[18]将人参皂苷Rh2代替胆固醇作为脂质体关键膜材,制备递送紫杉醇的脂质纳米粒,药辅两用,利用人参皂苷Rh2与葡萄糖转运体结合提高纳米粒肿瘤靶向性,而且发挥其自身抗肿瘤和免疫调节作用,从而赋予纳米载体高稳定性、长循环、主动靶向和免疫调节等多种功能。
甘草酸是豆科甘草属植物甘草Glycyrrhiza uralensisFisch.的主要活性成分之一,属于齐墩果烷型五环三萜皂苷,具有较好的抗肿瘤活性[20]。甘草酸具有两亲性类似于表面活性剂的结构特点[21],可与细胞膜上的胆固醇或磷脂相互作用,改变脂质流动性,增加细胞膜通透性和药物跨膜能力[22-23]。此外,研究证实肝癌细胞表面存在大量甘草酸特异性结合位点[24-25],经甘草酸修饰的纳米载体具有更强的肝癌靶向能力。
因此,本实验拟采用甘草酸替代胆固醇作为脂质膜材,将其用于Tr 的包载和抗肿瘤递送,制备一种新型载雷公藤甲素的甘草酸脂质纳米粒(glycyrrhizic acid lipid nanoparticles loaded with triptolide,Tr@GLN)。通过对比考察Tr@GLN 与胆固醇为膜材的载雷公藤甲素脂质体(cholesterol lipid nanoparticles loaded with triptolide,Tr@CLN)的理化性质、载药性能、体外细胞摄取能力、荷瘤肝癌小鼠模型抗肿瘤作用等方面,从而揭示甘草酸替代胆固醇构建脂质纳米粒并作为Tr 递药载体的适宜性,为其抗肿瘤递送提供了新思路。
1 仪器与材料
1.1 仪器
UltiMate 3000 型高效液相色谱(HPLC)仪,美国Thermo Fisher 公司;DF-101S 型集热式恒温加热磁力搅拌器,上海邦西仪器科技有限公司;Litesizer 500 纳米粒度及ζ 电位分析仪,上海安东帕商贸有限公司;YMNL-1000Y 超声波细胞粉碎机,南京以马利仪器设备有限公司;JEM-1230 透射电子显微镜,日本JEOL 公司;TSC SP8 STED 激光扫描共聚焦显微镜,德国Leica 公司。
1.2 药品与试剂
Tr,质量分数≥98%,批号DSTDL003401,成都德思特生物技术有限公司;甘草酸,质量分数>98%,批号D1213A,天津美伦医药有限公司;蛋黄卵磷脂,批号AL20002,上海艾伟拓医药科技有限公司;胆固醇,批号C104028,上海阿拉丁生化科技股份有限公司;DMEM 培养液、0.25%胰蛋白酶、青-链霉素溶液,美国Gibco 公司;胎牛血清(FBS),杭州四季青公司;激光共聚焦皿,北京硕华佰奥生物科技有限公司;乙腈,色谱纯,上海西格玛奥德里奇贸易有限公司;磷酸,色谱纯,成都市诺尔施科技有限责任公司;水为超纯水;其他试剂均为分析纯。
1.3 细胞株及实验动物
人肝癌HepG2 细胞、小鼠肝癌H22 细胞均购自中科院上海细胞生物学研究所。ICR(institute of cancer research)小鼠,SPF 级,体质量20~25 g,雄性,购于北京斯贝福生物技术有限公司,合格证号SCXK(京)2019-0010。饲养条件:温度为20~26 ℃,湿度为40%~70%。实验期间动物自由进食、饮水,昼夜节律正常。动物实验获得成都中医药大学动物实验伦理委员会的批准,批准号2020DL-126。
2 方法与结果
2.1 Tr@GLN 和Tr@CLN 的制备
采用乙醇注入法分别制备 Tr@GLN、Tr@CLN[26-29]。称取6 mg 甘草酸或胆固醇、30 mg 蛋黄卵磷脂以及1 mg Tr 完全溶解于2 mL 乙醇中,作为有机相。将有机相缓慢匀速滴入10 mL 水相(纯水)中,边滴加边搅拌,滴加完毕后于在磁力搅拌器上37 ℃恒温400 r/min 搅拌1 h。待有机溶剂挥尽后,用超声波细胞破碎仪冰浴探超5 min,超声破碎3 s,间歇2 s。最后用0.45 μm 微孔滤膜滤过,得到白色乳光的Tr@GLN 和Tr@CLN 溶液。
2.2 Tr@GLN 和Tr@CLN 的表征
2.2.1 粒径、多分散指数(polydispersity,PDI)与ζ 电位考察 分别取一定体积的样品溶液于粒径池和电位池中,利用纳米粒度及ζ 电位分析仪测定其粒径、PDI 及ζ 电位值。结果显示,采用乙醇注入法制备得到Tr@GLN 和Tr@CLN 均为带乳白色乳光的透明液体,如图1-IA、IIA 所示;其粒径相差不大,分别为(115.59±1.23)、(97.28±0.95)nm,PDI 分别为0.18±0.03、0.22±0.02,均小于0.3,制备的Tr@GLN 粒径均匀度、分散性较好,见图1-IB、IIB。ζ 电位分别为(-19.63±3.14)、(-7.77±0.12)mV,表明Tr@GLN 各微粒之间带有一定程度的负电性,这对脂质纳米粒的相互聚集有一定的抑制作用,有助于增强脂质体体系的稳定性。
2.2.2 形态学考察 取10 μL 样品溶液于碳膜铜网上,静置1 min 后将多余液体从铜网边缘除去。再将3%磷钨酸水溶液滴加1 滴至铜网表面,负染2 min 后用滤纸吸附多余染料,待液体挥干后在TEM下拍摄其形态,结果见图1-IC、IIC。通过TEM 拍摄显示,Tr@CLN 呈类椭圆形的多层结构;相比Tr@CLN,Tr@GLN 的形貌呈更加均匀圆整球形,具有多层结构,分散性适中。

图1 Tr@GLN (I) 和Tr@CLN (II) 的外观 (A)、粒径分布 (B)、TEM 形态 (C,比例尺为100 nm)Fig.1 Appearance (A),particle size distribution (B),TEM morphology (C,scale bar is 100 nm) of Tr@GLN (I) and Tr@CLN(II)
2.2.3 储存稳定性考察 将Tr@CLN、Tr@GLN 密封放置于4 ℃冰箱保存,连续7 d 测量其粒径、ζ 电位值变化,结果如表1 所示,两者粒径在低温储存条件下具有稳定的粒径和ζ 电位,表明甘草酸代替胆固醇后可以得到稳定的脂质体。
表1 Tr@GLN 和Tr@CLN 的存储稳定性 (,n=3)Table 1 Storage stability of Tr@GLN and Tr@CLN(,n=3)
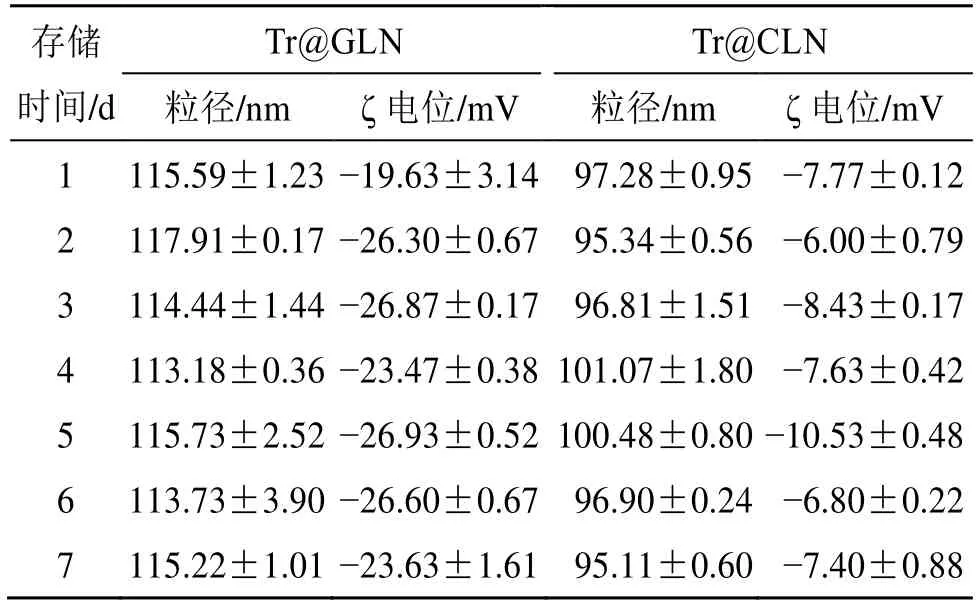
表1 Tr@GLN 和Tr@CLN 的存储稳定性 (,n=3)Table 1 Storage stability of Tr@GLN and Tr@CLN(,n=3)
2.3 Tr@GLN 和Tr@CLN 的包封率及载药量测定
2.3.1 HPLC 色谱条件
(1)TP 测定条件[11]:色谱柱为Welch Ultimate XB-C18柱(250 mm×4.6 mm,5 μm);流动相为纯水-甲醇(54∶46);检测波长220 nm;体积流量1.0 mL/min;柱温25 ℃;进样量10 μL。
(2)甘草酸测定条件[30]:色谱柱为 Welch Ultimate XB-C18柱(250 mm×4.6 mm,5 μm);流动相为0.1%磷酸水溶液-甲醇(25∶75);检测波长250 nm;体积流量1.0 mL/min;柱温25 ℃;进样量10 μL。
2.3.2 供试品溶液和对照品溶液的制备 取2 mL甲醇于1 mL Tr@CLN 或Tr@GLN 溶液中,涡旋、超声破乳,使得制备的脂质体完全破坏,过0.22 μm有机滤膜,即得供试品溶液。
分别精密称取Tr 对照品、甘草酸对照品于10 mL量瓶中,用甲醇溶液定容,得到1 mg/mL Tr 对照品母液和2.06 mg/mL 甘草酸对照品母液。
2.3.3 专属性考察 取“2.3.2”项供试品溶液和对照品溶液,分别按照“2.3.1”项下色谱条件进样。结果如图2、3 所示,可知Tr 和甘草酸的保留时间分别为10.77、8.53 min,供试品溶液和对照品溶液出峰时间相同,供试品溶液中的溶剂和辅料对Tr 和甘草酸的测定无干扰。
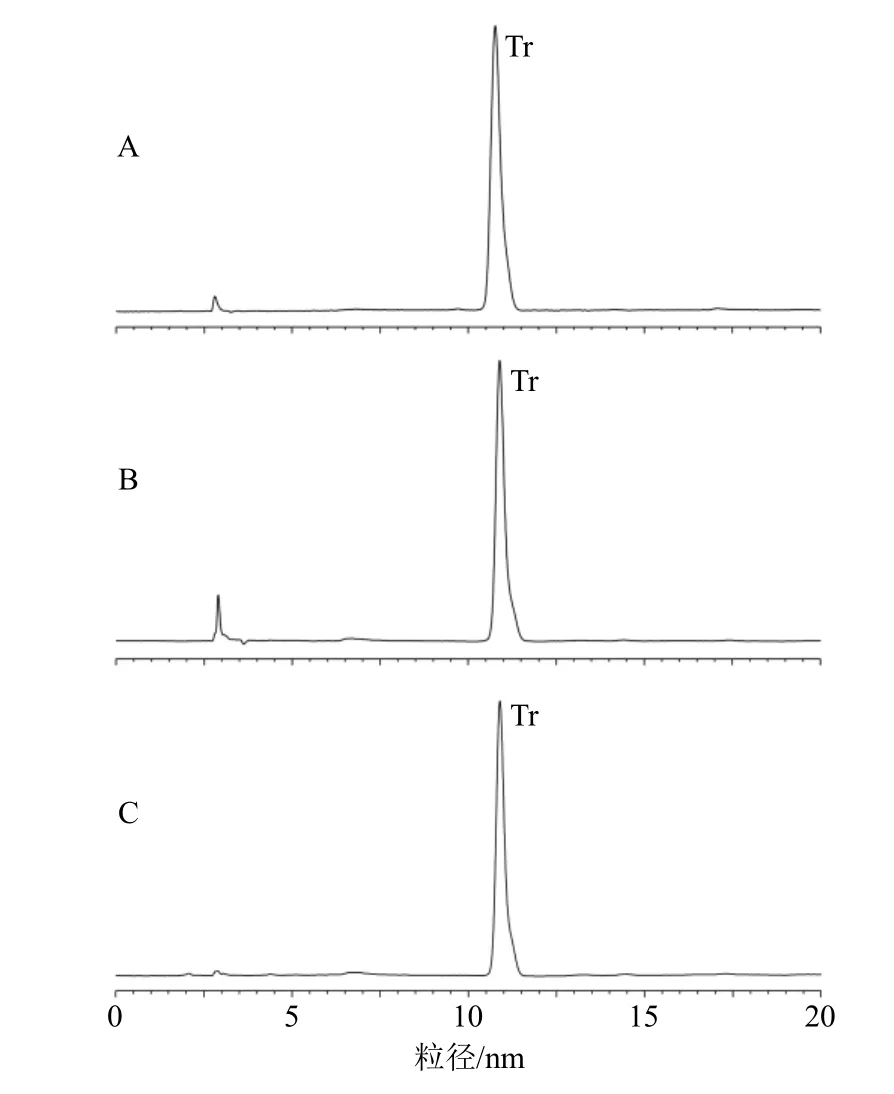
图2 Tr 对照品 (A)、Tr@GLN 样品 (B) 和Tr@CLN 样品 (C) 的HPLC 图谱Fig.2 HPLC of triptolide reference substance (A),Tr@GLN sample (B) and Tr@CLN sample (C)
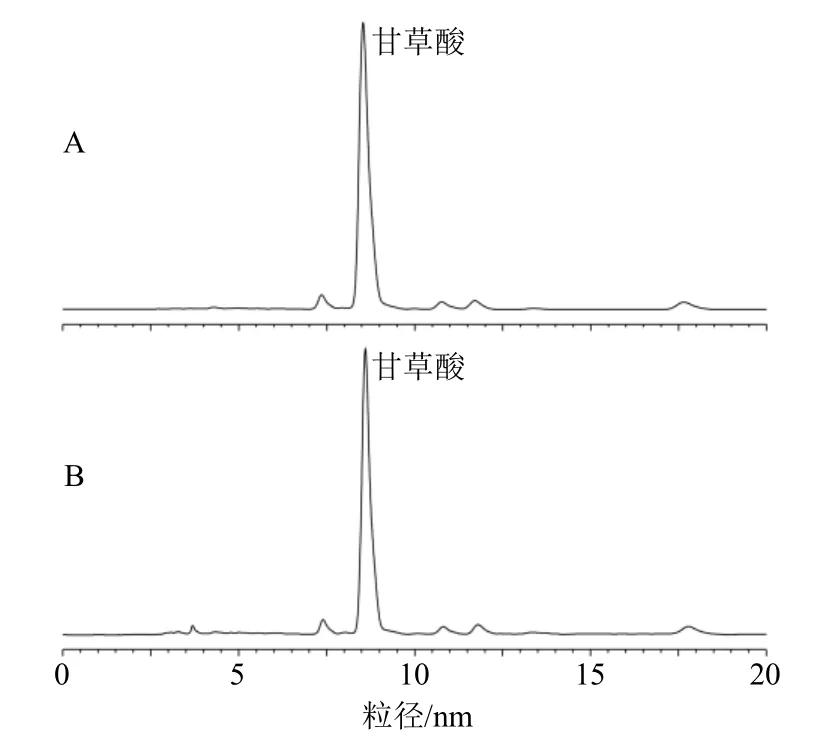
图3 甘草酸对照品 (A) 和Tr@GLN 样品 (B) 的HPLC 图Fig.3 HPLC of glycyrrhizic acid reference substance (A)and Tr@GLN sample (B)
2.3.4 线性关系考察 分别取“2.3.2”项Tr、甘草酸对照品溶液,用甲醇分别稀释成500、250、125、62.5、31.25、15.625 μg/mL Tr 对照品溶液和1 030、515、257.5、128.75、64.375、32.187 5 μg/mL 甘草酸对照品溶液,过0.22 μm 滤膜,进样。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得到标准曲线回归方程分别为TrY=17 537X+134 487,r=0.999 0,线性范围500~15.625 μg/mL;甘草酸Y=5 822.6X+79 001,r=0.999 0,线性范围1 030~32.187 5 μg/mL,表明在定量范围内各质量浓度与峰面积线性关系良好。
2.3.5 精密度试验 取“2.3.2”项下Tr@GLN 和Tr@CLN 供试品溶液,分别连续进样6 次,计算Tr@GLN 样品中的Tr 和甘草酸峰面积的RSD 分别为0.51%、0.58%,Tr@CLN 样品中的Tr 和甘草酸峰面积的RSD 分别为0.48%、0.63%,说明仪器精密度良好。
2.3.6 稳定性试验 取“2.3.2”项下Tr@GLN 和Tr@CLN 供试品溶液,分别于制备后0、2、4、8、12、24 h 进样分析,计算Tr@GLN 样品中的Tr 和甘草酸峰面积的RSD 分别为0.23%、0.41%,Tr@CLN 样品中的Tr 和甘草酸峰面积的RSD 分别为0.59%、0.62%,说明供试品溶液在24 h 内稳定。
2.3.7 重复性试验 按照“2.3.2”项方法配制Tr@GLN 和Tr@CLN 供试品溶液,平行6 份,进样,计算Tr@GLN 样品中的Tr 和甘草酸质量浓度的RSD 分别为1.28%、1.07%,Tr@CLN 样品中的Tr和甘草酸质量浓度的RSD 分别为1.23%、1.04%,说明该方法重复性良好。
2.3.8 加样回收率试验 取6 份已测定Tr 和甘草酸含量的Tr@GLN 溶液各500 μL,分别加入Tr 对照品溶液(1 mg/mL)500 μL,甘草酸对照品溶液(2.06 mg/mL)500 μL,随后涡旋、超声处理,过0.22 μm 微孔滤膜。平行6 份,进样,计算Tr 和甘草酸的平均加样回收率分别为100.07%、99.43%,RSD分别为1.84%、1.50%,表明该方法回收率良好。
另取6 份已测定Tr 含量的Tr@CLN 溶液各500 μL,分别加入Tr 对照品溶液(1 mg/mL)500 μL,随后涡旋、超声处理,过0.22 μm 微孔滤膜。平行6 份,进样,计算得Tr 的平均加样回收率为99.48%,RSD 为1.83%,表明该方法回收率良好。
2.3.9 包封率和载药量的测定 取2 mL 甲醇分别于1 mL Tr@GLN 和Tr@CLN 样品溶液中,涡旋、超声破乳,使得制备的脂质体完全破坏,过0.22 μm有机滤膜,用高效液相测定样品中甘草酸与Tr 含量,根据公式分别计算包封率和载药量。
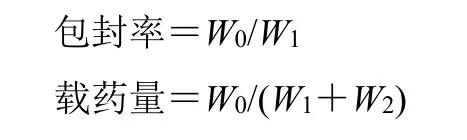
W0为脂质纳米粒或脂质体中药物含量,W1为药物投加量,W2为脂质纳米粒或脂质体材料量
计算得到Tr@GLN 和Tr@CLN 中Tr 的包封率分别为(89.70±0.39)%、(87.39±0.37)%,载药量分别为(2.25±0.01)%、(2.31±0.01)%;Tr@GLN中的甘草酸包封率为(87.46±0.65)%,载药量为(13.41±0.09)%。
2.4 Tr@GLN 和Tr@CLN 的体外释放行为考察
分别将3 mL Tr@CLN、Tr@GLN 溶液置于透析袋(截留相对分子质量3500)中,将透析袋浸入到30 mL 含有0.1%聚山梨酯80 的磷酸盐缓冲液(PBS,pH 7.4)中,放入摇床,37 ℃、100 r/min 条件下振摇。分别于0.5、1、2、3、4、6、8、12、24 h 取1 mL 释放介质,并补充相同体积的新鲜释放介质。加入2 mL 甲醇到所取释放介质中,涡旋、超声破乳后,过0.22 μm 有机滤膜,采用HPLC 测得Tr含量,并计算累积释放率。结果如图4 所示,Tr@GLN 和Tr@CLN 都在8 h 内达到饱和,累积释放率分别为52.92%、73.38%。Tr@GLN 中Tr 在24 h 内释放较Tr@CLN 缓慢,说明甘草酸作为膜材料替代胆固醇可以使脂质体更加稳定,具有一定缓释作用。
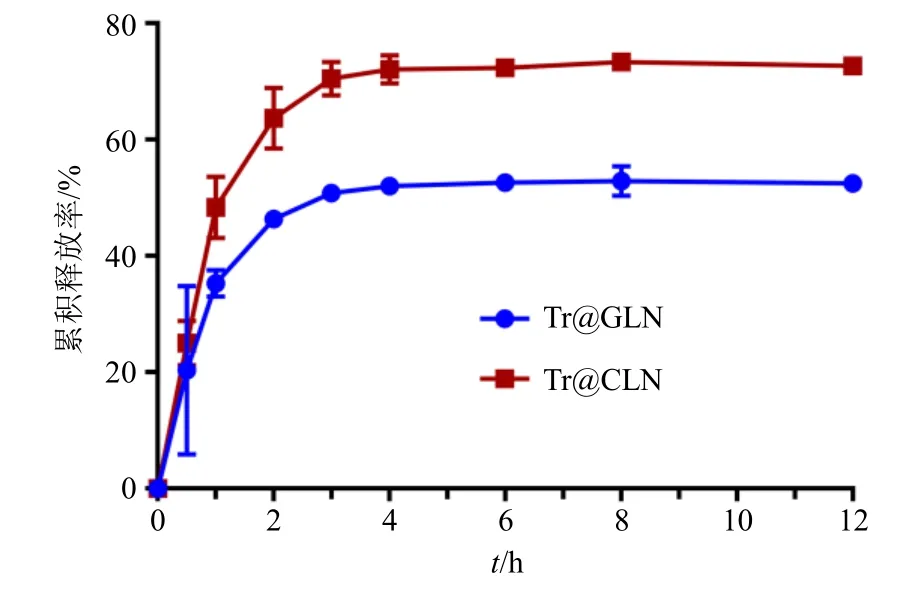
图4 Tr@CLN 和Tr@GLN 的体外释药情况Fig.4 In vitro release of Tr@CLN and Tr@GLN
2.5 Tr@GLN 和Tr@CLN 在HepG2 细胞摄取能力考察
考虑到Tr 无荧光,本研究采用带绿色荧光的香豆素6(coumarin 6,C6)作为表征药物,按照“2.1”项方法制备得到C6@CLN、C6@GLN。将HepG2细胞以1×105个细胞/孔的密度接种到激光共聚焦培养皿中并培养过夜。待细胞贴壁后,将培养基分别更换为含有等量C6 质量浓度(100 ng/mL)的游离C6、C6@CLN、C6@GLN 的低血清新鲜培养基。于37 ℃培养箱孵育4 h 后,弃去培养基,用冷PBS洗涤2 次。加入4%多聚甲醛固定15 min,用冷PBS洗涤2 次,再加入Hoechst 33342 染细胞核10 min,用PBS 清洗后加入1 滴防荧光猝灭剂,采用激光共聚焦显微镜观察HepG2 细胞对C6@GLN 的摄取情况。结果如图5 所示,C6 呈绿色荧光,C6/GLLNP的荧光强度显着高于游离C6 和C6@CLN,表明GLN 可以增加HepG2 细胞对游离药物的摄取,并且HepG2 细胞对其摄取优于C6@CLN,这可能与肝癌细胞膜表面具有甘草酸受体相关[31]。

图5 游离荧光探针C6、C6@CLN、C6@GLN (C6 质量浓度均为100 ng·mL-1) 孵育4 h 后HepG2 细胞摄取情况 (蓝色荧光为细胞核染色,绿色荧光为摄取进细胞的C6,比例尺为25 μm)Fig.5 Uptake of HepG2 cells with free fluorescent probes C6,C6@CLN and C6@GLN (mass concentration of C6 was 100 ng·mL-1) after incubation for 4 h (blue fluorescence is nuclear staining,green fluorescence is C6 absorbed into cells,scale bar is 25 μm)
2.6 Tr@GLN 和Tr@CLN 的体内抗肿瘤活性研究
取对数生长期的H22 细胞用0.25%胰蛋白酶消化后离心,用PBS 洗涤2 次并重悬后调整其密度为1×107个/mL,取100 μL 于小鼠皮下接种。当肿瘤体积达到100 mm3左右时,将小鼠随机分为6 组,分别给予生理盐水(对照)、Tr@GLN、Tr@CLN、游离Tr、游离甘草酸、游离Tr+游离甘草酸,其中Tr 给药剂量为0.35 mg/kg,甘草酸给药剂量为2.38 mg/kg。每2 天给药1 次,给药当天测量体质量和肿瘤体积,第12 天处死小鼠[10,32]。使用游标卡尺测量肿瘤体积,分别按公式计算肿瘤体积以及抑制率。

L为肿瘤最长直径,D为肿瘤最短直径,Vt为肿瘤体积,Wc和Wt分别代表对照组和各治疗组的肿瘤质量
采用t检验分析比较各组数据,P<0.05 认为差异具有统计学意义。
结果如表2 所示,与对照组相比,游离Tr 组、游离甘草酸组、游离Tr+游离甘草酸组的肿瘤体积均有不同程度的减小,抑瘤率分别为18.26%、56.80%、49.70%,说明Tr 与甘草酸均具有一定的抗肿瘤活性。游离Tr+游离甘草酸组对肿瘤的抑制作用甚至强于Tr@CLN 组,这可能是由于甘草酸具有调节肿瘤相关巨噬细胞极化以及减少肿瘤新生血管生成作用,使得游离Tr 与甘草酸联用抗肿瘤效果优于单用Tr 的Tr@CLN 组。

表2 治疗期间各组皮下荷瘤肝癌小鼠肿瘤体积变化Table 2 Changes in tumor volume of subcutaneous hepatocellular carcinoma mice in each group during treatment
Tr@GLN 组对肿瘤生长的抑制作用显著强于游离Tr 组(P<0.05),进一步证明所制备得到的Tr@GLN 由于渗透滞留效应(enhanced permeability and retention effect,EPR)以及主动靶向性使得其抗肿瘤作用明显优于游离Tr。此外,Tr@GLN 组与对照组相比,对肿瘤生长有显著抑制效果(P<0.05),抑瘤率为78.9%,高于Tr@CLN 组(抑瘤率为42.4%),这可能是由于GLN 本身具有调节肿瘤相关巨噬细胞极化作用,将Tr 包载于GLN 中,使得Tr 与甘草酸共达肿瘤部位对抗肿瘤。
实验结束后,小鼠肿瘤拍照结果和肿瘤质量同样表明,Tr@GLN 具有最佳抗肿瘤效果(图6 和表3)。在整个治疗期间,各组小鼠体质量均有相应增加,表明在Tr 安全给药剂量下,Tr@GLN 并未表现出毒性,在体内安全性良好(表4)。
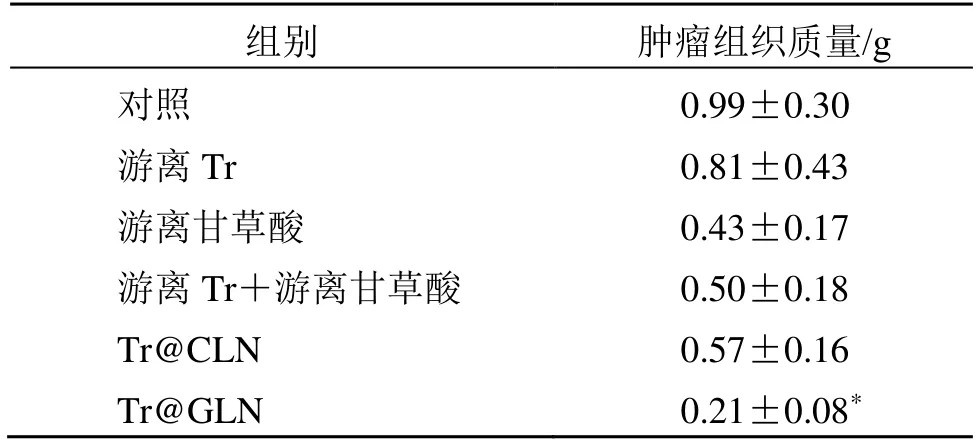
表3 第12 天各组小鼠离体肿瘤组织质量Table 3 Weight of tumor tissue in vitro of mice in each group on day 12
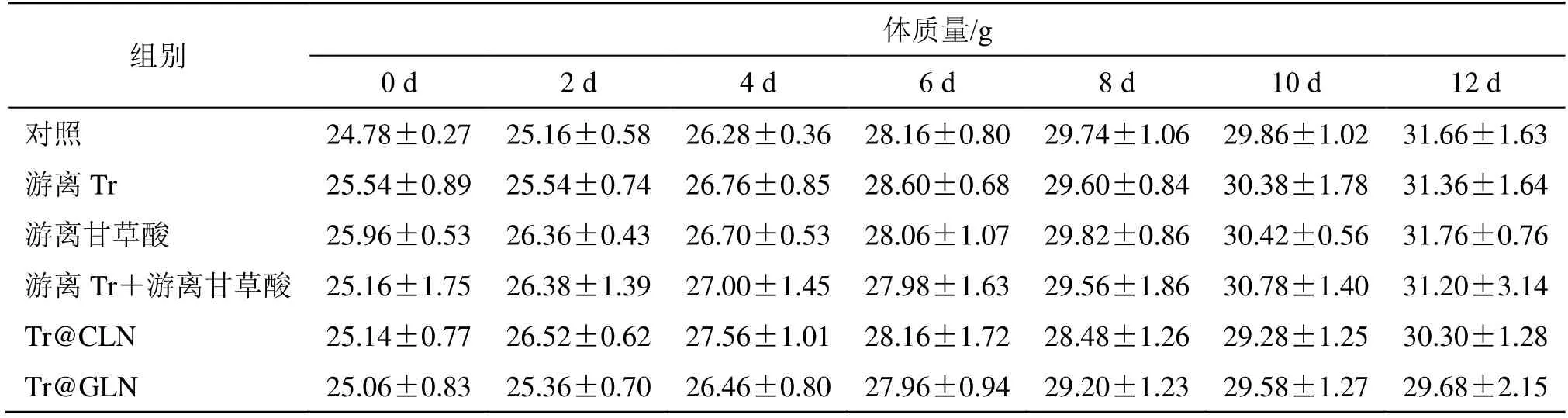
表4 治疗期间各组皮下荷瘤肝癌小鼠体质量变化Table 4 Body weight changes of subcutaneous tumor-bearing hepatoma mice in each group during treatment

图6 皮下荷瘤肝癌小鼠的离体肿瘤组织图Fig.6 In vitro tumor tissue diagram of subcutaneous tumorbearing hepatoma mice
2.7 Tr@GLN 和Tr@CLN 的体内抗肿瘤机制研究
为了进一步证实组织学水平的抗肿瘤作用,在第12 天治疗结束后,将所有小鼠处死,切取肿瘤组织进行苏木精-伊红染色(hematoxylin-eosin staining,HE 染色)、重组Ki-67 蛋白(recombinant Ki-67 protein,Ki-67,肿瘤细胞增殖标志物)和血管内皮生长因子(vascular endothelial growth factor,VEGF,肿瘤新生血管标志物)免疫组织化学分析并对肿瘤组织进行分化群86(cluster of differentiation 86,CD86,M1 型巨噬细胞标志物)、分化群206(cluster of differentiation 206,CD206,M2 型巨噬细胞标志物)和小鼠含生长因子样模体黏液样激素样受体(mouse EGF-like module-containing mucin-like hormone receptor-like 1,F4/80,总巨噬细胞标志物)免疫荧光染色。结果如图7 所示,对照组的肿瘤细胞很少观察到凋亡或坏死,而其他各治疗组均能观察到肿瘤细胞的细胞核呈现不同程度的皱缩和数量减少。其中Tr@GLN 组的肿瘤细胞出现严重的凋亡损伤甚至坏死,说明Tr@GLN 具有最强的肿瘤细胞杀伤能力,抗肿瘤效果优于Tr@CLN,这与上述动物实验结果相同。

图7 小鼠肿瘤组织中Ki-67 和VEGF 的HE 染色和免疫组化染色 (比例尺为100 μm)Fig.7 HE staining and immunohistochemical staining of Ki-67 and VEGF in tumor tissues of mice (scale bar is 100 μm)
课题组前期研究已经证实甘草次酸通过抑制肿瘤血管新生,协同化疗药物抗肿瘤[33]。甘草酸作为甘草中另一主要成分,研究发现其同样具有抗肿瘤血管新生作用[34-36],为了证实Tr@GLN 可以促进肿瘤细胞凋亡和抗肿瘤血管新生,通过Ki67 和VEGF的免疫组织化学进行了评估。
结果显示,Tr@GLN 处理组Ki67 阳性细胞数远低于对照组。游离Tr 组和Tr@CLN 组VEGF 表达相比于对照组没有明显减少,而游离甘草酸组、游离Tr+游离甘草酸组与Tr@GLN 组肿瘤新生血管均有相应的减少,且Tr@GLN 组VEGF 的表达水平显着降低,表明甘草酸具有一定抑制肿瘤新血管形成能力且Tr@GLN 具有更加优异的抗肿瘤新血管生成能力,这可能是由于Tr@GLN 具有更加强烈的肿瘤靶向性。研究发现甘草酸具有多种活性,尤其对肿瘤相关巨噬细胞(tumor associated macrophages,TAM)极化调节作用,可能为其抗肿瘤免疫调节角度提供思路。采用免疫荧光染色对小鼠肿瘤组织进行CD86、CD206 和F4/80 免疫荧光染色探究Tr@GLN 对肿瘤微环境中巨噬细胞调节作用。结果如图8 所示,绿色荧光表示总巨噬细胞,红色荧光表示M1 型巨噬细胞(M1 TAM)或M2 型巨噬细胞(M2 TAM)。结果显示,对照组中标记M1 TAM(F4/80+/CD86+)的红色荧光最少,标记M2 TAM(F4/80+/CD206+)的红色荧光最多,经过治疗后,在给予甘草酸治疗的组中,M1 TAM 增加和M2 TAM 减少较为明显,同时可以明显观察到Tr@GLN组的M1 TAM 最多,M2 TAM 最少。上述结果提示甘草酸可以诱导肿瘤巨噬细胞向M1 型极化,改善肿瘤免疫抑制,通过将甘草酸代替胆固醇制备为GLLNP,不仅可以增加甘草酸在肿瘤部位的累积,同时使得载体自身具有药效,进一步逆转肿瘤微环境(tumor microenvironment,TME)中的免疫抑制环境。
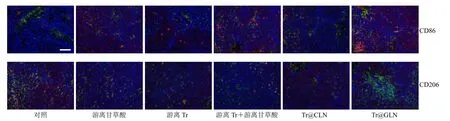
图8 小鼠肿瘤组织中CD206 和CD86 的免疫荧光染色 (比例尺为100 μm)Fig.8 Immunofluorescence staining for CD206 and CD86 in tumor tissues of mice (scale bar is 100 μm)
2.8 Tr@GLN 和Tr@CLN 的体内生物安全性考察
考虑到Tr 具有严重毒性,治疗结束后,收集各组小鼠主要组织器官(心、肝、脾、肺、肾),经多聚甲醛固定后制成石蜡切片,进行HE 染色,检测器官毒性。结果如图9 所示,结果显示,游离Tr 组肝脏组织病理学病变较对照组更严重,表现为肝细胞变性,细胞肿胀,胞质疏松淡染,淋巴细胞呈灶性浸润。然而,Tr@GLN 组的病变较轻,这表明肝损伤是由游离Tr 给药引起的,所制备的制剂减少了Tr 毒性,体内安全性较好。
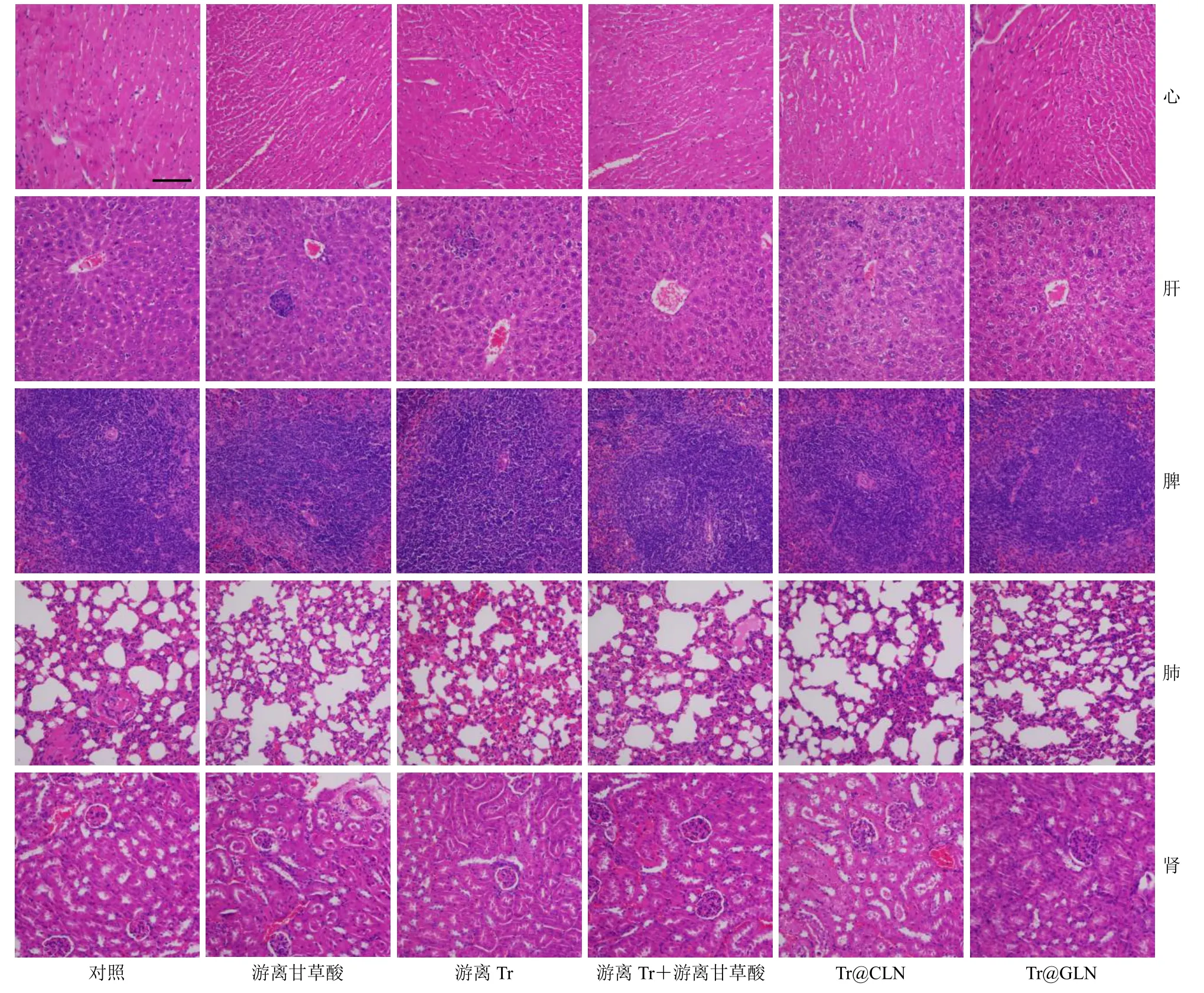
图9 各组小鼠心、肝、脾、肺、肾的HE 染色 (比例尺为100 μm)Fig.9 HE staining of heart,liver,spleen,lung,and kidney of mice in each group (scale bar is 100 μm)
3 讨论
纳米药物递送系统近年来在癌症治疗方面取得了显著成果。药物经纳米粒递送,可有效改善药物自身性质,增加药物在肿瘤组织的分布,延长药物在生物体内的滞留时间。然而,当2 种药物共递送时存在基质效应和竞争关系,物理包载方式很难实现2 种药物高包封率,药物比例难以稳定,而化学键合的方式,制备工艺复杂,难以实现转化。因此,亟需探索一种新的药物共载纳米递药体系的构建方式和思路。
“药辅合一”是中药制剂学中独特的用药理念、制药经验与哲学智慧。将药物作为纳米材料或替代原有材料的一部分,开发“药辅合一”的新型纳米递药系统有望解决这一难题。例如将中药活性成分白及多糖进行改性得到两亲性结构,在水中自组装形成负载多西紫杉醇的纳米粒,与人工合成的聚合物相比,天然多糖显示出许多有益的生物特性,包括无毒、生物降解性和非免疫原性同时通过抑制肿瘤细胞增殖抗肿瘤[37]。除多糖外,生物大分子核酸因其尺寸小、结构稳定而灵活、编码性强、易于操作等优势,使其既可以作为纳米载体又可以作为核酸药物来解决生命科学中的重要问题[38]。
本研究立足于目前研究最深入、产业化最成熟的纳米递药载体脂质体[39],利用甘草酸替代传统脂质体的膜稳定剂胆固醇,制备“药辅合一”的新型脂质纳米粒,解决了传统脂质体靶向效率低、难以完全治疗复杂的TME、胆固醇带来的不良反应等问题[40-42]。然而本研究所制备的GLN 仍然可能存在一些不足:(1)甘草酸作为一种皂苷类成分,存在一定溶血性,将其制备为脂质体是否能减少其带来的溶血性亟需实验证明。(2)研究发现,脂质体的快速清除与网状内皮系统(reticuloendothelial system,RES)的不可逆摄取有关[43]。脂质体进入生物介质后,脂质体迅速与各种蛋白质结合形成蛋白冠,被RES 识别和捕获,使得到达肿瘤部位的药物减少[44-45]。因此,GLN 相比普通脂质体是否能减少蛋白冠的形成,需要进一步验证。(3)Tr@GLN 还需要进一步研究在体外的抗肿瘤作用及机制。(4)GLN 能够增加肝癌HepG2 细胞对药物的摄取,但对于其体内的靶向能力还需后续实验证明。
利益冲突所有作者均声明不存在利益冲突

