栽培奇楠沉香化学成分及其抗炎活性研究
张 琳 ,王 昊,董文化,李 薇,云翠鸿,袁靖喆,蔡彩虹,吴 妃,梅文莉,戴好富*,李震宇
1.山西大学化学生物学与分子工程教育部重点实验室,中医药现代研究中心,山西 太原 030006
2.中国热带农业科学院热带生物技术研究所海南省黎药资源天然产物研究与利用重点实验室/海南热带农业资源研究院海南省热带农业生物资源保护与利用重点实验室,海南 海口 571101
沉香为瑞香科(Thymelaeaceae)沉香属AquilariaLam.或拟沉香属GyrinopsGaertn.植物含有树脂的木材,是天然香料和名贵的传统药材。沉香中的主要成分为倍半萜和2-(2-苯乙基)色酮2大类化合物。奇楠沉香特指高品质的沉香,出产极少,价格昂贵。因其香气幽雅、香韵丰富、香味浓郁、留香持久、油脂丰富、质地柔软,在未燃时也具有清凉香甜的气味,在宗教和香文化中备受推崇。经考证,奇楠的2 种基原植物为海南产白木香A.sinensis(Lour.) Spreng 和越南产柯拉斯那沉香A.crassnaPierre ex Lecomte[1]。奇楠沉香的乙醇或乙醚提取物得率均显著高于普通沉香的得率,乙醚提取物中2-(2-苯乙基)色酮和2-[2-(4-甲氧基苯)乙基]色酮的相对含量之和高达37%以上[2-4]。此外,普通沉香中母核无取代的2-(2-苯乙基)色酮类化合物(即C-3,5,6,7 和8 位没有被取代)含量较少,而本研究组从国产绿奇楠沉香中分离到大量色酮母核无取代的2-(2-苯乙基)色酮类化合物[5]。
本研究组选育出的新品种“热科2 号”白木香(琼S-SV-AS-002-2020)所产沉香的乙醚提取物中2-(2-苯乙基)色酮和2-[2-(4-甲氧基苯)乙基]色酮的平均相对含量之和为64.01%,具有高品质沉香的特性,是极具吸引力的栽培奇楠沉香良种[6-7]。GC-MS分析结果表明,“热科2 号”栽培奇楠沉香在乙醇提取物得率、2-(2-苯乙基)色酮衍生物的相对含量等方面与野生奇楠沉香类似,均远高于普通沉香,其水蒸气蒸馏法提取获得的精油富含倍半萜类化合物,是“热科2 号”栽培奇楠沉香在未燃时具有类似于奇楠沉香香气的物质基础[2,8-9]。此外,“热科2 号”栽培奇楠沉香及其叶片的急性毒性研究结果表明二者的急性毒性分级属于无毒级物质,为栽培奇楠沉香的药用和深加工提供了可能[10]。近年来,随着“热科2 号”白木香良种的大面积推广,“热科2 号”白木香所产栽培奇楠沉香的产量不断增加,为了更好地加工利用栽培奇楠沉香,急需对其化学成分进行深入系统地研究,发现栽培奇楠沉香的更多特征性成分,为栽培奇楠沉香替代野生奇楠沉香提供理论依据,为栽培奇楠沉香的利用提供系统、科学的依据,实现栽培奇楠沉香资源的最大化利用。本研究从“热科2 号”白木香人工打洞所产栽培奇楠沉香的乙醇提取物中分离并鉴定了17 个化合物(图1),分别为 2-[(4-甲氧基苯甲酰氧基)甲基]色酮(2-[(4-methoxybenzoyloxy)methyl]chromone,1)、2-(2-苯乙基)色酮(2-(2-phenylethyl)chromone,2)、2-[2-(3-羟基-4-甲氧基苯)乙基]色酮(2-[2-(3-hydroxy-4-methoxyphenyl)ethyl]chromone,3)、2-[2-(3-甲氧基-4-羟基苯)乙基]色酮(2-[2-(3-methoxy-4-hydroxyphenyl)ethyl]chromone,4)、2-[2-(4-甲氧基苯)乙基]色酮(2-[2-(4-methoxyphenyl)ethyl]chromone,5)、2-[2-(2-羟基苯)乙基]色酮(2-[2-(2-hydroxyphenyl)ethyl]chromone,6)、2-[2-(4-羟基苯)乙基]色酮(2-[2-(4-hydroxyphenyl)ethyl]chromone,7)、6-羟基-2-[2-(3-羟基-4-甲氧基苯)乙基]色酮(6-hydroxy-2-[2-(3-hydroxy-4-methoxyphenyl)ethyl]chromone,8)、6-甲氧基-2-[2-(4-甲氧基苯)乙基)]色酮(6-methoxy-2-[2-(4-methoxyphenyl)ethyl]chromone,9)、(R)-2-[2-羟基-2-(4-羟基苯)乙基]色酮((R)-2-[2-hydroxy-2-(4-hydroxyphenyl)ethyl]chromone,10)、(S)-2-[2-羟基-2-(4-羟基苯)乙基]色酮((S)-2-[2-hydroxy-2-(4-hydroxyphenyl)ethyl]chromone,11)、4-羟基苯甲酸甲酯(methyl 4-hydroxybenzoate,12)、4-丙烯基苯甲醚(anethole,13)、7β-H-9(10)-烯-11,12-环氧-8-氧艾里莫芬烷 [7β-H-9(10)-ene-11,12-epoxy-8-oxoeremophilane,14]、(5S,7S,9S,10S)-(-)-9-羟基-芹子烷-3,11-二烯-14-醛 [(5S,7S,9S,10S)-(-)-9-hydroxyselina-3,11-dien-14-al,15]、β-榄香烯-9β-醇(β-elemen-9β-ol,16)、角鲨烯(squalene,17)。其中,化合物1 为新化合物,化合物16 首次在沉香中发现。抗炎活性测试结果表明,化合物8 具有抗炎活性,半数抑制浓度(median inhibition concentration,IC50)值为(27.81±2.34)μmol/L。

图1 栽培奇楠沉香中化合物1~17 的结构Fig.1 Structures of compounds 1—17 from cultivated “Qi-Nan” agarwood
1 仪器与材料
安捷伦1260 分析型高效液相色谱仪(美国Agilent 公司);安捷伦1260 半制备型高效液相色谱仪(美国安捷伦科技有限公司);Cosmosil 5 C18-MS-II 色谱柱(250 mm×4.6 mm,5 µm,Nacalai tesque公司);Chiralpak AD-H 色谱柱(250 mm×4.6 mm,5 µm,Daicel 公司);Bruker AV-500 型超导核磁仪(德国Bruker 公司);质谱仪(Bruker amazon SL 公司);红外光谱仪(Nicolet 380);UV-2550 紫外光谱仪(Shimadzu 公司);旋光仪MCP 5100(奥地利Anton Paar 有限公司);圆二色谱仪MOS-500(法国Biologic 公司);CA-1111 型冷却水循环装置(上海爱朗仪器有限公司);BSA-100A 型自动部分收集器(上海青浦沪西仪器厂);旋转蒸发仪(德国Heidolph Laborota);Mettler Toledo ME204 精密和分析天平 [万分之一,梅特勒-托力多仪器(上海)公司];超净工作台(上海博讯实业有限公司医疗设备厂);ELX-800 酶标仪(美国宝特公司);色谱硅胶板G,柱色谱硅胶(200~300、60~80 目)(青岛海洋化工厂);Sephadex LH-20 凝胶(德国Merck公司)。小鼠单核巨噬细胞(RAW264.7)购买于中国科学院干细胞库;DMEM 培养基、胎牛血清(赛默飞世尔科技公司);脂多糖(lipopolysaccharide,LPS)、Griess 试剂、槲皮素(批号SLBZ4289)、吲哚美辛(批号RH107294)、盐酸阿霉素(批号H03A8J41034)、MTT 试剂(美国Sigma 公司)。
栽培奇楠沉香样品于2020年5月采自广东电白打洞结香12 个月的“热科2 号”白木香,经中国热带农业科学院热带生物技术研究所戴好富研究员鉴定基原植物为瑞香科沉香属白木香A.sinensis(Lour.) Spreng,凭证标本(RK220200517)保存于中国热带农业科学院热带生物技术研究所。
2 提取与分离
栽培奇楠沉香样品(177.7 g)粉碎后用95%乙醇(1.8 L)回流提取3 次,减压浓缩后得浸膏(85.3 g)。随后将浸膏用减压硅胶柱色谱进行粗划段,用石油醚-醋酸乙酯系统(1∶0→2∶1)和二氯甲烷-甲醇系统(40∶1→0∶1)洗脱,得14 个流分(Fr.1~14)。Fr.1(220.5 mg)经石油醚-醋酸乙酯(1000∶1→300∶1)硅胶柱洗脱得到化合物17(7.1 mg)。Fr.2(605.5 mg)经Sephadex LH-20 凝胶柱(氯仿-甲醇1∶1)洗脱获得流分Fr.2.1~2.4,Fr.2.3(146.1 mg)分别经凝胶柱色谱(甲醇)和硅胶柱色谱[石油醚-丙酮(500∶1→50∶1)]洗脱获得流分Fr.2.3.1~2.3.9 和化合物14(2.0 mg),Fr.2.3.1(32.1 mg)经石油醚-氯仿-丙酮(5∶1∶0→5∶5∶0.01)硅胶柱洗脱,得到化合物13(5.1 mg)和16(1.3 mg)。Fr.3(4.569 g)分别经凝胶柱(氯仿-甲醇1∶1)和石油醚-醋酸乙酯(40∶1→25∶1)硅胶柱洗脱获得化合物2(813.2 mg)。Fr.4(11.693 g)分别经凝胶柱(甲醇)和石油醚-醋酸乙酯(12∶1→4∶1)硅胶柱洗脱得到化合物5(10.147 g)和7(3.4 mg)。Fr.5(1.256 g)经凝胶柱(甲醇)洗脱,得到流分Fr.5.1 和Fr.5.2,Fr.5.1(536.1 mg)分别经凝胶柱(甲醇)和硅胶柱色谱[石油醚-氯仿-丙酮(5∶5∶0→5∶5∶0.4)]洗脱,得到化合物15(2.0 mg),Fr.5.2(351.8 mg)经硅胶柱色谱[石油醚-氯仿-异丙醇(5∶3∶0→5∶3∶0.15)]洗脱得到流分Fr.5.2.1~5.2.7,化合物4(4.5 mg)和6(6.5 mg),Fr.5.2.2(20.0 mg)经硅胶柱,以石油醚-醋酸乙酯(8∶1→4∶1)洗脱得到化合物1(2.7 mg)。Fr.9(8.407 g)经凝胶柱(氯仿-甲醇1∶1)洗脱,然后重结晶得化合物3(3.645 g)。Fr.10(900.8 mg)分别经凝胶柱(氯仿-甲醇1∶1)和硅胶柱色谱(石油醚-醋酸乙酯2∶1)洗脱得流分Fr.10.1~10.8 和化合物12(1.8 mg),Fr.10.4(72.8 mg)经半制备高效液相色谱(C18柱,甲醇-水13∶7)分离纯化得到化合物9(3.7 mg,tR=29.0 min)。滤过Fr.11(19.467 g)中析出的固体,将固体用氯仿溶解后,重结晶得化合物8(6.389 g),Fr.11 的母液分别经凝胶柱(氯仿-甲醇1∶1)和石油醚-醋酸乙酯(25∶1→6∶1)硅胶柱洗脱,得到流分Fr.11.1~11.6,Fr.11.5(583.2 mg)经石油醚-醋酸乙酯(6∶1→1∶1)硅胶柱洗脱得到外消旋混合物(2.0 mg)。随后,采用正向手性柱(正己烷-异丙醇3∶7)将外消旋混合物拆分得到化合物10(0.6 mg,tR=7.7 min)和11(0.4 mg,tR=8.2 min)。
3 结构鉴定
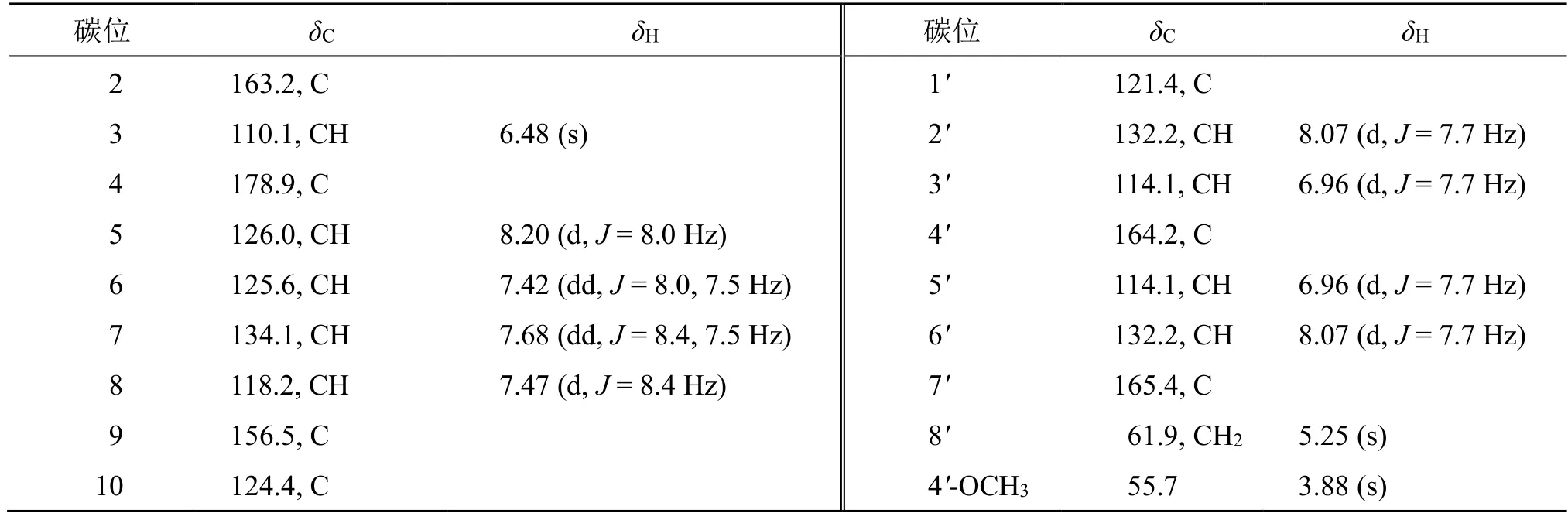
表1 化合物1 的1H-NMR (500 MHz,CDCl3) 和13C-NMR (125 MHz,CDCl3) 数据Table 1 1H-NMR (500 MHz,CDCl3) and 13C-NMR (125 MHz,CDCl3) data of compound 1
高分辨质谱HR-ESI-MSm/z333.073 8 [M+Na]+(计算值333.073 3,C18H14NaO5+),分子式为C18H14O5,不饱和度为12。红外谱图显示,该化合物存在色酮结构中共轭羰基(1630 cm-1),不含有羟基的吸收峰。1H-NMR 谱(表1)上显示1 组1,4-二取代苯环质子信号 [δH8.07 (2H,d,J=7.7 Hz,H-2',6'),6.96 (2H,d,J=7.7 Hz,H-3',5')],1 个沉香中色酮特征性质子信号 [δH6.48 (1H,s,H-3)],1 组1,2-二取代苯环质子信号 [δH8.20 (1H,d,J=8.0Hz,H-5),7.42 (1H,dd,J=8.0,7.5 Hz,H-6),7.68(1H,dd,J=8.4,7.5 Hz,H-7),7.47 (1H,d,J=8.4 Hz,H-8)],1 个连氧亚甲基 [δH5.25 (2H,s,H-8')]和1个甲氧基 [δH3.88 (3H,s,4'-OCH3)]。化合物1 的13C-NMR 显示该化合物有18 个碳原子,结合DEPT 135 及HSQC 谱图可以得出该化合物含有7 个季碳、9 个次甲基、1 个连氧亚甲基和1 个甲氧基(表1)。化合物1 的核磁数据与2-[2-(4-甲氧基)苯乙基]色酮(5)相似,表明化合物1 也具有C-2 位连有取代基色酮母核和1,4 二取代苯环,不同之处在于化合物1多出1 个酯羰基(δC165.4,C-7')和1 个连氧亚甲基(δC61.9,C-8'),而缺少乙-1,2-叉基。在HMBC谱上,H-8'与C-2(δC163.2)、C-3(δC110.1)的远程相关信号和H-3 与C-2、C-8'的远程相关信号表明C-8'与C-2 连接;H-8'与C-7'的远程相关信号表明C-8'与C-7'形成酯键;H-2'和H-6'与C-7'、C-4'(δC164.2)的远程相关信号,和4'-OCH3与C-4'的远程相关信号表明C-7'与C-1'连接以及C-4'被甲氧基取代(图2)。此外,化合物1 的ROESY 谱中4'-OCH3与H-3'和H-5'的NOE 效应也进一步确定甲氧基位于C-4'。综合分析化合物1 的2D NMR 信号,表明其他结构片段与2-[2-(4-甲氧基)苯乙基]色酮的一致,其结构如图1 所示,命名为2-[(4-甲氧基苯甲酰氧基)甲基]色酮。栽培奇楠沉香的主要成分2-[2-(4-甲氧基)苯乙基]色酮(5)可能是化合物1 的前体,其C-7'被氧化成酮羰基,然后发生Baeyer-Villiger 氧化反应形成化合物1[11](图3)。

图2 化合物1 的关键2D NMR 相关信号Fig.2 Key 2D NMR correlations of compound 1

图3 化合物1 可能的生物合成途径Fig.3 The proposed biosynthesis pathway of compound 1
化合物2:黄色油状物。ESI-MSm/z273.3 [M+Na]+,分子式C17H14O2;1H-NMR (500 MHz,CD3OD)δ: 8.04 (1H,d,J=8.0 Hz,H-5),7.72 (1H,dd,J=8.4,7.0 Hz,H-7),7.51 (1H,d,J=8.4 Hz,H-8),7.41 (1H,dd,J=8.0,7.0 Hz,H-6),7.32 (2H,m,H-2',6'),7.23(3H,m,H-3'~5'),6.12 (1H,s,H-3),3.04 (2H,m,H-7'),2.96 (2H,m,H-8');13C-NMR (125 MHz,CD3OD)δ: 171.6 (C-2),110.7 (C-3),180.5 (C-4),126.1 (C-5),126.5 (C-6),135.4 (C-7),119.2 (C-8),158.0 (C-9),124.3 (C-10),141.2 (C-1'),129.6 (C-2',6'),129.4 (C-3',5'),127.5 (C-4'),33.9 (C-7'),37.0(C-8')。以上数据与文献报道基本一致[5],确定化合物2 为2-(2-苯乙基)色酮。
化合物3:淡黄色针晶(甲醇)。ESI-MSm/z297.3 [M+H]+,分子式C18H16O4;1H-NMR (500 MHz,CDCl3)δ: 8.17 (1H,d,J=8.0 Hz,H-5),7.65(1H,dd,J=8.4,7.0 Hz,H-7),7.44 (1H,d,J=8.4 Hz,H-8),7.37 (1H,dd,J=8.0,7.0 Hz,H-6),6.79 (1H,d,J=2.0 Hz,H-2'),6.75 (1H,d,J=8.2 Hz,H-5'),6.65(1H,dd,J=8.2,2.0 Hz,H-6'),6.14 (1H,s,H-3),3.85(3H,s,4'-OCH3),2.96 (2H,m,H-7'),2.88 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 168.6 (C-2),110.2 (C-3),178.4 (C-4),125.6 (C-5),125.0 (C-6),133.5 (C-7),117.8 (C-8),156.4 (C-9),123.6 (C-10),132.9 (C-1'),114.4 (C-2'),145.7 (C-3'),145.2 (C-4'),110.8 (C-5'),119.6 (C-6'),32.3 (C-7'),36.2 (C-8'),55.9 (4'-OCH3)。以上数据与文献报道一致[5],确定化合物3 为2-[2-(3-羟基-4-甲氧基苯)乙基]色酮。
化合物4:无色针晶(甲醇)。ESI-MSm/z297.3[M+H]+,分子式C18H16O4;1H-NMR (500 MHz,CDCl3)δ: 8.17 (1H,d,J=8.0 Hz,H-5),7.64 (1H,dd,J=8.4,7.2 Hz,H-7),7.43 (1H,d,J=8.4 Hz,H-8),7.37 (1H,dd,J=8.0,7.2 Hz,H-6),6.83 (1H,d,J=8.0 Hz,H-5'),6.69 (1H,brd,J=8.0 Hz,H-6'),6.67(1H,brs,H-2'),6.15 (1H,s,H-3),3.80 (3H,s,3'-OCH3),2.98 (2H,m,H-7'),2.89 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 168.6 (C-2),110.1(C-3),178.3 (C-4),125.6 (C-5),125.0 (C-6),133.5(C-7),117.7 (C-8),156.4 (C-9),123.6 (C-10),131.5(C-1'),110.8 (C-2'),146.5 (C-3'),144.2 (C-4'),114.5(C-5'),120.8 (C-6'),32.7 (C-7'),36.4 (C-8'),55.8(3'-OCH3)。以上数据与文献报道一致[5],确定化合物4 为2-[2-(3-甲氧基-4-羟基苯)乙基]色酮。
化合物5:无色针晶(甲醇)。ESI-MSm/z303.3[M+Na]+,分子式C18H16O3;1H-NMR (500 MHz,CDCl3)δ: 8.16 (1H,d,J=7.9 Hz,H-5),7.63 (1H,dd,J=8.4,7.2 Hz,H-7),7.42 (1H,d,J=8.4 Hz,H-8),7.41 (1H,dd,J=7.9,7.2 Hz,H-6),7.10 (2H,d,J=8.6 Hz,H-2',6'),6.81 (2H,d,J=8.6 Hz,H-3',5'),6.12 (1H,s,H-3),3.76 (3H,s,4'-OCH3),2.99 (2H,m,H-7'),2.88 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 168.4 (C-2),110.1 (C-3),178.1 (C-4),125.5(C-5),124.8 (C-6),133.4 (C-7),117.7 (C-8),156.3(C-9),123.6 (C-10),131.6 (C-1'),129.1 (C-2',6'),113.9 (C-3',5'),158.1 (C-4'),32.0 (C-7'),36.2 (C-8'),55.1 (4'-OCH3)。以上数据与文献报道一致[12],确定化合物5 为2-[2-(4-甲氧基苯)乙基]色酮。
化合物6:白色粉末。ESI-MSm/z289.3 [M+Na]+,分子式C17H14O3;1H-NMR (500 MHz,CDCl3)δ: 8.07 (1H,d,J=8.0 Hz,H-5),7.61 (1H,dd,J=8.4,7.0 Hz,H-7),7.40 (1H,d,J=8.4 Hz,H-8),7.32 (1H,dd,J=8.0,7.0 Hz,H-6),6.99 (1H,d,J=8.3 Hz,H-6'),6.97 (1H,dd,J=8.0,7.4 Hz,H-4'),6.73 (1H,d,J=8.0 Hz,H-3'),6.32 (1H,dd,J=8.3,7.4 Hz,H-5'),6.13 (1H,s,H-3),2.99 (2H,m,H-7'),2.93 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 170.4 (C-2),109.5 (C-3),179.3 (C-4),125.2 (C-5),124.9 (C-6),133.6 (C-7),117.8 (C-8),156.5 (C-9),123.1 (C-10),126.0 (C-1'),154.7 (C-2'),114.9 (C-3'),127.6 (C-4'),119.5 (C-5'),129.8 (C-6'),27.8 (C-7'),34.2 (C-8')。以上数据与文献报道一致[5],确定化合物6 为2-[2-(2-羟基苯)乙基]色酮。
化合物7:白色无定形固体。ESI-MSm/z267.3[M+H]+,分子式C17H14O3;1H-NMR (500 MHz,CDCl3)δ: 8.18 (1H,d,J=8.0 Hz,H-5),7.66 (1H,dd,J=8.3,7.0 Hz,H-7),7.44 (1H,d,J=8.3 Hz,H-8),7.39 (1H,dd,J=8.0,7.0 Hz,H-6),7.05 (2H,d,J=8.4 Hz,H-2',6'),6.77 (2H,d,J=8.4 Hz,H-3',5'),6.13 (1H,s,H-3),2.99 (2H,m,H-7'),2.90 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 168.8 (C-2),110.2 (C-3),178.6 (C-4),125.7 (C-5),125.0 (C-6),133.6 (C-7),117.8 (C-8),156.5 (C-9),123.6 (C-10),131.5 (C-1'),129.4 (C-2'),115.5 (C-3'),154.5 (C-4'),115.5 (C-5'),129.4 (C-6'),32.1 (C-7'),36.4 (C-8')。以上数据与文献报道一致[5],确定化合物7 为2-[2-(4-羟基苯)乙基]色酮。
化合物8:白色粉末。ESI-MSm/z335.3 [M+Na]+,分子式C18H16O5;1H-NMR (500 MHz,DMSO-d6)δ: 9.91 (1H,s,6-OH),8.79 (1H,s,3'-OH),7.44 (1H,d,J=9.0 Hz,H-8),7.22 (1H,d,J=1.8 Hz,H-5),7.15(1H,dd,J=9.0,1.8 Hz,H-7),6.74 (1H,d,J=8.1 Hz,H-5'),6.62 (1H,d,J=2.2 Hz,H-2'),6.55 (1H,dd,J=8.1,2.2 Hz,H-6'),6.06 (1H,s,H-3),3.66 (3H,s,4'-OCH3),2.85 (2H,m,H-7'),2.83 (2H,m,H-8');13C-NMR (125 MHz,DMSO-d6)δ: 168.8 (C-2),108.8(C-3),176.9 (C-4),107.6 (C-5),154.7 (C-6),122.9(C-7),119.6 (C-8),149.7 (C-9),124.0 (C-10),132.9(C-1'),115.7 (C-2'),146.5 (C-3'),146.2 (C-4'),112.4(C-5'),118.8 (C-6'),31.9 (C-7'),35.4 (C-8'),55.6(4'-OCH3)。以上数据与文献报道一致[13],确定化合物8 为6-羟基-2-[2-(3-羟基-4-甲氧苯)乙基]色酮。
化合物9:无色油状物。ESI-MSm/z333.3 [M+Na]+,分子式C19H18O4;1H-NMR (500 MHz,CDCl3)δ: 7.57 (1H,d,J=2.5 Hz,H-5),7.39 (1H,d,J=9.4 Hz,H-8),7.24 (1H,dd,J=9.4,2.5 Hz,H-7),7.13(2H,d,J=8.5 Hz,H-2',6'),6.85 (2H,d,J=8.5 Hz,H-3',5'),6.15 (1H,s,H-3),3.91 (3H,s,6-OCH3),3.80 (3H,s,4'-OCH3),3.02 (2H,m,H-7'),2.92 (2H,m,H-8');13C-NMR (125 MHz,CDCl3)δ: 168.3 (C-2),109.5 (C-3),178.3 (C-4),104.9 (C-5),151.4 (C-6),123.6 (C-7),119.3 (C-8),156.8 (C-9),124.3 (C-10),131.8 (C-1'),129.3 (C-2',6'),114.1 (C-3',5'),158.3(C-4'),32.2 (C-7'),36.4 (C-8'),55.3 (4'-OCH3),56.0(6-OCH3)。以上数据与文献报道一致[14],确定化合物9 为6-甲氧基-2-[2-(4-甲氧基苯)乙基)]色酮。
化合物10 和11:一对对映异构体,化合物10的比旋光度为+28.6 (c0.7,MeOH),化合物11的比旋光度为-27.2 (c0.7,MeOH)。化合物10和11 都是浅黄色粉末。208 (3.42),221 (3.47),285 (3.01);ESI-MSm/z283.3 [M+H]+,分子式C17H14O4;1H-NMR (500 MHz,CD3OD)δ:8.09 (1H,dd,J=8.0 Hz,H-5),7.77 (1H,dd,J=8.4,7.2 Hz,H-7),7.56 (1H,d,J=8.4 Hz,H-8),7.46 (1H,dd,J=8.0,7.2 Hz,H-6),7.23 (2H,d,J=8.5 Hz,H-2',6'),6.75 (2H,d,J=8.5 Hz,H-3',5'),6.24 (1H,s,H-3),3.87 (3H,s,6-OCH3),5.08 (1H,dd,J=8.2,5.5 Hz,H-7'),3.10 (1H,dd,J=14.3,8.2 Hz,H-8'a),3.04 (1H,dd,J=14.3,5.5 Hz,H-8'b);13C-NMR (125 MHz,CD3OD)δ: 169.7 (C-2),112.0 (C-3),180.6(C-4),126.1 (C-5),126.5 (C-6),135.4 (C-7),119.3(C-8),158.1 (C-9),124.4 (C-10),135.6 (C-1'),128.2(C-2',6'),116.2 (C-3',5'),158.2 (C-4'),72.4 (C-7'),45.2 (C-8')。以上数据与文献报道一致[15],确定化合物10 和11 的平面结构为2-[2-羟基-2-(4-羟基苯)乙基]色酮。由于化合物10 的比旋光度符号和Cotton效应 [λmax(Δε):236(+3.56)、271(+1.09)nm]与(R)-6-甲氧基-2-[2-羟基-2-(3-甲氧基-4-羟基苯)乙基]色酮的{+16.3;λmax(Δε):241(+2.96)、280(+1.62)nm}一致,确定其结构为 (R)-2-[2-羟基-2-(4-羟基苯)乙基]色酮。同理,化合物11 的比旋光度符号和Cotton 效应 [λmax(Δε):233(-2.56)、266(-1.09)nm]与 (S)-6-甲氧基-2-[2-羟基-2-(3-甲氧基-4-羟基苯)乙基]色酮的{-22.3;λmax(Δε):241(-2.96)、280(-1.62)nm}一致,确定其结构为(S)-2-[2-羟基-2-(4-羟基苯)乙基]色酮[16]。
化合物12:黄色无定形固体。ESI-MSm/z153.1[M+H]+,分子式C8H8O3;1H-NMR (500 MHz,CDCl3)δ: 8.06 (2H,d,J=8.5 Hz,H-2,6),6.95 (2H,d,J=8.5 Hz,H-3,5),3.88 (3H,s,7-OCH3);13C-NMR (125 MHz,CDCl3)δ: 122.5 (C-1),131.7(C-2,6),115.7 (C-3,5),161.8 (C-4),160.5 (C-7),53.0(7-OCH3)。以上数据与文献报道一致[17],确定化合物12 为4-羟基苯甲酸甲酯。
化合物13:白色无定形固体。ESI-MSm/z149.1[M+H]+,分子式C10H12O;1H-NMR (500 MHz,CDCl3)δ: 7.26 (2H,d,J=8.6 Hz,H-2,6),6.83 (2H,d,J=8.6 Hz,H-3,5),6.35 (1H,d,J=15.9 Hz,H-1'),6.09 (1H,dq,J=15.9,6.6 Hz,H-2'),3.88 (3H,s,4-OCH3),1.86 (3H,d,J=6.6 Hz,H-3');13C-NMR(125 MHz,CDCl3)δ: 130.8 (C-1),126.9 (C-2,6),113.9 (C-3,5),158.6 (C-4),130.4 (C-1'),123.5 (C-2'),18.3 (C-3'),55.3 (4-OCH3)。以上数据与文献报道一致[18],确定化合物13 为4-丙烯基苯甲醚。
化合物17:黄色油状物。ESI-MSm/z411.7 [M+H]+,分子式C30H50;1H-NMR (500MHz,CDCl3)δ:5.11 (6H,m,H-3,7,11,14,18,22),2.02 (20H,m,H-4,5,8,9,12,13,16,17,20,21),1.68 (6H,s,H-1,24),1.60 (18H,s,H-2',6',10',15',19',23');13C-NMR (125 MHz,CDCl3)δ: 17.7 (C-1,24),131.3(C-2,23),124.4 (C-3,22),26.8 (C-4,21),39.8 (C-5,20),134.9 (C-6,19),124.2 (C-7,18),26.7 (C-8,17),39.7 (C-9,16),135.1 (C-10,15),124.3 (C-11,14),28.3 (C-12,13),25.7 (C-2',23'),16.0 (C-6',19'),16.1(C-10',15')。以上数据与文献报道一致[22],确定化合物17 为角鲨烯。
4 抗炎活性测试
4.1 细胞毒活性
采用MTT 法测试化合物1~9、12~17 对小鼠单核巨噬细胞 RAW264.7 的细胞毒活性[23]。RAW264.7 细胞用含10% FBS 的DMEM 培养液于37 ℃、5% CO2培养箱中常规培养。细胞按1×105个/mL 接种于96 孔板中培养24 h 后,加入100 μL待测化合物溶液(100 µmol/L),置于37 ℃、5% CO2细胞培养箱中贴壁72 h 后,向每孔细胞中加入15 μL 质量浓度为5 mg/mL 的MTT 溶液,37 ℃条件下反应4 h 后吸走上清液,向每孔加入100 μL DMSO 充分溶解,于酶标仪490 nm 波长下测定每孔的吸光度(A)值,每组实验平行3 次。按公式计算细胞生长抑制率。
抑制率=1-A实验/A0
A0为空白组(100 μL 培养液)的吸光度,A实验为实验组(100 μL 化合物/药物)的吸光度
实验结果显示,以上化合物在100 µmol/L 浓度下不具有细胞毒活性。
4.2 抑制脂多糖(lipopolysaccharide,LPS)诱导小鼠单核巨噬细胞RAW264.7 产生NO 的活性
建立LPS 诱导小鼠单核巨噬细胞RAW264.7 模型,采用Griess 法测试化合物1~9、12~17 的抗炎活性[24-25]。RAW264.7 细胞用含10% FBS 的DMEM 培养液于37 ℃、5% CO2培养箱中常规培养。细胞按1×105个/mL 接种于96 孔板中培养24 h后,加入50 μL 待测化合物溶液(化合物浓度为100、50、25、12.5、6.25 µmol/L),继续培养1 h 后,加入50 μL LPS,置于37 ℃、5% CO2细胞培养箱中贴壁24 h 后,取100 μL 于新的96 孔板中,之后向每孔加入100 µL(40 mg/mL)Griess 试剂,混匀后于酶标仪540 nm 波长下测定各孔的A,每组实验平行3 次。按公式计算NO 抑制率。最后利用GraphPad Prism 软件处理数据,求得化合物对LPS 诱导RAW264.7产生NO 的半抑制浓度(median inhibition concentration,IC50)。
抑制率=(A2-A1)/(A2-A0)
A0为空白对照组(50 μL 培养液+50 μL 培养液)的吸光度,A1为药物组(50 μL 化合物/药物+50 μL 脂多糖)的吸光度,A2为LPS 诱导组(50 μL 培养液+50 μL 脂多糖)的吸光度
实验结果显示,化合物8 具有抑制LPS 诱导小鼠单核巨噬细胞RAW264.7 产生NO 的活性,IC50值为(27.81±2.34)μmol/L。阳性对照槲皮素和吲哚美辛的IC50值分别为(12.46±0.24)、(35.40±1.34)μmol/L。其他化合物无明显抗炎活性。
5 讨论
本研究从栽培奇楠沉香中分离鉴定了17 个化合物,化合物1 为新化合物,榄香烷倍半萜16 首次在沉香属植物中发现。化合物8 具有一定的抗炎活性,IC50值为(27.81±2.34)μmol/L。研究组前期研究发现国产野生绿奇楠中色酮母核无取代的2-(2-苯乙基)色酮衍生物约占2-(2-苯乙基)色酮类化合物总数1/2,是野生奇楠沉香中主要的化合物类型[2],而普通沉香中2-(2-苯乙基)色酮的色酮母核绝大多数被羟基或甲氧基取代。与野生奇楠沉香类似,本研究从栽培奇楠沉香中鉴定的化合物1~7 和10~11 为色酮母核无取代的2-(2-苯乙基)色酮衍生物,进一步揭示了栽培奇楠沉香与野生奇楠沉香具有相似性,但前期对奇楠沉香致香成分的分析结果和本研究所分离化合物的香气分析结果表明,二者在沉香香气成分组成上有一定差异,形成了各自不同的香气特征[4,8-9]。GC-MS 分析结果表明化合物2和5 是奇楠沉香的主要成分[8],本研究发现化合物3 和8 也是栽培奇楠沉香的主要成分,下一步可综合利用GC-MS 和LC-MS 分析并挖掘沉香的特征性成分,完善栽培奇楠沉香与野生奇楠沉香的标准,为奇楠沉香的合理利用提供科学依据。
利益冲突所有作者均声明不存在利益冲突

