艾米替诺福韦治疗慢性乙型肝炎患者的早期疗效:一项真实世界多中心临床研究
李亚萍 崔丹丹 苟国娥 蔺咏梅 祖红梅 徐光华 高晓红 党双锁
作者单位:710004 陕西 西安交通大学第二附属医院(李亚萍,崔丹丹,苟国娥,党双锁);西安交通大学附属三二〇一医院(蔺咏梅);青海省第四人民医院(祖红梅);延安大学附属医院(徐光华,高晓红)
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是严重的全球公共卫生问题,全球约有超过2.57亿的HBV感染者,每年约有88.7万人死于HBV感染相关疾病,已证明抗病毒治疗可以改善患者预后,提高生存期[1-2]。目前一线抗病毒药物主要包括恩替卡韦(entecavir, ETV)、富马酸替诺福韦(tenofovir disoproxil fumarate, TDF)和富马酸丙酚替诺福韦(tenofovir alafenamide fumarate, TAF)[3]。目前面临着ETV耐药率逐年升高且长期使用TDF抗病毒有骨肾损害的风险[1, 4-5],TAF可强效抗病毒且骨肾安全性好[6],艾米替诺福韦(Tenofovir amibufenamide, TMF)作为我国首个抗HBV原研药在TAF的酰胺化基团上增加了一个甲基优化了结构,提高了药物的血浆稳定性[7]。TMF的III期临床试验表明其具有较好的抗病毒疗效及骨肾安全性[8],但目前尚无TMF真实世界的临床研究数据。本研究主要分析TMF在真实世界治疗CHB患者的早期抗病毒疗效和安全性,为后续CHB抗病毒治疗的选择提供参考。
资料与方法
一、研究对象
选择2021年8月—2022年8月西安交通大学第二附属医院、西安交通大学附属三二〇一医院、青海市第四人民医院、延安大学附属医院感染科门诊就诊的CHB患者,纳入标准:①符合《慢性乙型肝炎防治指南(2019年版)》[3]诊断标准的CHB患者;②年龄18周岁~65周岁,性别不限;③符合CHB治疗要求的初治患者或已接受核苷酸类似物抗病毒治疗(至少48周)但疗效不佳或已经出现肾、骨安全性问题需要换药的经治患者;④定期随访且疗程至少24周。排除标准:①有证据提示为肝细胞癌或血清甲胎蛋白>100 g/L;②合并感染丙型或丁型病毒性肝炎、艾滋病、自身免疫性肝炎或其他原因所致的活动性肝炎;③合并严重的心肺功能异常、晚期肿瘤、中枢神经系统(如有癫痫病史)或其他系统疾病者;④对核苷或核苷类似物有过敏史;⑤妊娠及哺乳患者。本研究已通过医学伦理委员会批准, 伦理批号:2022016,所有患者入组前签署了书面知情同意书。
二、研究方法
全部患者签署知情同意书,自签署日起口服艾米替诺福韦片25 mg,1次/d,需随食物服用。收集患者的基本信息,包括基线及治疗过程中HBV DNA定量、丙氨酸氨基转移酶(alanine transaminase, ALT)、乙型肝炎表面s抗原(hepatitis B virus surface antigen, HBsAg)定量、乙型肝炎e抗原(hepatitis B virus e antigen, HBeAg)定量,肌酐(creatinine, Cr)、估算的肾小球滤过率(estimated glomerular filtration rate, eGFR)、血胱抑素C (Cystatin C, CysC)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)和反映肾小管功能的尿β2微球蛋白(β2-MG)、尿α1微球蛋白(α1-MG)、尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)。
三、观察指标
主要疗效指标:12周、24周时完全病毒学应答(HBV DNA <20 IU/mL)及HBV DNA(lg IU/mL)水平变化。次要疗效指标:基于实验室标准(ULN:男性≤50 U/L;女性≤40 U/L)及AASLD 2018 标准[9](ULN: 男≤35 U/L, 女 ≤25 U/L))的ALT复常率、血清学(HBsAg、HBeAg转阴率和HBsAg、HBeAg血清转换率)、肾功能和血脂的变化情况。
四、检测方法
使用罗氏公司生产的全自动AmpliPrepCOBAS TaqMan48系统检测仪及其配套试剂检测血清HBV DNA(<20 IU/mL时被定义为完全病毒学应答);使用上海科华生物工程股份有限公司生产的奥林巴斯 AU2700 生化仪检测ALT(ULN:男性≤50 U/L;女性≤40 U/L);使用美国雅培公司生产的Architect i2000化学发光免疫分析仪及其配套试剂检测血清HBV标志物(血清HBsAg<0.05 IU/mL被定义为HBsAg转阴,血清抗-HBs≥10 mIU/mL被定义为HBsAb阳性;HBeAg<1 s/co被定义为HBeAg转阴,血清抗-HBe>1 s/co被定义为抗-HBe阳性)。
五、统计学处理
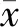
结 果
一、一般资料
共入组91例患者,初治28例,63例为经治患者,具体基线资料见表1。
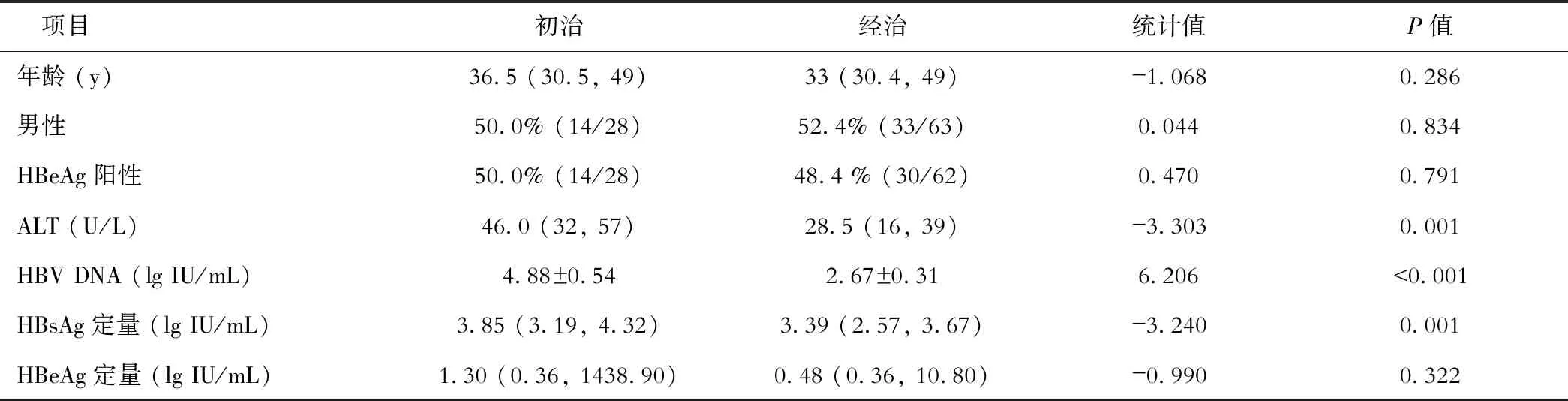
表1 91例CHB患者基线资料
二、病毒学应答情况
初治患者在12周、24周时实现完全病毒学应答(HBV DNA <20 IU/mL)的比率分别是17.4%、47.9%,两组数据对比差异有统计学意义(χ2=4.623,P=0.032)。经治63例患者中有32例在改用TMF前已实现完全病毒学应答,余31例患者在12周和24周实现完全病毒学应答的比例分别是48.4%、58.1%,两组数据对比差异无统计学意义(χ2=0.583,P=0.445)。
初治患者HBV DNA水平由基线(4.88±0.54) lg IU/mL在治疗后的12周和24周分别下降至(2.69±0.35)、(2.40±0.39) lg IU/mL,组间比较差异具有统计学意义(F=24.51,P<0.001),组内比较仅12周与24周对比差异无统计学意义(t=0.139,P=0.312)。
经治患者HBV DNA水平由基线(2.67±0.31) lg IU/mL在治疗后的12周和24周分别下降至(1.70±0.24)、(1.49±0.09) lg IU/mL, 组间比较差异具有统计学意义(F=5.83,P=0.009),组内比较 12周与24周数据对比差异无统计学义(t=1.472,P=0.148)。
三、ALT的变化
总体ALT中位数由基线的33(20, 48)U/L在12周、24周分别降至27(18, 40)U/L、22(16, 31)U/L,组内比较差异具有统计学意义(χ2=23.486,P<0.001)。
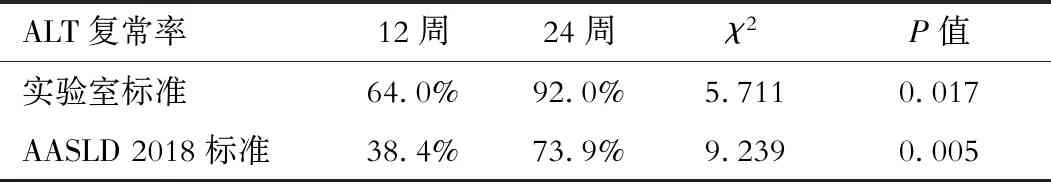
表2 12周、24周 ALT复常情况
四、HBeAg和HBsAg的变化
在TMF治疗过程中有2例经治患者实现HBeAg转阴,占比4.53% (2/46),1例患者在24周时实现HBeAg血清转换,转换率2.17% (1/46)。24周时1例患者HBsAg转阴,转阴率1.09% (1/91),暂未出现HBsAg血清转换患者。
五、肾功能、血脂变化情况
与基线相比,CHB患者治疗24周时血Cr、eGFR、CysC无显著变化,TG较基线有下降趋势,TC有升高趋势,但差异无统计学意义(见表3)。
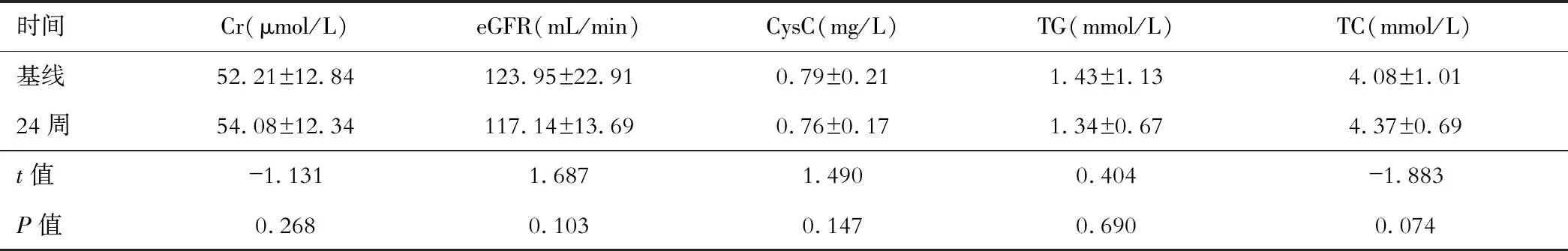
表3 CHB患者基线及TMF抗病毒治疗24周时肾功能和血脂变化
本研究中有33例经治患者因出现肾脏损伤换用TMF继续抗病毒治疗,尿α1-MG和尿NAG、尿β2-MG由基线(26.97±2.81)mg/L、(19.23±1.54)U/L、(0.43±0.06)mg/L,24周复查分别下降为(18.44±2.38)mg/L、(14.64±1.48)U/L、(0.29±0.04)mg/L,差异有统计学意义(均P<0.05)。
讨 论
TMF具有比TAF细胞膜透过速率更快、血浆中稳定性更好等特点,能更好地发挥抗病毒作用[7]。TMF的III期临床试验总体完全病毒学应答率为60.7%[8],略高于本研究治疗24周时初治及经治患者47.6%、58.1%的完全病毒学应答率,考虑与本研究抗病毒治疗时间尚短有关。TAF抗病毒治疗效果不劣于TDF[10-12],本研究TMF抗病毒疗效高于TAF 24周时25%~39.34%的完全病毒学应答率[11, 13]。其中经治患者24周实现完全病毒学应答的比例更高,考虑与其既往已行抗病毒治疗病毒载量较低有关,但同时也从侧面反映了对于ETV、TDF等抗病毒治疗效果不佳的患者改用TMF继续抗病毒治疗的可行性,也可能在改善耐药方面存在优势。
ALT复常率方面,TMF在真实世界中也表现出较好的优势,本研究中基于实验室、AASLD 2018标准的24周ALT复常率分别是92%、73.9%,都略高于TMF III期临床试验中48周时的83.8%和72.1%[8],考虑与真实世界研究中抗病毒同时加用保肝药物有关。基于实验室标准TMF抗病毒治疗12周时ALT的复常率是64%,低于TAF治疗12周的81.3%,但24周时的数据略高于TAF 87.5%的ALT复常率[13]。基于AASLD 2018 标准,TAF在治疗48周时ALT的复常率为50%,高于TDF的32%[10, 14]。TMF在抗病毒治疗24周时ALT的复常率是73.9%同时高于TDF和TAF,也与TMF III期临床试验中TMF的48周ALT复常率高于TDF(P<0.017)相一致。
血清学应答方面,TMF在真实世界治疗CHB患者的HBeAg血清学转阴率及转换率低于TMF的III期临床48周时的17.2%、9.4%[8],主要因为该研究治疗时间短,尚不足以使部分高HBeAg水平的患者出现转阴甚至发生转换;其次多数经治患者存在其他抗病毒方案治疗效果不佳问题,这部分患者更不易实现HBeAg转阴或血清学转换。HBsAg转阴可改善CHB患者预后[1, 15],本研究中1.09%的患者实现HBsAg转阴,TAF治疗96周时仅有1%的患者发生HBsAg转阴[6],TMF的III期临床试验中也仅有0.6%的患者实现这一目标[8]。
CHB患者抗病毒治疗的肾损伤风险也是临床医师非常关注的问题,尤其是TDF肾小管损伤问题[4, 16]。一项10年的临床研究中,5.1%的CHB患者在TDF治疗期间出现肾功能不全[17-18]。TMF的III期临床试验中,抗病毒治疗48周时TMF组较TDF组出现eGFR下降、血Cr增加的比率低,TDF组出现肾衰的患者比TMF组多8.67%[8]。本研究中TMF治疗24周后血Cr、eGFR、CysC较基线变化无明显差异(P<0.005),宁会彬等[19]发现,尿肾小管检测指标(尤其是尿α1-MG和尿NAG)比血Cr、eGFR、CysC能更早发现CHB患者早期肾损伤。本研究中出现抗病毒药物相关肾脏损伤的患者换用TMF继续治疗后24周复查尿α1-MG和尿NAG、尿α2-MG较前显著下降,提示TMF治疗有较好的肾脏安全性。因此,TMF是CHB患者长期抗病毒治疗的较好选择,特别是对那些有肾损伤风险的患者。
CHB患者抗病毒治疗期间引发的血脂异常问题也是近年来关注的热点。本研究显示TMF抗病毒治疗24周后TG较基线下降,TC升高但差异无统计学意义,与TMF III期临床试验相一致[8],TAF抗病毒治疗后也可以使血脂升高,主要表现为TC升高[10, 14, 20],但目前核苷(酸)类似物引起脂质代谢异常的原因尚不明确。
TMF在真实世界中的研究显示抗病毒疗效强、ALT复常率高,对于抗病毒治疗应答不佳的经治患者也有很强的抗病毒作用,同时具有肾损伤小的特性。本研究主要的不足之处是观察时间短,病例数较少,仍需动态随访及进一步扩大样本量,观察药物的疗效及安全性。
利益冲突声明:所有作者均声明不存在利益冲突。

