锰源对尖晶石LiMn2O4高温性能的影响
刘培松 宋利君 黄朝连 胡 磊 卢晓英*, 江 奇*,
(1西南交通大学材料先进技术教育部重点实验室,超导与新能源研究开发中心,成都 610031)
(2安徽南都华拓新能源科技有限公司,阜阳 236000)
(3苏州热工研究院有限公司,苏州 215004)
0 引言
尖晶石LiMn2O4(LMO)的安全性好、工作电压高、倍率性能突出且原料成本低廉、对环境友好,是动力锂离子电池的常见正极材料之一[1‑3],但其应用一直受到LMO高温衰减较快的影响[4]。尖晶石LMO的高温不稳定性,通常认为是Jahn‑Teller效应、Mn的溶解和电解液分解等引起的[5‑7]。目前市面上的尖晶石LMO主要是将锰源和锂盐球磨混合,然后经高温煅烧而来。而锰源主要是一些锰氧化物,主要有MnO2、Mn2O3和Mn3O4等。这些锰氧化物都可用于制备LMO,且表现出不同的电化学性能。如:Fang等用水热法合成的α‑MnO2作为锰源,采用CH3COOLi·6H2O作为锂盐,在600℃煅烧4 h得到LMO。其在0.2C下,初始放电比容量达到120 mAh·g-1[8]。Zhang等利用水热法制备得到Mn3O4,然后通过高温固相法制备出尖晶石LMO。其在0.1C下的初始放电比容量为115 mAh·g-1,循环60次后,容量保持率为98.3%[9]。Wai等用沉淀法制备出球形Mn2O3,然后通过固相法得到尖晶石LMO。其在0.1C下的初始放电比容量为103.2 mAh·g-1,即使在1C下,初始放电比容量也可以维持在100.5 mAh·g-1,循环100次容量保持率达到了96%[10]。由此可见,锰源不同,LMO的电化学储能性能(常温)不同。目前LMO研究的重点是提高高温(55℃)下的循环性能和倍率性能,而关于锰源对LMO电化学性能(特别是高温性能)的影响还未见报道。为此,在本课题组对尖晶石LMO已有的研究基础上[11‑12],通过水热法先制备锰氧化物前驱体MnCO3,然后根据不同的煅烧温度(400、600和950℃)获得了不同的锰氧化物(MnO2、Mn2O3和 Mn3O4),再采用相同条件(温度和时间)下的高温固相法制备得到LMO(为提高其高温性能,在制备MnCO3过程中加入金属铝粉,先得到铝掺杂的锰氧化物,最终得到铝掺杂的LMO),并进行了相应的结构和电化学性能测试表征,以此来探讨锰源对所得LMO正极材料高温性能的影响。研究表明,不同煅烧温度下可以获得不同的锰氧化物,且其形貌结构存在差异。所得MnO2具有致密球形结构,导致由其所得的LMO也保持球形的二次颗粒结构。而Mn2O3具有疏松的球形结构,由其所得的LMO无法保持球形的二次颗粒。而Mn3O4则是棒状结构。由这3种锰氧化物所制备的LMO的电化学储能性能也有较大差异。其中,由Mn2O3得到的LMO无论是在常温(25℃)还是高温(55℃)下,容量性能、倍率性能和循环性能均最好。
1 实验部分
1.1 不同锰氧化物的制备
参照课题组已有的方法制备含Al的MnCO3前驱体[11‑12]。按照分别取3.381 g MnSO4·H2O 和 3.160 g NH4HCO3。将 MnSO4·H2O 溶于150 mL去离子水和300 mL乙二醇的混合溶液中,同时加入0.7 g聚乙烯吡咯烷酮和适量金属铝粉(nMn∶nAl=99∶1),磁力搅拌 2 h,标记为溶液 A。另外将NH4HCO3溶解于50 mL去离子水中,标记为溶液B。在连续搅拌条件下,将溶液B缓慢滴加入溶液A中,使 Mn2+与 CO32-接触,逐渐产生乳白色沉淀。连续搅拌该悬浊液2 h后,过滤、洗涤沉淀物。将获得的沉淀物用去离子水和无水乙醇多次洗涤,然后在80℃的真空干燥箱中保温4 h,得到白色MnCO3前驱体(此处前驱体含金属Al,由于Al加入量少且本文中并不讨论Al的影响,因此下文如无特别说明,均指含少量Al成分的材料)。
将所得前驱体放入马弗炉中,经400℃煅烧6 h后,得到MnO2;经600℃下煅烧6 h后,得到Mn2O3;经950℃煅烧得到6 h后,得到Mn3O4。
1.2 尖晶石LMO的制备
采用锂盐渗透方式,先制备前驱体,然后经高温固相法获得LMO[11]。按nLi+∶nMn=1.05∶2分别称取LiOH·H2O和MnO2,加入40 mL去离子水,并加入10 mL乙二醇作为锂离子渗透引发剂[13],在80℃下进行水浴搅拌,使Li+充分渗透于锰氧化物的颗粒中,待溶液蒸干后,放入鼓风干燥箱120℃干燥4 h,然后在玛瑙研磨钵中研磨均匀,最后在马弗炉中750℃下煅烧15 h,得到尖晶石LMO,命名为LMO‑MnO2。同样操作下,锰源换用Mn2O3和Mn3O4后得到LMO‑Mn2O3和LMO‑Mn3O4。
1.3 材料形貌结构表征和电化学性能测试
所得材料的形貌结构分别采用X射线衍射仪(XRD,X′Pert PRO,CuKα靶,工作电压40 kV,工作电流40 mA,波长λ=0.154 056 nm,扫速5(°)·min-1,扫描范围2θ=10°~80°)、扫描电子显微镜(SEM,JEOL JSM‑7001F,加速电压为20 kV)、拉曼光谱(XPLORA one,λ=532 nm)和粒径分析仪(Malvern Mastersizer 3000,乙醇为载液)进行表征。
电池组装:首先按质量比85∶10∶5称取LMO、乙炔黑、黏结剂(质量分数2.5% 的LA132溶液),将其放入玛瑙研钵中充分研磨混合均匀,然后将该浆料涂覆在铝箔上制备电极片,静置干燥后冲裁成直径为14 mm的正极片。将电极片放入真空干燥箱中,在120℃下真空干燥12 h,完成后进行扣式电池的组装。电解液采用1.0 mol·L-1的LiPF6(碳酸乙烯酯、碳酸二甲酯体积比1∶1),隔膜为Celgard 2400隔膜,金属锂片为负极,全程均在氩气气氛手套箱中进行。
采用CT‑3008型全自动电池程控测试仪在25和55℃下分别进行扣式电池不同倍率下(1C=148 mA·g-1)的恒流充放电测试以及循环性能测试,测试电压区间为3.2~4.3 V。采用电化学工作站(CHI660E)对组装的纽扣电池进行循环伏安(CV,电压范围为3.2~4.5 V,扫速为0.2 mV·s-1)和交流阻抗谱(EIS,测试电压为开路电压3.0 V,频率范围为105~10-2Hz,振幅为5 mV)测试。
2 结果与讨论
2.1 XRD分析
图1为所得材料的XRD图。由图1a可知,在400℃煅烧6 h后所得锰氧化物的XRD图与标准卡片PDF No.72‑1982完全吻合,因此所得中间体为α‑MnO2,属于四方晶系I4/m空间群。在12.7°、18.0°和28.7°处的峰分别对应 MnO2的(110)、(200)和(310)晶面。而在600℃下煅烧6 h所得锰氧化物的XRD图则与标准卡片PDF No.71‑0636相对应,为立方晶系Mn2O3,属于Ia空间群,其3个主要特征峰分别位于18.7°、36.2°和 44.1°,对应立方晶系 Mn2O3的(211)、(222)和(400)晶面。而在950℃煅烧6 h所得锰氧化物的XRD图则与标准卡片PDF No.89‑4837相对应,为四面体结构的Mn3O4,属于I41/a空间群,其在29.3°、32.7°、36.1°和 59.9°处的特征峰分别对应Mn3O4的(112)、(211)、(220)和(105)晶面。
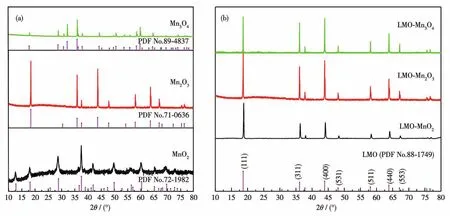
图1 (a)锰氧化物和(b)LMO的XRD图Fig.1 XRD patterns of(a)manganese oxide and(b)LMO
图1b为由不同锰氧化物所制备LMO的XRD图。由图1b可知,3种材料的XRD图均与PDF No.89‑4837完全吻合,无其他峰出现,表明所有LMO纯度都较高,无杂质生成。且3种LMO都为面心立方结构,同属于Fd3m空间群[14]。在 18.6°、36.1°、43.9°和58.1°处的衍射峰分别对应尖晶石LMO的(111)、(311)、(400)和(511)晶面,相关的晶胞参数如表1所示。

表1 不同锰氧化物所制备LMO的晶胞参数Table 1 Unit cell parameters of LMO prepared from different manganese oxides
表1为3种LMO的晶胞参数数据。由表1可知,所得LMO的晶胞参数a相对于标准参数都出现了一定程度的减小,这是Al掺杂的结果。Al进入到晶体结构中可以降低Mn—O键的强度,从而使LMO晶胞体积出现一定程度的收缩,这有利于提高LMO的稳定性[12]。同时,不同锰氧化物获得的LMO的晶胞参数a是不同的。其中由Mn2O3制备的LMO的晶胞参数a最小,预示其具有最好的稳定性能。
LMO的(311)和(400)晶面的衍射峰强度比(I(311)/I(400))可以反映其结构的稳定性能[11]。该比值越小,表明LMO晶体的结构畸变程度越小,晶体结构越稳定,有助于材料电化学性能的提升。LMO‑Mn2O3的强度比最小,为0.868 6。说明在3种LMO中,LMO‑Mn2O3的畸变程度最低,说明具有最出色的电化学储能性能。
2.2 SEM分析
图2为所得材料的SEM图。由图2可知,将锰氧化物前驱体MnCO3在不同温度下煅烧后,得到的锰氧化物呈现出不同的形貌结构。所得MnO2和Mn2O3均为球形结构,且由局部放大图可知,MnO2的球形结构比较致密,而Mn2O3则由于煅烧温度的升高,球形结构已经不致密,出现明显的条状结构。随着温度的进一步提高,Mn3O4已经不是球形结构,而表现出散乱的棒形结构。这是由于煅烧温度的升高,导致晶体结构进一步生长,各晶面的生长速率随温度升高而出现不同,使得球形结构坍塌。

图2 所得材料的SEM图(插图为局部放大图)Fig.2 SEM images of the obtained materials(Insets:the enlarged views)
而由SEM可知3种LMO均具有八面体结构。但仅LMO‑MnO2的二次颗粒继续保留了MnO2的球形结构。LMO‑Mn2O3的二次颗粒则由于原材料Mn2O3球形结构不致密,导致无法维持球形形貌。至于LMO‑Mn3O4,由于原材料Mn3O4具有散乱的棒形结构,导致其最终得到的LMO结构也不具有球形结构。由此可以看出,锰氧化物的形貌结构与其最终产物LMO的二次颗粒形貌结构具有一定的关系。由图2b可知,所得LMO部分颗粒具有八面体结构,但同样也有部分颗粒呈现不规则形状。说明在同样制备条件下,LMO‑MnO2的生长并不彻底,这将降低其电化学性能[15]。而图2d表明LMO‑Mn2O3的棱角分明,表面光滑,呈现出良好的八面体结构,颗粒尺寸分散均匀。同时图2f中的LMO‑Mn3O4也是部分生成八面体结构,部分颗粒呈现不规则形状,且颗粒之间的大小差异较大。因此,在同样制备条件下,不同的锰氧化物会导致所得LMO中八面体的尺寸大小及含量的变化。在本工作中,LMO‑Mn2O3的八面体含量最多,尺寸也最均匀。
2.3 拉曼和粒径分析
图3是所得LMO的拉曼谱图和粒径分布图。由图3a可知,3种LMO在200~800 cm-1范围内都只有一个主峰,位于600~640 cm-1附近,这是Mn—O的特征振动峰,其中LMO‑MnO2的特征峰位于631.1 cm-1,而 LMO‑Mn2O3和 LMO‑Mn3O4的特征峰位于629.3 cm-1,峰位出现一定程度的红移,说明LMO‑Mn2O3和LMO‑Mn3O4的畸变程度相对减小,结构更加稳定[16]。由图 3b可知,LMO‑MnO2、LMO‑Mn2O3、LMO‑Mn3O4的粒径分布都主要集中在1~3 μm之间,最概然分布分别为2.2、1.6和1.4 μm。其中 LMO‑MnO2的粒径相对较大,LMO‑Mn3O4的粒径相对最小,LMO‑Mn2O3的粒径尺寸居中,这与图2的SEM结果一致。LMO颗粒的大小会影响材料的电化学性能:颗粒过大,会阻碍Li+在晶体结构中的脱出和嵌入,影响材料的倍率性能[12];颗粒过小,材料的比表面积增大,电解液对LMO的腐蚀速率增大[17],材料的容量衰减会加重。

图3 所得材料的拉曼谱图(a)和粒径分布(b)Fig.3 Raman spectra(a)and particle size distribution curves(b)of the obtained materials
2.4 电化学性能分析
图4为所制备材料在不同温度下的电化学性能。图4a为在0.2 mV·s-1下的质量归一化CV曲线。由图可知,3个样品均有2对明显的氧化还原峰,对应尖晶石LMO中Li+的典型两级脱出和嵌入[18]。在充电过程中,3.95 V(vs Li/Li+)的峰,对应具有Li‑Li相互作用的一半四面体位点的Li+脱出形成Li0.5Mn2O4的过程;而4.15 V(vs Li/Li+)的峰则对应剩下的没有Li‑Li相互作用的另一半四面体位点的Li+脱出形成Li0.25Mn2O4的过程[15]。电池放电时反应过程则相反。这与图4b中首次充放电曲线中的2个电压平台(3.95和4.15 V)相对应。此外由于是归一化的CV曲线,因此CV曲线所包含的面积可大致反映其可逆容量的大小[19],从图4a可大致看出LMO‑MnO2的面积最小,暗示其可逆容量最低。
图4b为25℃时,0.5C倍率下的首次充放电曲线。3种材料都在3.95和4.15 V附近出现了2个电压平台,分别对应LMO在充放电时发生的2段典型的 Li+脱出和嵌入反应[18]。且 LMO‑MnO2、LMO‑Mn2O3、LMO‑Mn3O4的首次充放电效率分别为92.3% 、87.7% 和83.2%。在首次充放电中发生的不可逆容量损失,主要是由于固体电解质界面(SEI)膜的形成[20]。适量的SEI膜对维持材料的稳定性具有一定的提升作用,但过量的SEI膜会使电池的内阻增加[21]。

图4 所制备材料在25℃(a~d)和55℃(e、f)下的电化学性能Fig.4 Electrochemical performance of the materials at 25 ℃ (a‑d)and 55 ℃ (e,f)
图4c为25℃时材料的倍率性能图。由图可知,在0.2C和0.5C倍率下,LMO‑Mn3O4的放电比容量分别为 130.3 和 122.3 mAh·g-1,而 LMO‑Mn2O3的分别是 131.8 和 124.5 mAh·g-1,LMO‑MnO2的分别为126.3和117.5 mAh·g-1。可见,LMO‑Mn3O4和LMO‑Mn2O3的放电比容量都优于LMO‑MnO2,但差距不大。但随着倍率的提高,其放电比容量的差距逐渐变大。比如当倍率达到3C时,LMO‑MnO2和LMO‑Mn3O4的放电比容量分别为86.1和97.1 mAh·g-1,而LMO‑Mn2O3的放电比容量还有 100.4 mAh·g-1。在5C倍率时,这种放电比容量的差距进一步加大。由此可见,锰氧化物的不同,不仅影响所得LMO的放电比容量,而且还会影响其倍率性能。LMO‑Mn2O3的放电比容量最高,也具有最好的高倍率性能,更加适合大电流充放电。
图4d为25℃时,0.5C下的循环曲线图。由图可知,LMO‑Mn3O4和LMO‑Mn2O3拥有较高的初始放电比容量,分别为 124.9和123.6 mAh·g-1,而LMO‑MnO2的放电比容量只有 118.7 mAh·g-1。LMO‑Mn2O3循环100次后的放电比容量仍然有116.0 mAh·g-1,容量保持率为93.9%。而 LMO‑MnO2循环100次后的放电比容量仅为105.5 mAh·g-1,容量保持率88.9%,LMO‑Mn3O4循环100次后放电比容量为112.0 mAh·g-1,容量保持率89.6%。由此可见,不管是从初始放电比容量还是从循环稳定性来看,LMO‑Mn2O3的性能都优于其他2种材料。
图4e为55℃时0.5C下的循环曲线图。由图可知,经过100次循环后3个样品的容量都出现了衰减。LMO‑MnO2的放电比容量从117.6 mAh·g-1衰减到77.1 mAh·g-1,容量保持率为66.1%。LMO‑Mn3O4从 124.3 mAh·g-1下降为 80.4 mAh·g-1,容量保持率为 64.7%。而 LMO‑Mn2O3从 123.5 mAh·g-1下降为89.5 mAh·g-1,容量保持率为72.5%。由此可见,在未进行其他处理的情况下,材料在高温下的容量衰减明显高于常温。但3种锰源制备的LMO中,LMO‑Mn2O3的衰减率最小。
图4f为55℃时的倍率性能图。由图可知,在0.2C下,LMO‑Mn2O3具有最高的放电比容量(131.9 mAh·g-1),LMO‑Mn3O4次之,LMO‑MnO2最低,只有125.1 mAh·g-1。在2C及更大倍率下,三者之间的差距进一步加大。如5C下,LMO‑Mn2O3有80.2 mAh·g-1的放电比容量,LMO‑Mn3O4只有 59.4 mAh·g-1,LMO‑MnO2仅有 36.7 mAh·g-1。由此可见,LMO‑Mn2O3在同样条件下,具有更好的高温容量性能、倍率性能和抗衰减能力。
LMO‑Mn2O3在常温和高温下的初始放电比容量、循环稳定性能和倍率性能都优于其他2种材料的主要原因是LMO‑Mn2O3中的八面体晶体含量较多且尺寸更均匀。这些八面体晶体上的(111)晶面可以有效降低Mn的溶解,提高其循环性能[22]。同时八面体晶体上的(001)和(110)晶面有利于Li+的通过,从而能有效提高材料的容量性能与高倍率性能[23]。至于材料中八面体含量的多少,应该与不同锰氧化物浸渍锂离子后的煅烧反应有关[13]。
图5为所制备材料的EIS谱图和Z′‑ω-1/2关系曲线。由图可知,3种材料的EIS谱图均由高频区的半圆和低频区的斜线组成[24]。通过计算,可以得到其电荷传质电阻(Rct)[8]。通过图5b可以获得其斜率σw,即Warburg常数。锂离子扩散系数可由下式计算[25]:DLi+=R2T2/(2A2F4n4c2σw2),其中R=8.314 J·K-1·mol-1,T=298.15 K,n为电子迁移数,A是电极面积(1.766 cm2),F为法拉第常数,c为 Li+浓度(0.023 8 mol·cm-3),计算结果如表2所示。
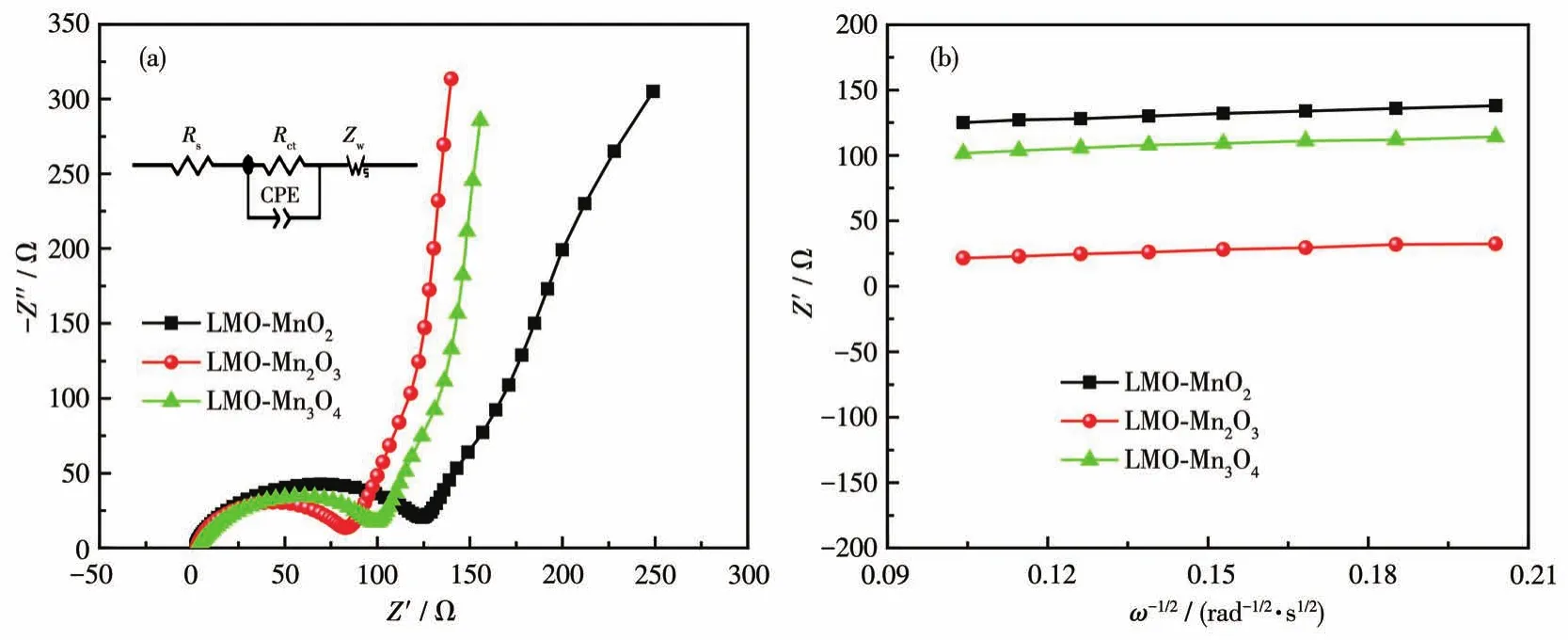
图5 所得材料的EIS曲线(a)和Z′‑ω-1/2关系曲线(b)Fig.5 EIS curves(a)and Z′‑ω-1/2curves(b)of the obtained materials
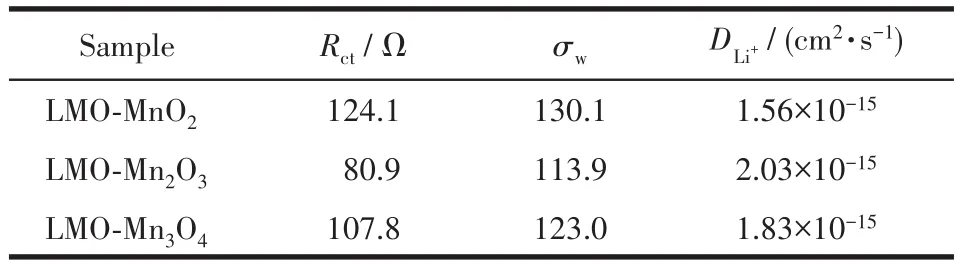
表2 所得材料的EIS数据Table 2 EIS data of the obtained materials
由表2可知,3种材料中LMO‑Mn2O3的Rct最小,为80.9 Ω。表明电荷在此材料中移动更加容易,预示着其具有更好的导电性能和倍率性能。而其DLi+最大,达到了 2.03×10-15cm2·s-1,这就是LMO‑Mn2O3具有最好的倍率性能和循环稳定性能的原因。
3 结论
采用沉淀法制备得到MnCO3前驱体,通过改变其煅烧温度可以获得具有不同形貌结构的MnO2、Mn2O3和Mn3O4。分别将其作为锰源,在同样条件下制备得到结晶性良好的LMO。但是这些LMO的形貌结构以及八面体晶体含量和尺寸大小不同。其中,LMO‑Mn2O3的八面体晶体含量最多,尺寸最均匀。电化学研究表明,得益于LMO‑Mn2O3具有最低的Rct和最高的DLi+,其具有最好的电化学储能性能,包括常温和高温下的容量性能、倍率性能和循环稳定性能等。因此Mn2O3更加适合用作LMO的锰源,这对于LMO高温下的倍率性能和抗衰减能力都有一定的促进作用。

