灵芝双向发酵液冻干粉抑制环氧化酶-2及抗氧化活性的研究
张影,孟宪瑶,李忠峰,杨云丽,郭苗苗,李丽*,周卫强
1(北京工商大学 化学与材料工程学院,北京,100048)2(北京市植物资源研究开发重点实验室,北京,100048)3(战略支援部队兴城特勤疗养中心,辽宁 兴城,125105)4(中粮营养健康研究院有限公司,北京,102209)
灵芝(Ganodermalucidum)又被称为“仙草”、“瑞草”、“还阳草”等,在《神农本草经》还被称为“神芝”[1],为多孔菌科(Polyporaceae)灵芝属 (Ganoderma)真菌[2]。作为我国药食两用传统珍贵中药,灵芝具有很高的药用价值[3]。灵芝化学成分复杂,其中的活性成分主要为灵芝多糖、灵芝多肽、灵芝三萜类化合物、蛋白质、氨基酸等[4-5],具有清除自由基、抗炎[6]、抗过敏、保湿、延缓皮肤衰老、祛斑美白等功效[7-9]。
来源于子实体的灵芝原料成本普遍较高,产品质量不稳定[7,10],将灵芝的菌丝体接种于液体培养基中,以一定转速和温度进行培养,菌丝体在培养基中获得合成代谢产物或生长繁殖所需营养物质的培养方式称为灵芝液体深层发酵培养。液体深层发酵技术因其生产周期短、效率高、产量大、品质稳定,已经成为开发利用灵芝资源的重要途径[11-13]。添加人参等药材进行灵芝液体深层发酵,既为菌丝体提供大量营养活性成分,同时其药效成分又可被菌丝体产生的酶催化产生大量新的活性物质[14]。利用真空冷冻干燥技术将发酵液制备成冻干粉,通过降低水分含量以实现对发酵液营养物质的保存,从而适当延长存储时间,有利于运输。
本研究利用液体深层发酵技术对灵芝进行培养,通过添加玉竹、桦树茸、人参及三七药材粉末,制备灵芝以及灵芝与上述药材的发酵液冻干粉,采用显色法结合紫外分光光度法测定发酵液冻干粉总糖、总皂苷及总多肽的含量。为筛选出灵芝双向发酵液冻干粉抗氧化及抗炎效果最优的组合方式,测定各发酵液冻干粉对DPPH自由基、ABTS阳离子自由基清除能力及对环氧化酶-2(cyclooxygenase,COX-2)的抑制能力,COX-2是诱导型酶,具有环氧化酶和过氧化氢酶活性,是将花生四烯酸转化为前列腺素的关键酶。COX-2在正常组织表达量极低,在炎症、疼痛及肿瘤等刺激下可显著表达,因此可作为药物抗炎效果的指标[15]。通过以上实验,评价灵芝双向发酵体外抗氧化及抗炎活性,进而筛选出最优的抗氧化、抗炎发酵组合方式,为进一步研究发酵液各个成分含量与其活性的关系奠定基础,也为灵芝双向发酵工业化生产提供思路。
1 材料与方法
1.1 材料与试剂
灵芝[Ganodermalucidum(Leyss.ex Fr.)Kars]CICC 14024,中国工业微生物菌种保藏中心;玉竹[Polygonatumodoratum(Mill.)Druc],中国北京同仁堂有限责任公司;桦树茸(Inonotusobliquus)、人参(PanaxginsengC.A.Mey.)、三七[Panaxnotoginseng(Burk.)F.H.Chen],河北安国东方药城。
葡萄糖、CuSO4,佛山西陇化工有限公司;苯酚、HClO4、浓硫酸,国药集团化学试剂有限公司;人参皂苷Re、香兰素,上海源叶生物科技有限公司;NaOH,上海麦克林生化科技有限公司;牛血清白蛋白,上海阿拉丁生化科技股份有限公司;COX-2抑制剂筛选试剂盒,上海碧云天生物技术有限公司;冰乙酸、三氯乙酸、酒石酸钾钠、乙醇,天津福晨化学试剂有限公司;ABTS,Biotopped公司;DPPH,梯希爱化成工业;K2S2O8,西陇化工股份有限公司;抗坏血酸(99%),北京百灵威科技有限公司。
1.2 仪器与设备
SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;HWS-24电热恒温水浴锅,上海一恒科学仪器有限公司;KYC-100B摇床,上海福马实验设备有限公司;Epoch酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 发酵液冻干粉制备工艺
发酵基础培养基(g/L):葡萄糖35、蛋白胨5、酵母粉2.5、KH2PO41、MgSO4·7H2O 0.5、维生素B10.05。
在S1~S5发酵罐中加入发酵基础培养基,然后在S2、S3、S4、S5发酵罐中分别加入玉竹、桦树茸、人参及三七药材粉末10 g/L,121 ℃,灭菌20 min,按照10%(体积分数)的接种量接种,在28 ℃,150 r/min的摇床中发酵7 d后,超声波30 min后灭菌处理,4 ℃冰箱中静置1~2 d,抽滤,收集滤液,制备灵芝(S1)、灵芝-玉竹(S2)、灵芝-桦树茸(S3)、灵芝-人参(S4)以及灵芝-三七(S5)发酵液冻干粉。
1.3.2 总糖含量检测[16]
葡萄糖标准曲线的制作:准确称取标准葡萄糖50 mg,加蒸馏水定容至50 mL的容量瓶中,混匀,再从中吸取2.0 mL于8.0 mL蒸馏水中稀释,混合均匀后得到质量浓度为0.2 mg/mL的标准葡萄糖溶液。分别准确吸取标准葡萄糖溶液50、100、200、300、400、500 μL并补水至2.0 mL,然后加入1.0 mL 5%(体积分数,下同)苯酚,混匀,再加入5.0 mL浓硫酸混匀,放入沸水浴中反应30 min,反应结束后,放入冷水中冷却至室温,在490 nm处用酶标仪测量其吸光度值,以吸光度(Y)为纵坐标,葡萄糖浓度(X)为横坐标,建立回归方程。
样品总糖含量的测定:吸取样品S1~S5溶液(0.05 mg/mL)2.0 mL,然后加入1.0 mL 5%苯酚,混匀,再加入5.0 mL浓硫酸混匀,放入沸水浴中反应30 min,反应结束后,放入冷水中冷却至室温,在490 nm处用酶标仪测量其吸光度值,根据葡萄糖标准溶液曲线计算其总糖含量。
1.3.3 总皂苷含量检测[17]
人参皂苷Re标准曲线的制作:分别吸取人参皂苷Re标准溶液(2.0 mg/mL)25、50、100、150、200 μL,置于60 ℃水浴挥干。在已挥干的蒸发皿中准确加入0.2 mL 5%(体积分数,下同)香草醛冰乙酸溶液,使蒸发皿上的残渣全部溶解,再加入0.8 mL HClO4,混匀后加入到10 mL的离心管中,60 ℃水浴10 min,取出,用凉水冷却后,准确加入冰乙酸5.0 mL,于560 nm波长处用酶标仪进行测定,以吸光度(Y)为纵坐标,人参皂苷Re浓度(X)为横坐标,建立回归方程。
样品总皂苷的测定:准确吸取样品S1~S5溶液(10 mg/mL)各400 μL,置于60 ℃水浴挥干,在已挥干的蒸发皿中准确加入0.2 mL 5%香草醛冰乙酸溶液,使蒸发皿上的残渣全部溶解,再加入0.8 mL HClO4,混匀后加入到10 mL的离心管中,60 ℃水浴10 min,取出,用凉水冷却后,准确加入冰乙酸5.0 mL,于560 nm波长处用酶标仪进行测定。根据人参皂苷Re标准溶液曲线计算皂苷含量。
1.3.4 总多肽含量检测[18]
双缩脲试剂:试剂A:0.15 g CuSO4、0.60 g酒石酸钾钠、50 mL蒸馏水混合均匀;试剂B:30 mL 100 g/L NaOH溶液(使用时将A与B混匀)。
牛血清白蛋白标准曲线制作:配制适量10 mg/mL牛血清白蛋白溶液,分别取50、100、200、300、400、500 μL于离心管中,补水至1 mL,加入4 mL双缩脲试剂,室温反应30 min,540 nm处测其吸光度,制作标准曲线。
样品溶液的测定:取样品S1~S5溶液(10 mg/mL)1 mL于离心管中,加入1 mL 10%(体积分数)的三氯乙酸,离心,将蛋白沉淀下来,取1 mL上清液,加入4 mL双缩脲试剂,室温反应30 min,540 nm处测其吸光度,根据标准曲线计算样品多肽含量。
1.3.5 DPPH自由基清除率检测[19-20]
DPPH乙醇溶液的配制:称取20 mg DPPH,加入无水乙醇溶解并定容于250 mL容量瓶中,DPPH浓度为2×10-4mol/L;0~4 ℃下避光保存,现配现用,4 h内有效;阳性对照选用维生素C(0.5 mg/mL);阴性对照为蒸馏水。
样品待测液的配制:样品S1~S5分别配制成5个质量浓度:10、8、4、2、1 mg/mL
取1.0 mL的待测液与1.0 mL的2×10-4mol/L的DPPH乙醇溶液混匀(A管);取1.0 mL的无水乙醇与1.0 mL的2×10-4mol/L的DPPH乙醇溶液混匀(B管);取1.0 mL的无水乙醇与1.0 mL的待测液混匀(C管)。室温反应30 min后,在517 nm下测A、B、C管吸光度值。DPPH自由基清除率按照公式(1)计算。
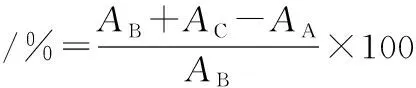
(1)
1.3.6 ABTS阳离子自由基清除率检测[19,21]
主要试剂配制:储备液1(7 mmol/L ABTS水溶液):精密称取0.038 41 g ABTS,溶解定容于10 mL水中;储备液2(2.45 mmol/L K2S2O8水溶液):精密称取0.066 2 g K2S2O8,加蒸馏水溶解定容于100 mL容量瓶中;ABTS阳离子自由基工作液:将储备液1和储备液2等体积混合,低温避光反应12~16 h,无水乙醇稀释至OD734=0.7±0.02;阳性对照选用维生素C(0.5 mg/mL)。
样品待测液的配制:样品S1~S5分别配制成5个质量浓度:10、8、4、2、1 mg/mL。
用移液枪分别准确吸取0.2 mL不同浓度的待测液和0.8 mL ABTS阳离子自由基工作液,充分混匀后,在室温条件下避光反应30 min,用酶标仪测定其在734 nm下的吸光值A;用0.2 mL蒸馏水代替待测溶液,其他条件不变,测定吸光值A0。ABTS阳离子自由基清除率按照公式(2)计算。

(2)
1.3.7 COX-2抑制率检测
根据COX-2抑制剂筛选试剂盒的操作说明书进行测定。
1.4 分析方法
总糖、总皂苷、总多肽、COX-2、DPPH自由基及ABTS阳离子自由基清除率检测实验均设置3组平行,检测结果采用Excel软件作图,SPSS 25软件分析,采用T-test统计分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 总糖含量检测结果
葡萄糖标准曲线回归方程为y=8.144 5x+0.087 2,R2=0.997 3,曲线拟合性较好,根据葡萄糖标准曲线计算得到样品S1~S5中总糖的含量(图1),结果显示,与S1相比,S2及S3的总糖含量极显著降低(P<0.01),S4总糖含量增加,S5总糖的含量极显著升高(P<0.01)。

图1 各组冻干粉总糖含量Fig.1 Total sugar content of lyophilized powder注:*表示与S1对比,P<0.05;**表示与S1对比,P<0.01(下同)
2.2 总皂苷含量检测结果
人参皂苷Re标准曲线回归方程为y=2.331 8x+0.025 2,R2=0.999 5,曲线拟合性较好,根据人参皂苷Re标准曲线计算得到样品S1~S5中总皂苷的含量(图2),结果表明,与S1相比,S5中总皂苷的含量极显著下降(P<0.01),S2、S3及S4的总皂苷含量极显著升高(P<0.01),其中,S2中总皂苷的含量最高,是S1总皂苷含量的1.26倍。
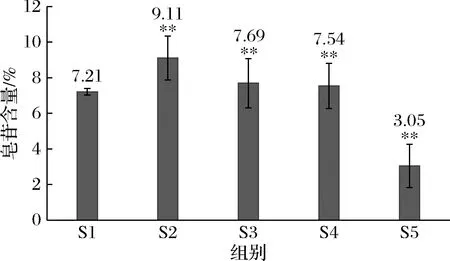
图2 各组冻干粉总皂苷含量Fig.2 Total saponin content of lyophilized powder
2.3 总多肽含量检测结果
牛血清白蛋白标准曲线回归方程为y=0.031 4x+0.117 5,R2=0.999 3,曲线拟合性较好,根据牛血清白蛋白标准曲线计算得到样品S1~S5中多肽的含量(图3)。与S1相比,S5中总多肽含量降低,S4中总多肽含量极显著降低(P<0.01),S2及S3中总多肽含量升高,其中S2中总多肽含量显著升高(P<0.05),是S1总多肽含量的1.27倍。

图3 各组冻干粉总多肽含量Fig.3 Total polypeptide content of lyophilized powder
2.4 DPPH自由基清除率检测结果
阳性对照维生素C(0.5 mg/mL)的DPPH自由基清除率为95.01%,阴性对照蒸馏水的DPPH自由基清除率为1.48%,说明实验结果具有一定的可信度及参考价值。
如图4所示,随着样品S1~S5浓度的降低,其DPPH自由基清除能力也逐渐降低,其中S2降低的幅度最小,且S2在其相应浓度的DPPH自由基清除能力都强于其他样品,因此相比于S1及其他样品,S2清除DPPH自由基的能力最强。

图4 各组冻干粉DPPH自由基清除率Fig.4 DPPH free radical scavenging rate trend of lyophilized powder
2.5 ABTS阳离子自由基清除率检测结果
阳性对照维生素C(0.5 mg/mL)的ABTS阳离子自由基清除率为92.28%,阴性对照蒸馏水的ABTS阳离子自由基清除率为-4.53%,说明实验结果具有一定的可信度及参考价值。
如图5所示,除S2外,样品S1、S3、S4及S5 ABTS阳离子自由基清除能力都有随着浓度的降低而降低的趋势,相比于S1,S2在各个浓度都有着稳定且较强的ABTS阳离子自由基清除能力,因此,综合来说S2 对ABTS阳离子自由基的清除效果最好。
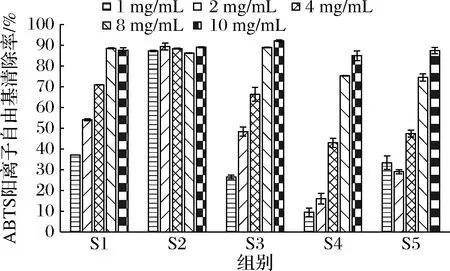
图5 各组冻干粉ABTS阳离子自由基清除率Fig.5 ABTS cation free radical scavenging rate trend of lyophilized powder
2.6 COX-2抑制率检测结果
阳性对照Celecoxib溶液(1 μmol/L)的COX-2抑制率为63.92%,说明实验结果具有一定的参考价值。如图6所示,与S1及其他样品相比,S2在其相应浓度的COX-2抑制能力都强于其他样品,且随着浓度的降低,S2的COX-2抑制能力降低幅度较小,有着稳定且较强的COX-2抑制能力。因此,相比于S1来说,S2的COX-2抑制能力最强。
图6 各组冻干粉COX-2抑制率Fig.6 COX-2 inhibition rate trend of lyophilized powder
3 讨论与展望
研究结果发现,相比于灵芝发酵液冻干粉,灵芝-玉竹发酵液冻干粉中总皂苷及总多肽的含量显著升高(P<0.05),其总皂苷及总多肽的含量分别为灵芝发酵液冻干粉的1.26、1.27倍。并且灵芝-玉竹发酵液冻干粉抗氧化及抑制COX-2的活性最强,其可能与总皂苷以及总多肽的含量的提高有关,灵芝-玉竹发酵液冻干粉较强的COX-2抑制能力说明其可能存在较好的抗炎效果。因此添加了玉竹的灵芝发酵组合是符合预期的最优发酵组合方式,这为后续进一步研究灵芝-玉竹发酵液中各个成分含量与其活性的关系奠定了基础,为研究开发抗氧化及抗炎的灵芝双向发酵原料提供了新的思路,为灵芝双向发酵的工业化生产提供了前提和基础。
同时,本研究也存在一定的局限性,药材-灵芝的双向液体深层发酵与直接提取是不同的,药材粉末主要作为培养基被灵芝真菌吸收和代谢,分泌到胞外的是经过灵芝真菌代谢后的成分。由于是胞外成分,所以灵芝中的主要三萜类成分并没有被检测到,因此本研究目前只能以总成分变化为主。

