不同表面修饰纳米硒在模拟胃肠消化中稳定性及抗氧化活性变化
王亚彬,黎志伟,李长江,戴雅琪,何芬芳,郑国栋*,杨丽聪
1(江西农业大学 食品科学与工程学院,天然产物结构与分离重点实验室,江西 南昌,330045)2(福州大学 生物科学与工程学院,福建 福州,350108)
多酚类物质是植物的次级代谢产物,包括黄酮、花色苷等,广泛存在于水果、谷物和蔬菜中,具有多种生物活性。绿原酸和没食子酸是常见的多酚化合物,具有抗氧化、抗菌、抗肿瘤、抗炎、保护神经和保护肝脏等生物活性[1-3]。维生素C是一种水溶性维生素,广泛存在于水果和蔬菜中,具有抗氧化,抗衰老,清除有害自由基等生物活性[4]。食品中的多酚化合物及维生素类物质必需经过胃肠消化才能被人体吸收,参与到新陈代谢,才能发挥它们抗氧化作用,并促进人体健康[5-6]。但是多酚化合物水溶性低,导致其在生物体内的有效性较低,只有5%~10%的多酚可被小肠吸收。另一方面多酚及维生素C分子有多个羟基基团,容易被氧化。因此,增加这些活性物质的稳定性及促进其在生物体内利用十分必要。
纳米硒(selenium nanparticles,SeNPs)是近年来备受人们关注的纳米材料之一。纳米硒作为药物用于肿瘤治疗已经得到越来越多的研究,其功能化和靶向修饰可增强抗肿瘤效果[7]。与无机硒相比,纳米硒毒性更低,生物活性更高,更容易被机体吸收消化[8]。本课题组前期研究表明,利用纳米硒负载绿原酸、没食子酸[9]或维生素C[10],可有效提高其体外生物活性。人体的消化环境和过程比较复杂,极易对不同表面修饰纳米硒稳定性产生影响,不同表面修饰纳米硒在生物体内的稳定性仍是未知的,因此研究不同表面修饰纳米硒在胃肠液中的稳定性对于其在生物体内的应用十分必要。
本研究通过测定体外胃肠液消化前后不同表面修饰纳米硒的粒径、表面修饰剂的残留量以及DPPH和ABTS阳离子自由基的清除能力,比较绿原酸纳米硒(CGA@SeNPs)、没食子酸纳米硒(GA@SeNPs)和维生素C纳米硒(VC@SeNPs)的稳定性和抗氧化活性。本研究可为纳米硒在生物体内的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
绿原酸,毕得医药;硼氢化钠,上海阿拉丁生化科技股份有限公司;没食子酸、维生素C,天津永大化学试剂厂;亚硒酸钠,郑州红祥化工有限公司;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)、DPPH、NaHCO3、ABTS阳离子自由基,北京索莱宝科技有限公司;胃蛋白酶、胰蛋白酶,大连美仑生物技术有限公司;盐酸,南昌鑫光精细化工厂;NaOH,上海国药集团;KH2PO4、无水乙醇,西陇科学股份有限公司。
1.2 仪器与设备
Moecular devices多功能酶标仪、UV-5200型UV-可见分光光度计、恒温水浴锅,上海元析仪器有限公司;AUY120型电子天平,岛津公司;CL-3型磁力搅拌器,巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 纳米材料的制备
参考文献[11]制备CGA@SeNPs。调节亚硒酸钠溶液pH值至5~6。先将100 μL 0.1 mmol/L的亚硒酸钠溶液与1.6 mL 50 mmol/L绿原酸溶液混合均匀,滴加200 μL 0.1 mmol/L硼氢化钠溶液,400 r/min搅拌30 min,直到溶液颜色变为砖红色,离心,即获得CGA@SeNPs。
参照文献[9]改进GA@SeNPs的合成方法,将2 mL 0.1 mmol/L亚硒酸钠溶液与2 mL 0.6 mmol/L没食子酸溶液等体积混合后,用稀盐酸将pH值调至3.0,加热挥干后得橙红色固相样品,将此样品加超纯水溶解,定容至10 mL得GA@SeNPs。
依据软模板法[12-13]制备VC@SeNPs并适当调整。以PVP为模板剂,维生素C为还原剂。将2 mL 0.2 mol/L维生素C溶液加入小烧杯中,并用磁力搅拌器以300 r/min的转速轻轻搅拌,然后将1 mL 0.1 mol/L亚硒酸钠溶液和3 mL 5.0 g/L PVP溶液滴入维生素C溶液中,搅拌至颜色由无色变至砖红色,将所得溶液取400 μL定容至10 mL得VC@SeNPs。
1.3.2 不同表面修饰纳米硒在不同pH中的稳定性
取pH值为2、4、6、8、10 PBS缓冲液1 mL和0.5 mL 250 μg不同表面修饰剂纳米硒混合,摇匀,置于37 ℃恒温培养箱中保温2 h,观察有无聚集或沉降。各取100 μL加入酶标板,各梯度设置3组平行测定吸光度,读出410和490 nm处的吸光度数值,A410/A490比值的变化用于表征粒径变化[14]。
1.3.3 体外模拟胃肠道消化
1.3.3.1 体外模拟胃消化
消化过程中,药物在胃中的停留时间与药物种类有关,一般在胃部的停留时间为1~3 h,最多不超过4 h[15]。根据邹青飞等[16]的研究方法,取100 μL CGA@SeNPs、GA@SeNPs和VC@SeNPs溶液置于50 mL的离心管中,加入25 mL人工胃液,水浴4 h。分别取2 mL消化1、2、3、4 h的样品溶液。测定纳米粒子的粒径,抗氧化能力及表面修饰剂CGA、GA和维生素C含量变化。
1.3.3.2 体外模拟肠消化
基于模拟胃消化的实验结果,在消化2 h后,不同表面修饰纳米硒的粒径基本保持不变,因此在胃消化2 h后,进入模拟肠消化阶段。根据邹青飞等[16]的研究方法,取10 mL经胃消化2 h后的样品溶液于50 mL离心管中,再加入5 mL人工肠液,调pH值至7.0左右,水浴消化4 h。取2 mL消化1、2、3、4 h的样品溶液,测抗氧化能力及表面修饰剂CGA、GA和维生素C含量变化。
1.3.4 体外模拟胃肠道消化时不同表面修饰纳米硒粒径的测量
分别在胃、肠消化 1、2、3、4 h,取200 μL胃液或胃肠液于96孔酶标板中,每个时间段取3个孔作为平行样。根据双波长法,A410/A490作为纳米粒径的衡量标准[17]。
1.3.5 体外抗氧化活性的测定
1.3.5.1 DPPH自由基清除能力的测定
DPPH清除率的测定[18],分别取1、2、3和4 h的胃液和肠液消化样品,实验分组如下:空白组,每孔加入 180 μL DPPH工作液和 20 μL无水乙醇;对照组,每孔加入 180 μL无水乙醇和 20 μL含纳米粒子的胃液(胃肠液)消化液;实验组,每孔加入 180 μL DPPH工作液和 20 μL含纳米粒子的胃液(胃肠液)消化液。室温避光孵育20 min,测定其吸光度值,试验平行测定3次。按公式(1)计算清除率:
(1)
式中:E,清除率,%;AX,样品吸光值;A1,对照组吸光值;A0,空白组吸光值。
1.3.5.2 ABTS阳离子自由基清除能力测定
ABTS阳离子自由基清除率的测定[18],分别取1、2、3和4 h的胃液和肠液消化样品,实验分组如下:空白组,每孔加入180 μL ABTS阳离子自由基工作液和 20 μL无水乙醇;对照组,每孔加入180 μL无水乙醇和 20 μL含纳米粒子的胃液(胃肠液)消化液;实验组,每孔加入 180 μL ABTS阳离子自由基工作液和20 μL含纳米粒子的胃液(胃肠液)消化液。室温避光孵育20 min,测定其吸光度值,试验平行测定3次。根据1.3.5.1中公式(1)计算清除率。
1.3.6 表面修饰剂含量的测定
绿原酸,维生素C和没食子酸以二倍法稀释成不同的浓度,用紫外分光光度计测其吸光度,作标准曲线[19]。在胃肠消化的1、2、3和4 h取样,测其吸光度,修饰物的含量用标准曲线计算。
1.3.7 数据处理与分析
采用SPSS 18.0软件分析实验数据,结果用平均值±标准差表示,通过单因素方差分析和多重比较方法对数据进行显著性差异分析,P<0.05表示差异具有显著性。
2 结果与分析
2.1 不同表面修饰纳米硒在不同pH中粒径的变化
根据双波长法[19],当吸光度比值A410/A490不变时纳米粒子粒径不变,处于稳定状态,且比值越大,纳米硒的粒径越小,形貌越稳定。由图1可以看出pH值为2~6时,A410/A490的比值没有显著性变化,说明3种不同表面修饰纳米硒颗粒结构稳定。然而在pH值为8~10时,CGA@SeNPs的A410/A490的比值变为7.5,说明CGA@SeNPs纳米粒子不稳定。CGA在pH值为8~10时会发生降解[20],因此,CGA@SeNPs与CGA性质一致,碱性条件下会发生降解。同理在pH值为8~10时,GA@SeNPs的A410/A490的比值变化了1.0,这与吴雪钗等[21]的研究结果一致,GA在pH值为2~6时稳定,pH值为8~10时不稳定,碱性条件下会发生降解,所以GA@SeNPs与GA的性质一样。VC@SeNPs的A410/A490的比值变化了0.8,纳米颗粒发生了降解,这与王乐等[22]的研究结果一致,维生素C是一种强酸性物质,在pH值为2~6时稳定,在pH值为8~10时不稳定,VC@SeNPs与维生素C的性质一样。因此3种不同表面修饰纳米硒在酸性条件下稳定,碱性条件下不稳定。

图1 不同表面修饰纳米硒在不同pH中粒径变化Fig.1 Particle size changes of different surface modified nano selenium at different pH
2.2 不同表面修饰纳米硒在模拟胃消化中粒径的变化
3种不同表面修饰纳米硒经胃消化后不同时间段粒径的变化如图2所示,A410/A490的比值有所波动,但变化不显著,说明3种不同修饰纳米硒经胃消化后粒径基本维持稳定,结构未受到破坏,这与王乐等[22]的研究结果相一致。但1~2 h时,GA@SeNPs的A410/A490的比值波动较大,相比之下,CGA@SeNPs的结构更稳定。

图2 不同表面修饰纳米硒在模拟胃消化中粒径变化Fig.2 Particle size changes of different surface modified nano selenium in simulated gastric digestion
2.3 不同表面修饰纳米硒在模拟肠消化中粒径的变化
3种不同表面修饰纳米硒在模拟肠消化的不同时间段的粒径变化如图3所示,CGA@SeNPs的A410/A490的比值在4 h内几乎没有变化,说明纳米粒子在肠液中结构稳定。GA@SeNPs和VC@SeNPs在3 h内粒径基本没有变化,4 h时A410/A490的比值有所波动,但变化不显著,说明3种不同修饰纳米硒经肠消化后粒径基本维持稳定,结构未受到破坏,这与王乐等[22]的研究结果相一致。在3~4 h时VC@SeNPs的A410/A490比值波动较大,其次是GA@SeNPs,CGA@SeNPs的稳定性最好。

图3 不同表面修饰纳米硒在模拟肠消化中粒径变化Fig.3 Particle size changes of different surface modified nano selenium in simulated intestinal digestion
2.4 不同表面修饰纳米硒在模拟胃肠消化后抗氧化能力的测定
2.4.1 不同表面修饰剂纳米硒未消化前对DPPH的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在未消化前不同时间段对DPPH的清除率如图4所示,在2 h时,3种不同修饰纳米硒的抗氧化能力具有显著性差异(P<0.05),可看出清除率最高的是GA@SeNPs,其次是VC@SeNPs,CGA@SeNPs最低。随着消化时间的延长,GA@SeNPs和VC@SeNPs的清除率有所提高,3 h达到最高值,CGA@SeNPs基本保持不变。
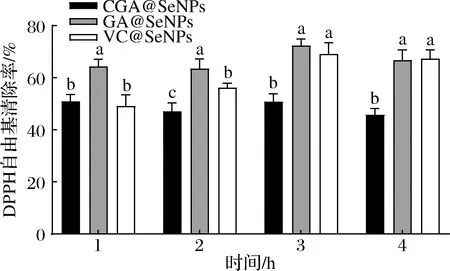
图4 未消化前不同表面修饰纳米硒的不同时间段对DPPH的清除率Fig.4 Clearance of DPPH by different surface modified nano selenium in different periods before digestion
2.4.2 不同表面修饰纳米硒模拟胃消化后对DPPH自由基的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在模拟胃消化不同时间段对DPPH清除率的影响如图5所示。

图5 不同表面修饰纳米硒在胃消化的不同时间段对DPPH的清除率Fig.5 Clearance of DPPH by different surface modified nano selenium in different periods of gastric digestion
3种不同表面修饰纳米硒对DPPH自由基清除率具有显著性差异(P<0.05),可看出清除率最高的是GA@SeNPs,其次是CGA@SeNPs,VC@SeNPs最低,但相较于未消化前3种不同表面修饰纳米硒的清除率有所降低,这进一步证实在模拟胃消化过程中CGA、GA和维生素C都略有降解,这与李贻等[23]的研究结果相一致。与未消化样品相比,VC@SeNPs对DPPH自由基清除率的下降幅度最大,在3 h时下降了36.06%,其次是GA@SeNPs,下降了11.08%,CGA@SeNPs下降了1.69%,因此CGA@SeNPs经胃消化后具有较强的抗氧化活性。
2.4.3 不同表面修饰纳米硒模拟肠消化后对DPPH自由基的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在模拟肠消化时对DPPH的清除率如图6所示,3种不同表面修饰纳米硒对DPPH清除率具有显著性差异(P<0.05),1和3 h时清除率最高的是VC@SeNPs,其次是CGA@SeNPs,GA@SeNPs最低,4 h时GA@SeNPs的清除率比CGA@SeNPs高,与模拟胃消化不同,GA@SeNPs在模拟肠消化的1和3 h时清除率最低,说明GA@SeNPs的结构较胃消化过程的稳定性差。然而VC@SeNPs的清除率最高,说明相对于GA@SeNPs和CGA@SeNPs,VC@SeNPs在模拟肠消化中结构更稳定。与未消化的样品相比,清除率下降幅度最大的是GA@SeNPs,在肠消化1 h时,下降了30.71%,其次是CGA@SeNPs,下降了2%,然而VC@SeNPs升高了8.57%,因此VC@SeNPs在肠消化后具有较强的抗氧活性。
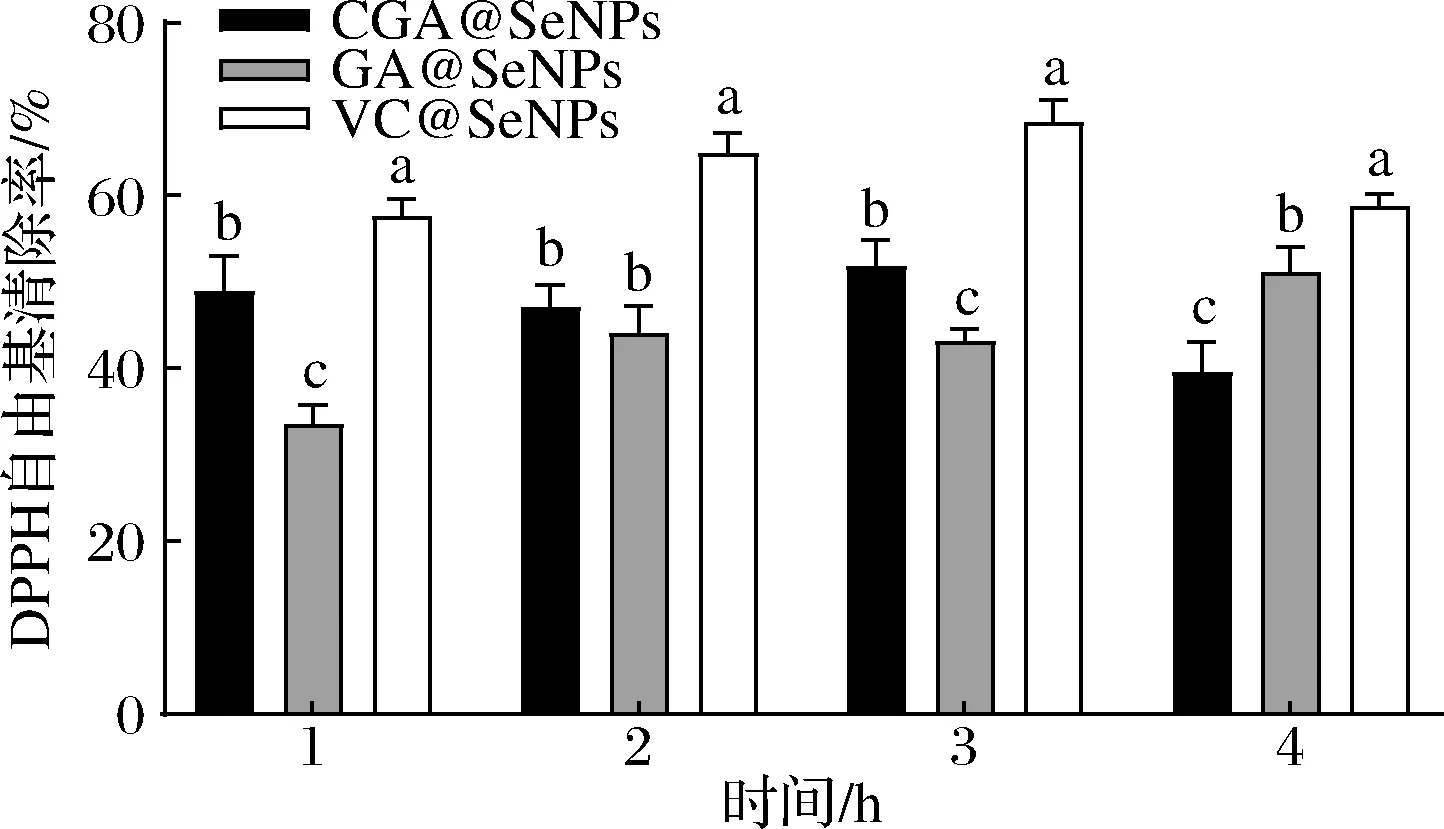
图6 不同表面修饰纳米硒在肠消化的不同时间段对DPPH的清除率Fig.6 Clearance of DPPH by different surface modified nano selenium in different periods of intestinal digestion
2.4.4 不同表面修饰纳米硒未消化前对ABTS阳离子自由基的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在未消化时对ABTS阳离子自由基的清除率如图7所示。1和3 h时,不同表面修饰纳米硒对ABTS阳离子自由基的清除率具有显著性差异(P<0.05),清除率最高的是GA@SeNPs,其次是CGA@SeNPs,VC@SeNPs最低。2和4 h时,GA@SeNPs清除率最高,CGA@SeNPs和VC@SeNPs的清除率接近。

图7 未消化前不同表面修饰纳米硒的不同时间段对ABTS阳离子自由基的清除率Fig.7 Clearance of ABTS cationic radical by different surface modified nano selenium in different time periods before digestion
2.4.5 不同表面修饰纳米硒模拟胃消化后对ABTS阳离子自由基的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在模拟胃消化时对ABTS阳离子自由基的清除率如图8所示,相对于DPPH自由基,这3种不同表面修饰纳米硒对ABTS阳离子自由基的清除率力较高。1~3 h内CGA@SeNPs、GA@SeNPs和VC@SeNPs对ABTS阳离子自由基的清除率具有显著性差异(P<0.05),清除率最高的是GA@SeNPs,其次是CGA@SeNPs,VC@SeNPs最低。CGA@SeNPs和GA@SeNPs在胃消化过程中对自由基的清除力基本保持不变,无显著性变化,说明在胃消化过程中纳米粒子的结构保持稳定,但VC@SeNPs对ABTS阳离子自由基清除率在3和4 h显著上升,可能是实验误差造成的。相较于未消化的样品,CGA@SeNPs和GA@SeNPs都有所提高,GA@SeNPs在1 h时提高了23.55%,CGA@SeNPs提高了9.15%,但VC@SeNPs降低了11.84%。综上所述,GA@SeNPs在模拟胃消化中对ABTS阳离子自由基抗氧化活性最高,其次是CGA@SeNPs。

图8 不同表面修饰纳米硒在胃消化的不同时间段对ABTS阳离子自由基的清除率Fig.8 Clearance of ABTS cationic radical by different surface modified nano selenium in different periods of gastric digestion
2.4.6 不同表面修饰纳米硒模拟肠消化后对ABTS阳离子自由基的清除力
CGA@SeNPs、GA@SeNPs和VC@SeNPs在模拟肠消化时对ABTS阳离子自由基的清除率如图9所示,3 h时CGA@SeNPs、GA@SeNPs和VC@SeNPs对ABTS+清除率具有显著性差异(P<0.05),清除率最高的是GA@SeNPs,其次是VC@SeNPs,CGA@SeNPs最低。3种不同表面修饰纳米硒在模拟肠消化过程对ABTS阳离子自由基的清除率比模拟胃消化过程要高,这与孟天梦等[24]的研究结果相一致,这是由于肠消化后负载在CGA@SeNPs、GA@SeNPs和VC@SeNPs上CGA、GA和维生素C发生了轻微的解离使得肠液中修饰剂含量增多,从而清除率上升。与未消化的样品相比,GA@SeNPs的清除率在1 h时提高了29.48%,其次是CGA@SeNPs在2 h时提高了32%,与GA@SeNPs相近,但VC@SeNPs在4 h时则降低了30.50%。因此,CGA@SeNPs经肠消化后抗氧化活性较好。

图9 不同表面修饰纳米硒在肠消化的不同时间段对ABTS阳离子自由基的清除率Fig.9 Clearance of ABTS cationic radical by different surface modified nano selenium in different periods of intestinal digestion
2.5 不同表面修饰纳米硒在模拟胃肠消化后含量的变化
2.5.1 不同表面修饰纳米硒经胃消化后含量的变化
CGA@SeNPs、GA@SeNPs和VC@SeNPs经胃消化后CGA、GA和维生素C含量的变化如图10所示。CGA@SeNPs和VC@SeNPs经胃消化后CGA和维生素C含量无明显变化,表明CGA和维生素C在胃液中稳定存在。然而GA@SeNPs中GA的含量有所降低,表明随着胃消化时间的延长GA发生了一定程度的降解。其中CGA@SeNPs在1~4 h时几乎无变化,因此,CGA@SeNPs经胃消化后可稳定存在。

图10 模拟胃消化过程不同时间段表面修饰剂的浓度Fig.10 Concentration of surface modifier in different periods during simulated gastric digestion
2.5.2 不同表面修饰纳米硒在肠消化后含量的变化
CGA@SeNPs、GA@SeNPs和VC@SeNPs经肠消化后CGA、GA和维生素C含量变化如图11所示。由图可知在模拟肠消化的1~4 h内3种表面修饰纳米硒中CGA、GA和维生素C含量无显著性变化,但在3~4 h时GA@SeNPs和VC@SeNPs都有所下降,VC@SeNPs下降最明显,因此,CGA@SeNPs经肠消化后可稳定存在。
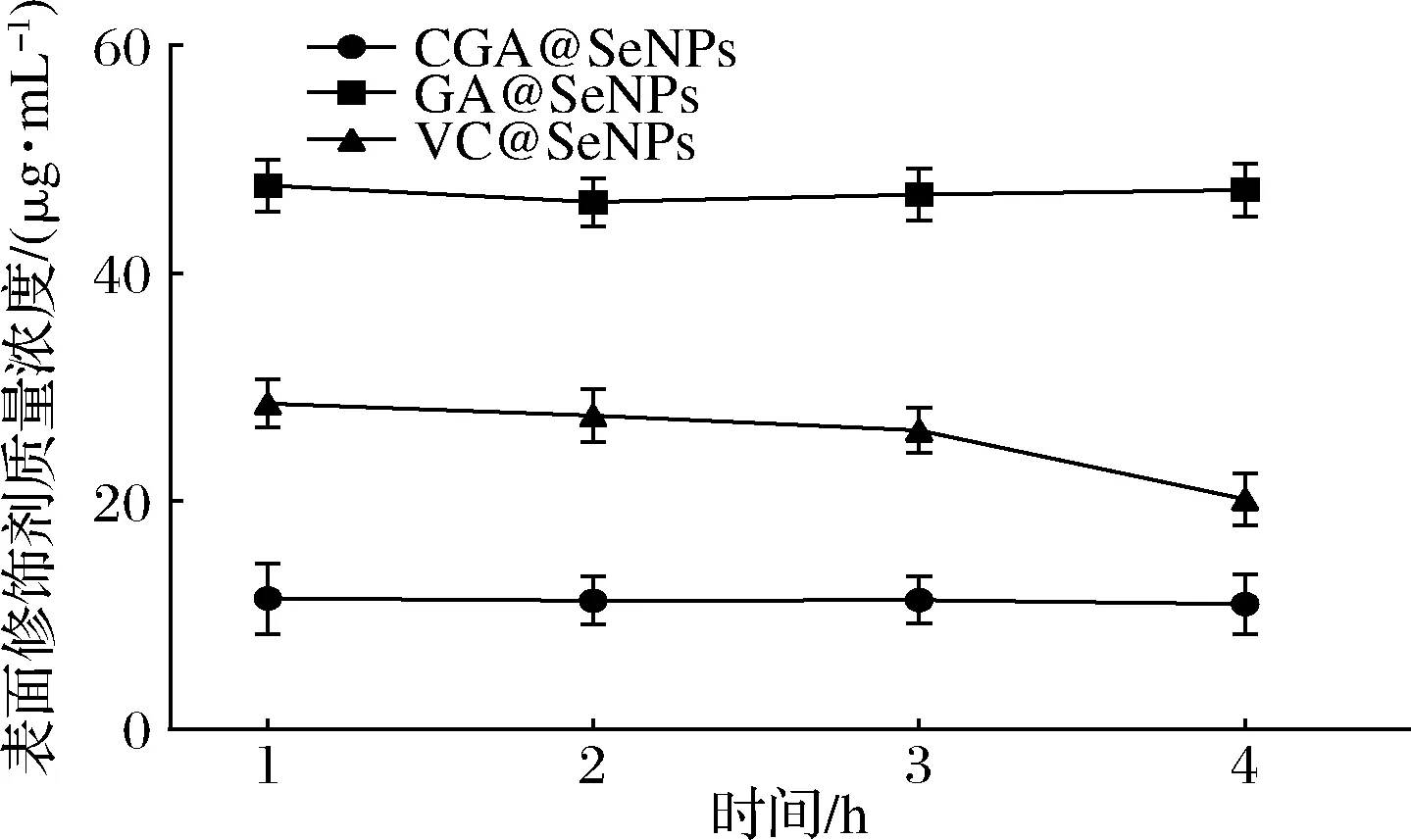
图11 模拟肠消化过程不同时间段表面修饰剂的浓度Fig.11 Concentration of surface modifier in different periods of simulated intestinal digestion process
3 结论
本文利用体外胃肠道消化模型,比较3种不同表面修饰纳米硒的稳定性和抗氧化活性变化,得出CGA@SeNPs经胃肠消化后,CGA@SeNPs结构和含量最稳定,与未消化的样品相比,CGA@SeNPs在胃肠消化中抗氧化活性最好。本研究可进一步为纳米硒在生物体内的研究提供理论依据。

