lncRNA XIST通过NF-κB/NLRP3炎性体通路影响急性肺损伤大鼠炎症反应和细胞凋亡
汤建华 刘克勤 姜爱雯 冯平 张志华
(河北北方学院附属第一医院 1药学部,河北 张家口 075000;2呼吸内科)
急性肺损伤(ALI)是一种常见的比较严重的临床并发症,由肺炎、尿毒症、外伤等因素引起的,主要表现为呼吸困难、咯血、肺水肿等,严重时可诱发急性呼吸窘迫综合征,其病死率为40%左右〔1〕。相关文献〔2〕表明,炎症反应的失控和炎症因子的异常表达是ALI发病的主要机制。不具备蛋白编码能力的长链非编码RNA(lncRNA)可参与调控疾病的生理过程。长链非编码RNA-X染色体失活特异转录物(lncRNA XIST)作为lncRNA的一员,在肿瘤细胞中研究较多,在胃癌〔3〕、乳腺癌〔4〕、卵巢癌〔5〕中均呈现高表达,然而其在ALI方面的研究较少。目前已证实lncRNA XIST在ALI模型中显著上调表达〔6〕,但是其具体的作用机制尚不完全清楚。因此,本研究将通过构建ALI模型大鼠,并沉默lncRNA XIST表达,进而探讨lncRNA XIST对ALI大鼠炎症反应和细胞凋亡的影响及其可能的分子机制,为治疗ALI提供新的依据。
1 材料与方法
1.1试剂与仪器 脂多糖(LPS)购自上海新睿生物科技有限公司;含有lncRNA XIST-NC和lncRNA XIST-shRNA的psiCHECK2重组载体质粒购自上海吉玛生物公司;核转录因子(NF)-κB/核苷酸结合寡聚化结构域样受体蛋白(NLRP)3炎性体通路激活剂CHPG购自MedChemExpress公司;Opti-MEM培养基和Lipofectamine 2000转染试剂购自赛默飞世尔科技(中国)有限公司;苏木素-伊红(HE)染色试剂盒,髓过氧化物酶(MPO)、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6和IL-1β试剂盒均购自上海晶抗生物工程有限公司;末端脱氧核苷酸转移酶介导的dUTP缺口标记技术(TUNEL)试剂盒和电化学发光(ECL)试剂购自上海翌圣生物科技有限公司;活化的半胱氨酸天冬氨酸蛋白水解酶(Cleaved caspase)-3、半胱氨酸天冬氨酸蛋白酶(Caspase)-3、NF-κB p65、p-NF-κB p65、凋亡相关斑点样蛋白(ASC)、NLRP3、Cleaved caspase-1、Caspase-1抗体购自美国Abcam公司。酶标仪购自上海美谷分子仪器有限公司;电子天平购自上海精密仪器仪表有限公司;光学显微镜和荧光显微镜购自上海豫光仪器有限公司;组织石蜡包埋机和切片机购自孝感康瑞德电子科技有限公司。
1.2实验动物 健康SD大鼠,雄性,SPF级,共60只,体重160~180 g,均购自北京迈德康纳生物技术有限公司,实验动物许可证号为SYXK(京)2020-0050。所有大鼠在湿度为(55±5)%、温度为21~25℃的条件下饲养。
1.3动物分组、造模及lncRNA干预 将60只SD大鼠随机分组为Control组、ALI组、lncRNA XIST-NC组、lncRNA XIST-shRNA组和lncRNA XIST-shRNA+CHPG组,每组12只。除了Control组之外,其余各组大鼠均采用腹腔注射5 mg/kg LPS〔7〕进行ALI造模。利用Opti-MEM培养基将10 μl的Lipofectamine 2000转染试剂、5 μg的lncRNA XIST-NC或lncRNA XIST-shRNA的重组载体质粒各稀释至30 μl,静置后将二者混匀得到质粒脂质体复合物。lncRNA XIST-NC组和lncRNA XIST-shRNA组大鼠分别于造模后从尾静脉注射lncRNA XIST-NC和lncRNA XIST-shRNA质粒脂质体复合物,lncRNA XIST-shRNA+CHPG组大鼠在lncRNA XIST-shRNA组大鼠的基础上再注射0.5 mg/kg NF-κB/NLRP3炎性体通路激活剂CHPG〔8〕,而Control组和ALI组大鼠则注射等量的Opti-MEM培养基。
1.4肺组织lncRNA XIST水平的检测 各组大鼠按照1.3的方法进行处理,7 d后将其处死并取出左上肺组织,采用TRIzol试剂提取肺组织总RNA,然后将其逆转录成cDNA,并以此为模板,按照qRT-PCR试剂盒和仪器的使用说明进行PCR。所得数据使用GAPDH作为内参进行归一化,并采用2-ΔΔCt法计算lncRNA XIST相对表达量。lncRNA XIST引物序列为:正向5′-AGGGTGTGTGTGCATATGGA-3′,反向5′-CCGCCATCTTTTCCTGTACG-3′。
1.5肺病理变化的观察 取各组大鼠右上肺组织,用4%甲醛固定48 h,用乙醇脱水,然后将其进行石蜡包埋和切片。完成后采用HE法对切片进行染色,中性胶密封。最后使用光学显微镜评估肺组织病理变化。
1.6肺湿/干比的测定 各组大鼠处死后,切除右肺中叶,使用吸水纸吸去表面水分,用电子天平进行称重并记录湿重(W)。然后将其置于60℃干燥箱中,重量不再变化时停止烘干,再次进行称重并记录为干重(D)。W/D值即可评价肺水肿。
1.7MPO活力的测定 将各组大鼠左肺中叶制备成组织匀浆,并按照1∶19的质量体积比加入MPO试剂,然后放置于96孔板上,在60℃下水浴15 min,最后使用酶标仪在460 nm处测定吸光度值,并计算其活力值。MPO活力值(U/g)=(A实验-A对照)/11.3×肺组织质量(g)。
1.8炎症因子水平的测定 各组大鼠颈主动脉取血,通过离心获得其上清液,参照酶联免疫吸附试验(ELISA)试剂盒说明书的方法检测血清中炎症因子TNF-α、IL-6和IL-1β水平。
1.9大鼠肺组织细胞凋亡的检测 按照TUNEL试剂盒的说明对各组肺组织切片进行处理,然后加入50 μl TUNEL溶液,37℃孵育5 min,在荧光显微镜下观察各组大鼠肺组织细胞凋亡情况。
1.10凋亡相关蛋白及NF-κB/NLRP3炎性体通路相关蛋白表达水平的检测 将从各组大鼠右下肺叶中提取的总蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并转至聚偏氟乙烯(PVDF)膜,脱脂牛奶封闭后,加入Cleaved caspase-3、Caspase-3、NF-κB p65、p-NF-κB p65、ASC、NLRP3、Cleaved caspase-1、Caspase-1一抗过夜孵育,然后用对应二抗继续孵育2 h,添加ECL试剂进行显色,并使用Image J软件对上述蛋白水平进行分析。
1.11统计学处理 采用SPSS22.0软件单因素方差分析。
2 结 果
2.1lncRNA XIST在各组肺组织中表达水平 ALI组肺组织中lncRNA XIST水平显著高于Control组(P<0.05);lncRNA XIST-shRNA组肺组织中lncRNA XIST水平显著低于ALI组和lncRNA XIST-NC组(P<0.05);lncRNA XIST-shRNA+CHPG组肺组织中lncRNA XIST水平显著明显高于lncRNA XIST-shRNA组(P<0.05),见表1。
2.2lncRNA XIST-shRNA对各组损伤的影响 Control组肺部没有病变迹象;ALI组肺部病变严重,出现大量炎性细胞,肺泡壁加厚且肺泡血管阻塞;与ALI组比较,lncRNA XIST-shRNA组肺部病灶明显减少,炎性细胞数量也减少;而lncRNA XIST-shRNA+CHPG组肺部病灶比lncRNA XIST-shRNA组明显变多。见图1。与Control组相比,ALI组W/D值和MPO活力值明显升高(P<0.05);与ALI组和lncRNA XIST-NC组相比,lncRNA XIST-shRNA组W/D值和MPO活力值明显下降(P<0.05);而lncRNA XIST-shRNA+CHPG组W/D值和MPO活力值明显高于lncRNA XIST-shRNA组(P<0.05),见表1。
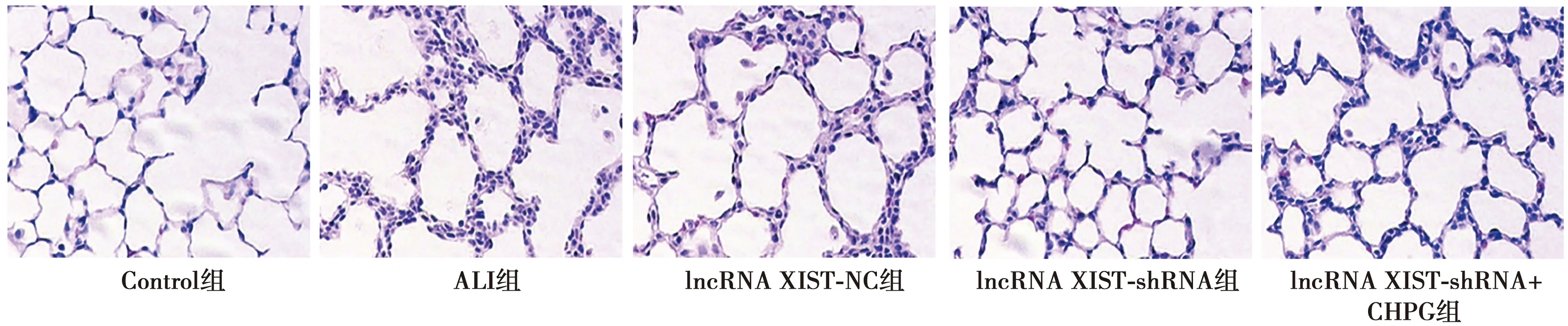
图1 各组肺病理变化(HE染色,×200)
2.3lncRNA XIST-shRNA对ALI大鼠血清炎症因子的影响 与Control组相比,ALI组TNF-α、IL-6和IL-1β水平显著升高(P<0.05);与ALI组和lncRNA XIST-NC组相比,lncRNA XIST-shRNA组TNF-α、IL-6和IL-1β水平明显降低(P<0.05);与lncRNA XIST-shRNA组相比,lncRNA XIST-shRNA+CHPG组TNF-α、IL-6和IL-1β水平明显升高(P<0.05),见表1。

表1 lncRNA XIST-shRNA对ALI大鼠肺组织损伤、lncRNA XIST表达及血清炎症因子的影响
2.4lncRNA XIST-shRNA对ALI大鼠肺组织细胞凋亡的影响 ALI组肺组织细胞凋亡率和Cleaved caspase-3表达明显高于Control组(P<0.05);与ALI组和lncRNA XIST-NC组相比,lncRNA XIST-shRNA组肺组织细胞凋亡率和Cleaved caspase-3表达明显减少(P<0.05),而lncRNA XIST-NC组和ALI组肺组织细胞凋亡率和Cleaved caspase-3表达没有显著差异;与lncRNA XIST-shRNA组相比,lncRNA XIST-shRNA+CHPG组肺组织细胞凋亡率和Cleaved caspase-3表达显著增加(P<0.05),见图2、表2、图3。
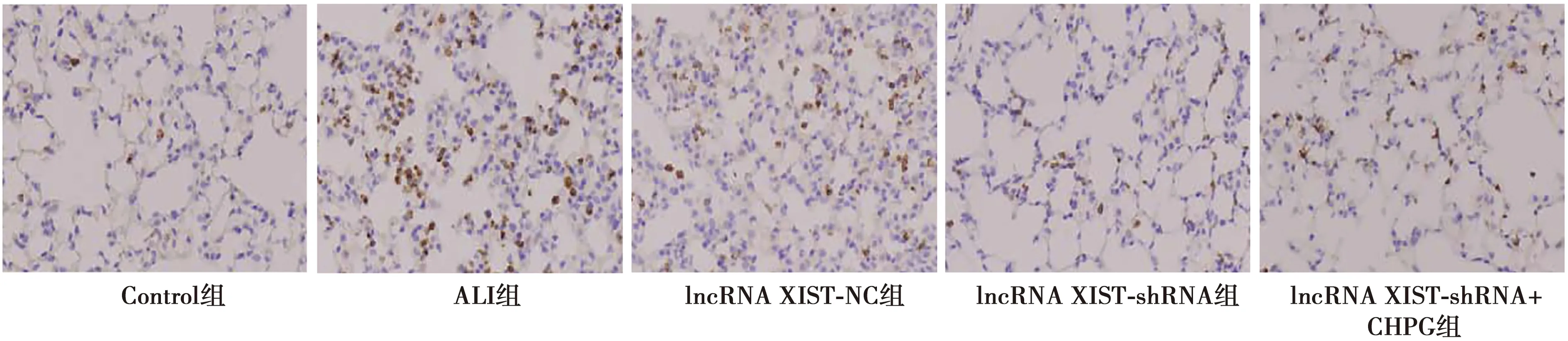
图2 各组肺组织细胞凋亡(TUNEL染色,×200)

表2 lncRNA XIST-shRNA对ALI大鼠凋亡及肺组织NF-κB/NLRP3炎性体通路相关蛋白表达的影响

1~5:Control组、ALI组、lncRNA XIST-NC组、lncRNA XIST-shRNA、lncRNA XIST-shRNA+CHPG组;图4同图3 各组肺组织中凋亡蛋白表达比较
2.5lncRNA XIST-shRNA对ALI大鼠肺组织NF-κB/NLRP3炎性体通路相关蛋白表达的影响 p-NF-κB p65、ASC、NLRP3和Cleaved caspase-1在ALI组的表达明显高于Control组(P<0.05);p-NF-κB p65、ASC、NLRP3和Cleaved caspase-1在lncRNA XIST-shRNA组的表达明显低于ALI组和lncRNA XIST-NC组(P<0.05);p-NF-κB p65、ASC、NLRP3和Cleaved caspase-1在lncRNA XIST-shRNA+CHPG组的表达显明显高于lncRNA XIST-shRNA组(P<0.05),见表2、图4。
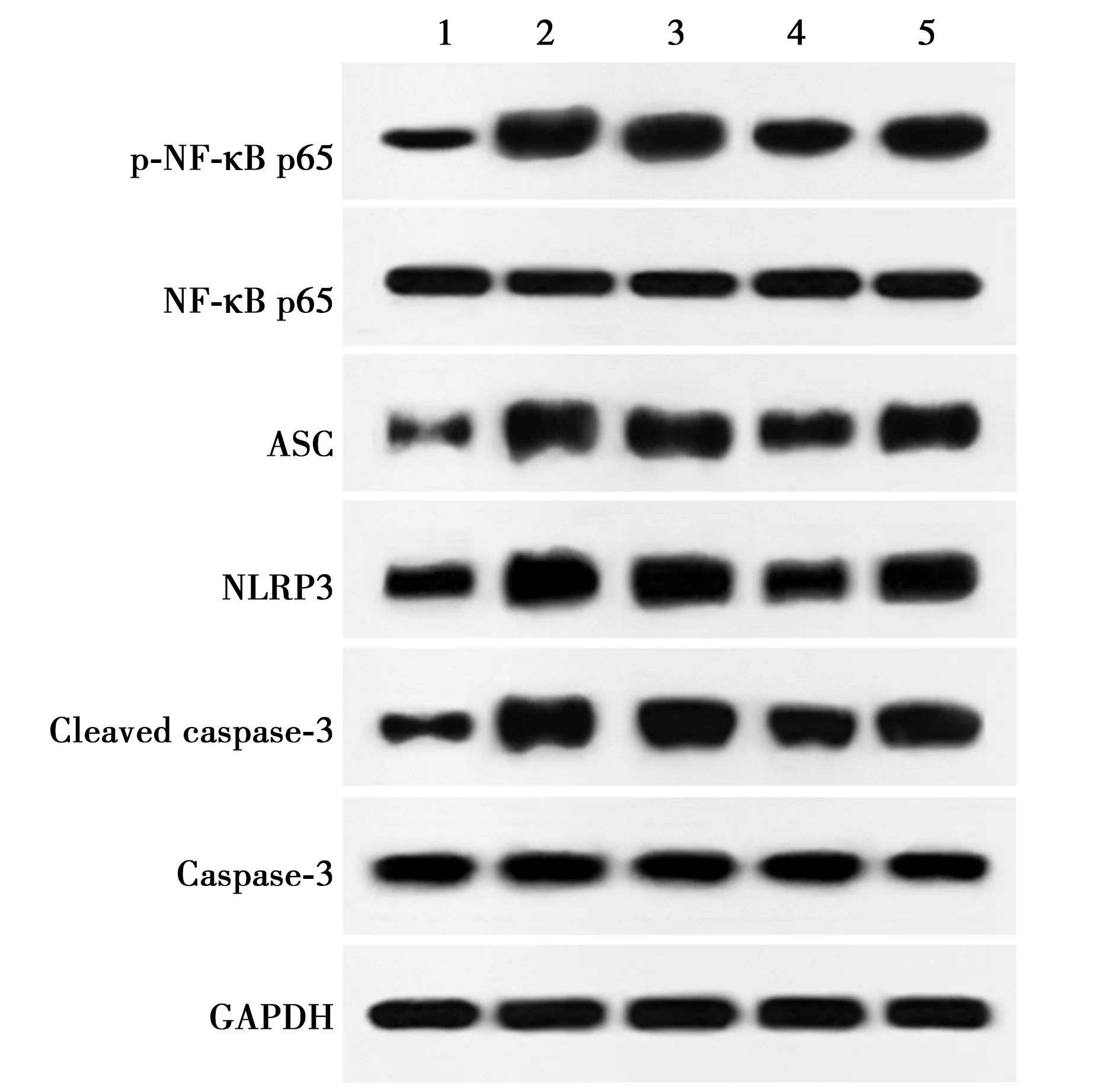
图4 各组肺组织NF-κB/NLRP3炎性体通路相关蛋白表达比较
3 讨 论
lncRNA XIST在多种疾病中均起作用。有研究表明,lncRNA XIST的敲减不仅能够减弱氧化低密度脂蛋白诱导的人脐静脉内皮细胞凋亡及炎症、氧化损伤〔9〕;也能改善脓毒症大鼠的心功能和存活率,降低细胞凋亡〔10〕;还能在体外抑制单侧输尿管梗阻小鼠肾脏的凋亡、炎症和纤维化〔11〕。上述证据均表明lncRNA XIST低表达具有抑制凋亡和炎症反应的作用。据文献〔12〕报道,ALI可导致肺组织炎症反应的发生,因而改善ALI诱导的肺组织病理损伤的最主要方式就是降低炎症反应。lncRNA XIST在ALI中的功能和作用机制还需进一步研究。
ALI患者的主要病理特征之一是肺水肿和炎症细胞的浸润。陈兰英等〔13〕研究显示,LPS诱导的ALI小鼠支气管肺泡灌洗液中炎症细胞明显增多,其中白细胞和中性粒细胞占大多数。而反映中性粒细胞数量的标志物就是MPO,已有报道〔14〕显示MPO含量在ALI大鼠肺组织匀浆中明显增多。而炎症因子水平也是评估炎症反应炎症程度的指标。研究〔15〕指出,TNF-α、IL-6、IL-1β水平升高可促进炎症反应发生。本研究结果说明LPS能够诱导大鼠产生炎症反应。W/D比值是肺水肿的主要评估方法。本文提示沉默lncRNA XIST可改善ALI大鼠的炎症反应和肺水肿,沉默lncRNA XIST能够抑制ALI大鼠的炎症反应。
肺组织细胞的过度凋亡是ALI的另一个病理特征。Caspase-3是细胞凋亡的重要调控因子,其经过切割活化后会变成Cleaved caspase-3。多项研究〔16,17〕表明,Cleaved caspase-3/Caspase-3比值的降低可以缓解LPS引起的ALI。TUNEL染色结果说明沉默lncRNA XIST可有效抑制ALI大鼠肺组织细胞凋亡。
NF-κB/NLRP3炎性体通路与LPS诱导的ALI关系密切,而NLRP3炎性体包括NLRP3、ASC、Caspase-1三个部分,在炎症方面有着非常重要的作用。Song等〔18〕发现,维拉帕米可能通过抑制NF-κB/NLRP3通路对LPS诱导的小鼠ALI产生一定的保护作用。Yang等〔19〕指出,miR-16直接靶向TLR4降低了NF-κB和NLRP3炎症小体的水平,进而改善LPS诱导的小鼠ALI。Shi等〔20〕表明,内质网钙离子结合蛋白(Rcn)3敲低通过抑制NF-κB通路和NLRP3依赖性炎症小体的激活减弱LPS诱导的ALI和肺泡炎症。本研究结果提示lncRNA XIST沉默可抑制NF-κB/NLRP3通路的激活。沉默lncRNA XIST可能通过抑制NF-κB/NLRP3通路的激活降低ALI大鼠的炎症反应和细胞凋亡。
综上所述,沉默lncRNA XIST在一定程度上可改善ALI大鼠的炎症反应和细胞凋亡,其机制是抑制NF-κB/NLRP3炎性体通路的激活,为ALI提供新的治疗策略。

