长链非编码RNA6030408B16RIK结合微小RNA-326-3p参与腹膜透析超滤衰竭发生的机制
李欣绪,周忠启,王志奎,张磊,孙丽娜,蔄瑜林
终末期肾脏病(end stage renal disease,ESRD)发病率高、病情危重且预后较差,且家庭、社会经济负担高,因而一直是全球关注的重要卫生问题[1]。腹膜透析(peritoneal dialysis,PD)以清除肾损伤病人尿毒症毒素的方式改善腹膜透析病人生活质量[2-3]。目前的统计表明,中国过去十年间腹膜透析的使用率急剧上升(超过10倍)[1]。但长期接触生物不相容性的腹透液会导致明显的腹膜纤维化(peritoneal fibrosis, PF),这些变化包括腹膜间皮细胞间充质转分化、细胞外基质沉积致间皮细胞下层增厚以及血管生成。并且高糖溶液能够引起腹膜组织发生上皮细胞向间充质细胞转化(epithelial-musenchymal transdifferentiation,EMT)[4]。反复发生腹膜炎、腹膜纤维化易致腹膜损伤后超滤衰竭(ultrafiltration failure, UFF),成为目前退出腹膜透析最主要、最常见的原因之一。据研究,包括LncRNA、miRNA等内的非编码RNA参与了腹膜透析的超滤衰竭[5-8]。刘莹等[9]报道,LncRNA NEAT-1通过miR-34a激活PI3KAKT信号通路影响上皮间质转分化。本课题组通过生物学预测网站预测了LncRNA6030408B16RIK与miR-326-3p之间的结合位点,并且前期实验已经证实LncRNA6030408B16RIK的表达下调可能改善了腹膜纤维化进程延缓了超滤衰竭的发生。本实验目的在于使用双荧光素酶报告实验以及RNA pull down实验研究LncRNA6030408B16RIK与miR-326-3p的靶向关系,在超滤衰竭的生发、始动环节进行预防,为保护腹膜功能提供新的靶点和思路。本研究于2019年7月至2020年6月通过双荧光素酶报告实验以及RNA pull down实验验证LncRNA6030408B16RIK结合miR-326-3p参与腹膜透析超滤衰竭发生的机制。
1 材料与方法
1.1 实验材料36只使用5/6肾脏切除术造模成功的尿毒症模型Sprague Dawley大鼠,体质量为185~200 g(广东省医学实验动物中心,动物许可证号SCXK,粤2013-0002)。3%戊巴比妥钠麻醉注射液、3%H2O2(美 国 Sigma-Aldrich Chemical Company),4.25%腹透液、一抗兔抗胶原Ⅲ抗体、二抗山羊抗兔免疫球蛋白G(英国Abcam Inc,Cambridge),兔源抗Collagen Ⅲ、CD31抗体,miR-326-3p模拟物、miR-326-3p抑制剂和NCs(广州RiboBio Co,Ltd.)。本研究符合一般动物实验伦理学原则。
1.2 实验方法
1.2.1 尿毒症模型构建及分组 选取40只正常喂养1周的大鼠参照文献[10-11]进行尿毒症模型构建,首先抽取大鼠尾部血测正常肌酐值,后用3%戊巴比妥钠麻醉,碘伏液消毒,选择左侧距离肋下肌约1.5 cm,平行于脊柱旁开1 cm的位置行纵行切口,依次切开大鼠的皮肤、筋膜层及肌层,识别左侧肾脏。后充分分离肾脏周围组织,结扎后将左侧肾脏的上1/3和下1/3一起取出,后用明胶海绵压迫止血,检查无出血后,逐层缝合切口。1周后以同样方法行右侧肾脏切除,确定右侧肾脏准确位置后,用丝线于肾门处结扎肾脏,后从结扎处切下右肾,检查确认无出血后,依次缝合肌层及皮肤。2次手术后都给予青霉素注射3日预防感染发生。造模手术4周后,抽取大鼠尾血测肌酐值,测量为正常值的2~3倍者则造模成功。造模手术过程中2只大鼠死亡,后有2只死于腹膜炎,将构建成功的36只大鼠尿毒症模型分为六组,每组6只大鼠(不成功大鼠已经剔除),分别为:尿毒症组(不进行腹膜透析治疗),空白组(腹膜透析4周),NC组(腹膜透析4周+转染空质粒),inhibitor NC组(腹膜透析4周+转染空质粒抑制剂),miR-326-3p mimic组(腹膜透析4周+miR-326-3p模拟物),miR-326-3p inhibitor组(腹膜透析4周+miR-326-3p抑制剂)。
1.2.2 腹膜平衡试验(PET) 大鼠腹膜透析诱导结束2 d后,将2 mL 4.25%的腹膜透析液注入大鼠腹腔中,并留取0.1 mL测量0 h大鼠的超滤量及葡萄糖转运量。透析2 h后,沿腹白线行一切口打开腹腔,抽取其中的腹透液,而后准确量取腹透液量,并用纱布吸净腹腔内残余液体,称重,后计算超滤量及葡萄糖转运量。计算方法:超滤量(ultrafiltration,UF)=(总出量-入量)mL;葡萄糖转运量(mass transfer of glucose,MTG)=(葡萄糖浓度-初始×透析液量-初始)-(葡萄糖浓度-透析末×透析液量-透析末)mmol/kg。
1.2.3 HE染色 处死大鼠后收集腹膜组织,切片制作完成后室温下干燥1.5 h。过滤去除氧化的杂质,经苏木精染色液染色5 min后,浸泡入蒸馏水中洗去多余的染色液,后以1%的盐酸乙醇分化5 s。将样品置于流水中至少洗涤30 min,直到细胞变蓝。用1%曙红染液染色1 min后,依次在梯度乙醇(70%、80%、95%、100%)中脱水,分别用 95% 和100%乙醇洗涤2次,每次5 min。然后经二甲苯(Ⅰ)、二甲苯(Ⅱ)清洗,各5 min,擦去多余的二甲苯,并在二甲苯干燥前以中性胶密封,盖上盖玻片干燥过夜。使用直立显微镜观察样品,并用CTS成像系统记录照片。
1.2.4 Masson染色 切片脱蜡后,依次经自来水、蒸馏水洗涤,细胞核用Regaud苏木精染液染色。水洗后,将切片在Ponceau酸液中浸泡8 min,在2%冰醋酸溶液中浸泡1 min。甩干玻片上的水分后以1%磷钼酸水溶液分化4 min,擦掉多余液体后,用苯胺盐染色5 min。将切片置于0.2%冰醋酸溶液和95%无水乙醇中浸泡2 min,以去除多余染液。最后,经二甲苯清洗后,以中性树胶封固。
1.2.5 免疫组化 将切片于60 ℃的恒温箱里加热1 h,浸入二甲苯溶液中脱蜡,而后依次置于梯度乙醇中脱水,然后在37 ℃的3%H2O2中孵育30 min,经磷酸盐缓冲液(PBS)洗涤后,浸入95 ℃的1%柠檬酸缓冲液中煮沸20 min。冷却至室温后,切片用PBS冲洗,在37 ℃下用山羊血清封闭10 min,后加入一抗兔抗胶原Ⅲ抗体,于4 ℃下放置12 h。然后PBS冲洗后,加入二抗山羊抗兔免疫球蛋白G(IgG),于37 ℃下孵育10 min。在标本中滴加辣根过氧化物酶标记的链霉亲和素溶液,并孵育10 min。然后将DAB显色剂加入样本中,置于室温暗室中显色8 min。切片用苏木精复染,脱水封片后,在光学显微镜下观察。
1.2.6 双荧光素酶报告实验 使用生物学预测网站(https://cm.jefferson.edu/rna22/)进行 miR-326-3p与LncRNA6030408B16RIK的结合位点分析,并获取含有作用位点的片段序列。克隆LncRNA603040 8B16RIK的全长到pmirGLO Luciferase载体上,命名为pLncRNA6030408B16RIK-Wt。利用生物信息软件预测miR-326-3p与LncRNA6030408B16RIK的结合位点,定点突变。构建pLncRNA6030408B16RIKMut载体,将 miR-326-3p 模拟物及 miR-326-3p 阴性对照物分别与荧光素酶报告载体共转染入HEK-293T细胞,然后用荧光检测仪器检测荧光强度。
1.2.7 RNA Pull Down实验 将50 nmol/L生物素化的Wt-miR-326-3p和Mut-miR-326-3p转染到大鼠腹膜间皮细胞。48 h后,收获细胞并在特异性裂解缓冲液中孵育10 min。将细胞裂解物与预涂有无RNase的牛血清白蛋白(BSA)和酵母转移RNA(tRNA)的M280链霉亲和素磁珠一起孵育。然后将小珠在4 ℃下孵育3 h,加入预冷的细胞裂解液洗涤2次。将小珠分别经低盐缓冲液洗涤3次,再用高盐缓冲液洗涤1次。通过Trizol试剂纯化的RNA,经实时定量PCR以检测LncRNA6030408B16RIK的富集。
1.2.8 实时定量PCR 使用Trizol试剂提取大鼠腹膜间皮细胞和大鼠腹膜组织中的RNA,读取260 nm及280 nm处分光光度计值,后用Nano Drop2000测定RNA的浓度和纯度。采用primer5.0和mirprimer2软件设计RT-qPCR的引物,确认后由上海吉玛有限公司(中国上海)合成。使用ABI PRISM 7500系统进行RT-qPCR。内参选用β-肌动蛋白和U6,并计算目标基因的表达。
1.2.9 蛋白质印迹法(Western blotting) 从大鼠腹膜间皮细胞和大鼠腹膜组织中提取总蛋白质,用二辛可宁酸(BCA)试剂确定每个蛋白质的浓度。蛋白质经10%的聚丙烯酰胺凝胶电泳分离后,在100 mV的恒定压力下使用湿转移法将印迹转移到PVDF膜上。加入浓度5%BSA,室温下封闭1 h,然后用抗β-肌动蛋白、α-SMA的一抗兔抗体在4℃下封闭过夜。洗涤后,加入二抗山羊抗兔IgG,并在室温下孵育1 h,然后使用化学发光试剂显影。使用Image J软件来量化谱带强度。β-肌动蛋白用作内参,靶条带与β-肌动蛋白的灰度值之比表示相对蛋白表达。
1.3 统计学方法本课题分析数据使用SPSS 21.0软件。服从正态分布和方差均匀性的数据表示为±s。使用独立样本的t检验比较两组之间的数据,而用单因素方差分析比较多组之间的数据,而后进行Tukey后检验。P<0.05时为差异有统计学意义。
2 结果
2.1 下调miR-326-3p对腹膜组织结构及功能变化和腹膜纤维化的影响(1)腹膜透析4周后,通过HE染色、Masson染色、免疫组化的实验结果观察腹膜组织结构发生的变化,与inhibitor NC组相比,miR-326-3p inhibitor组细胞变为明显的圆形,间皮基质增加并伴有许多成纤维样细胞;相反,与mimic NC组相比,miR-326-3-p mimic组的尿毒症大鼠间皮细胞成规律的扁平状,无明显巨噬细胞浸润及胶原纤维沉积。此外,miR-326-3p mimic组大鼠的腹膜厚度降低,胶原蛋白Ⅲ和CD31表达量下降,而miR-326-3p inhibitor组腹膜厚度增加,胶原蛋白Ⅲ和CD31阳性表达量明显增加。见表1。
表1 大鼠腹膜形态比较/± s

表1 大鼠腹膜形态比较/± s
注:①与模拟物空白组相比,P<0.001。②与抑制物空白组相比,P<0.001。
组别mimic NC组miR-326-3p组inhibitor NC组miR-326-3p inhibitor组F值P值鼠数6 6 6 6腹膜厚度/mm 18.57±1.95 13.11±1.36①17.32±1.88 27.18±2.82②48.84<0.001 CollagenⅢ/%22.44±2.45 6.44±0.74①20.09±3.08 44.69±5.12②142.56<0.001 CD31/%14.22±5.04 3.94±0.82①16.49±5.63 32.60±5.48②38.43<0.001
(2)通过腹膜平衡实验观察腹膜功能变化,miR-326-3p mimic组大鼠的超滤能力较mimic NC组明显增加,葡萄糖转运量明显下降;而miR-326-3p inhibitor组相比inhibitor NC组,超滤量明显下降,而葡萄糖转运量增加。见表2。
表2 大鼠腹膜超滤量及葡萄糖转运量/± s
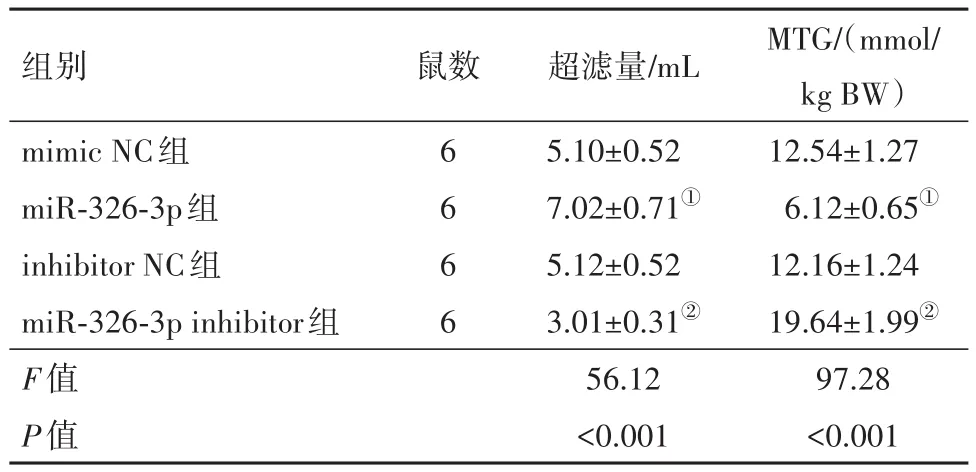
表2 大鼠腹膜超滤量及葡萄糖转运量/± s
注:MTG为葡萄糖转运量。①与模拟物空白组相比,P<0.001。②与抑制物空白组相比,P<0.001。
组别mimic NC组miR-326-3p组inhibitor NC组miR-326-3p inhibitor组F值P值鼠数6 6 6 6超滤量/mL 5.10±0.52 7.02±0.71①5.12±0.52 3.01±0.31②56.12<0.001 MTG/(mmol/kg BW)12.54±1.27 6.12±0.65①12.16±1.24 19.64±1.99②97.28<0.001
(3)RT-PCR和Western blotting的结果显示,miR-326-3p mimic组中,间皮细胞转分化的标志物α-SMA、FSP1和波形蛋白表达下降,E-钙黏蛋白表达增加,在miR-326-3p inhibitor组中结果相反。见表3,表4。
表3 大鼠腹膜中mRNA的表达水平/± s

表3 大鼠腹膜中mRNA的表达水平/± s
注:FSP1为成纤维细胞特异性蛋白-1,α-SMA为α-平滑肌肌动蛋白,Vimentin为波形蛋白,E-cadherin为E-钙黏蛋白。①与模拟物空白组相比,P<0.001。②与抑制物空白组相比,P<0.001。
组别mimic NC组miR-326-3p组Inhibitor NC组miR-326-3p inhibitor组F值P值鼠数6 6 6 6 FSP1 1.02±0.14 0.38±0.04①1.01±0.12 1.69±0.18②104.26<0.001 α-SMA 0.99±0.10 0.42±0.04①1.03±0.12 1.54±0.16②103.95<0.001 Vimentin 1.00±0.10 0.59±0.06①0.99±0.10 1.63±0.17②88.87<0.001 E-cadherin 1.01±0.12 1.90±0.19①1.02±0.12 0.58±0.05②108.05<0.001 miR-326-3p 1.01±0.13 2.56±0.26①1.01±0.11 0.31±0.04②221.15<0.001
表4 大鼠腹膜中蛋白质的表达水平/± s

表4 大鼠腹膜中蛋白质的表达水平/± s
注:α-SMA为α-平滑肌肌动蛋白,FSP1为成纤维细胞特异性蛋白-1,Vimentin为波形蛋白,E-cadherin为E-钙黏蛋白。①与模拟物空白组相比,P<0.001。②与抑制物空白组相比,P<0.001。
组别mimic NC组miR-326-3p组inhibitor NC组miR-326-3p inhibitor组F值P值鼠数6 6 6 6 α-SMA 0.81±0.09 0.51±0.06①0.92±0.09 1.57±0.16②107.78<0.001 FSP1 0.62±0.08 0.22±0.03①0.64±0.07 1.16±0.18②82.80<0.001 Vimentin 0.96±0.10 0.61±0.06①0.92±0.10 1.72±0.17②101.60<0.001 E-cadherin 1.14±0.14 1.99±0.21①1.14±0.15 0.62±0.06②85.01<0.001
2.2 LncRNA6030408B16RIK与miR-326-3p靶向关系验证通过生物学预测网站分析miR-326-3p与LncRNA6030408B16RIK的结合位点,双荧光素酶实验结果显示与miR-326-3p mimic相结合的LncRNA6030408B16RIK-Wt的荧光带强度明显下降,而LncRNA6030408B16RIK-Mut的强度相较于NC组则无明显变化;RNA pull down实验中,与Wt-miR-326-3p结合的LncRNA6030408B16RIK富集量明显高于Mut-miR-326-3p组。结果说明LncRNA603040 8B16RIK特异性结合miR-326-3p。见表5,6。
表5 与miR-326-3p结合LncRNA6030408B16RIK的荧光强度/± s
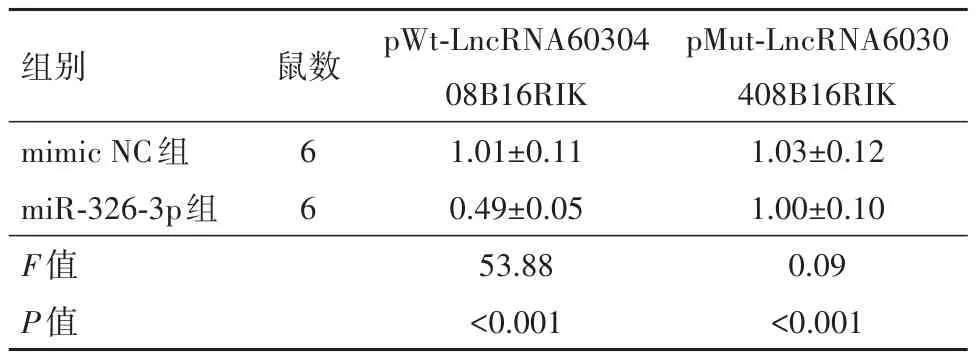
表5 与miR-326-3p结合LncRNA6030408B16RIK的荧光强度/± s
组别mimic NC组miR-326-3p组F值P值鼠数6 6 pWt-LncRNA60304 08B16RIK 1.01±0.11 0.49±0.05 53.88<0.001 pMut-LncRNA6030 408B16RIK 1.03±0.12 1.00±0.10 0.09<0.001
表6 与LncRNA6030408B16RIK结合miR-326-3p的富集量/± s

表6 与LncRNA6030408B16RIK结合miR-326-3p的富集量/± s
注:①与空白组相比,P<0.001。
组别NC组Wt-miR-326-3p组Mut-miRNA-326-3P组F值P值鼠数6 6 6 miR-326-3p 1.01±0.12 2.87±0.29①1.02±0.12 90.98<0.001
3 讨论
腹膜透析 (PD) 是终末期肾病治疗常用的重要连续替代方案,在生存、病人独立性和医疗保健成本方面具有相当大的初始益处[3]。然而,其更广泛使用的障碍之一是基于葡萄糖的PD溶液由于纤维化对腹膜的形态完整性和功能产生影响。主要是由高糖刺激引起的,通过激活多种细胞因子和转录因子信号通路影响胶原蛋白和其他细胞外膜成分的合成,使腹膜发生上皮间充质转分化,致超滤衰竭的发生,但具体机制尚不清楚[12]。越来越多的证据证明了不同类别的非编码 RNA (ncRNA)在腹膜纤维化中的调节作用。miRNA属于一类独特的ncRNA,目前研究显示miRNA通过介导多种信号通路参与了上皮间质转分化过程[13-16]。miR-326-3p在肾脏肿瘤疾病中对细胞增殖、侵袭、迁移和凋亡有重要影响,且在一些女性相关疾病(包括宫颈癌、子宫内膜癌、乳腺癌和多种自身免疫性疾病)中存在异常表达[17-20]。本课题探讨了miR-326-3p是否通过EMT参与了腹膜纤维化过程,HE染色、Masson染色、免疫组化结果表明miRNA-326-3p mimic组细胞排列规则,形态呈扁平状,无明显间皮细胞脱落、间质增厚、巨细胞浸润表现;而miRNA-326-3p inhibitor组中作为间皮细胞转分化标志物的α-SMA和波形蛋白表达上调,而E-钙黏蛋白表达下调说明发生了腹膜纤维化。Katsunori等[21]发现,与正常小鼠相比,腹膜纤维化的小鼠中miRNA表达异常。大量研究表明miR-15b、miR-21促进腹膜纤维化的发生,而miR-200c、miR-29b和miR-30a则一定程度上抑制纤维化的发生[13]。这些研究间接验证了我们的实验中miRNA-326-3P过表达可延缓腹膜纤维化的进程。
本课题组前期实验已经证实下调LncRNA6030 408B16RIK的表达可延缓大鼠超滤衰竭的发生,且经生物学预测网站分析LncRNA6030408B16RIK与miRNA-326-3p存在靶向结合位点。有研究显示LncRNA结合miRNA介导不同的通路,调节下游蛋白质的表达,对细胞的增殖、转移和上皮间质转分化产生影响[22-28]。本实验采用 RT-PCR、Western blotting等方法,检测大鼠腹膜组织中LncRNA6030408B 16RIK与miR-326-3p相关基因和蛋白的表达水平,且通过双萤光素酶实验对LncRNA6030408B16RIK与miR-326-3p的靶向关系进行研究。结果显示miR-326-3p mimic组与mimic NC组相比LncRNA6030408B16RIK-Wt富集量明显升高,而LncRNA6030408B16RIK-Mut的富集量在两组中差异无统计学意义;且与NC组以及LncRNA6030408B16 RIK-Mut组相比,miR-326-3p与LncRNA6030408B16 RIK-Wt相结合的荧光强度明显下降,说明LncRNA6030408B16RIK与miR-326-3p存在相互作用。通过本实验可得出结论,LncRNA6030408B16RIK通过结合miR-326-3p参与腹膜透析大鼠的超滤衰竭,过表达miR-326-3p可一定程度上抑制尿毒症大鼠腹膜透析超滤衰竭的发生,或可为我们预防超滤衰竭延缓腹膜纤维化提供新的思路。目前有文献表明mi-RNA可调控WISP因子影响足细胞的上皮间质转分化以及器官的纤维化[29-31]。目前经过生物预测网站分析,miR-326-3p与WISP因子存在靶向结合位点,可在以后阅读大量文献后,设计更加科学的实验以此作为进一步研究的方向。

