双特异性抗体在抗人类免疫缺陷病毒方面的研究进展
刘广文,秦嘉萍,顾汇权,刘嫱
艾滋病(acquired immunodeficiency syndrome,AIDS)是威胁人类健康的重大传染病之一。经典的抗逆转录病毒药物治疗(antiretroviral therapy,ART)[1]能够极好地抑制感染,但它们无法清除人类免疫缺陷病毒(HIV),且存在耐药性。单克隆抗体(mAb)具有高度特异性,是预防感染性疾病最有效的方法,由于其广度的有限性,需使用mAb组合疗法[2-4]。双特异性抗体是在mAb的基础上,对其进行有目的的加工而获得的工程抗体,具有非常强的抗HIV活性[5-6]。本文综述了近期国内外文献中有关靶向不同抗原表位HIV双特异性抗体研究的报道,以期为更深入的研究提供参考。
1 双特异性抗体的分子结构
双特异性抗体可大致划分为两种分子形式:含有Fc区的IgG类和不含Fc区的非IgG类[7]。IgG类双特异性抗体,有两个Fab区和一个Fc区,相对分子质量较大(>100 000 kD),具有较长的半衰期[8],稳定性更高。非IgG类的双特异性抗体,由两个抗体的VL区和VH区组成,没有Fc区,有些也会由Fab片段组成,分子量(30~50 kD)小于整个IgG(150 kD),有助于穿透组织。但由于肾脏清除速率快,导致半衰期短,需要持续输送用于延长作用时间[9-10]。
在抗病毒免疫治疗中,与传统单抗的组合治疗不同,双特异性抗体能够同时靶向两个甚至多个靶点,治疗效果更好。目前双特异性抗体分子结构正在不断创新,越来越多的新结构被设计出来,为多价抗体的设计提供了基础的技术平台。
2 抗HIV双特异性抗体
双特异性抗体主要基于病毒和宿主细胞上特定的抗原表位,通过结构修饰而得到的[11-13],双特异性抗体在抗癌及抗炎领域已取得了巨大进步,如今已开始探索将其应用到抗HIV领域[14],针对不同靶向的双特异性抗体如表1所示。
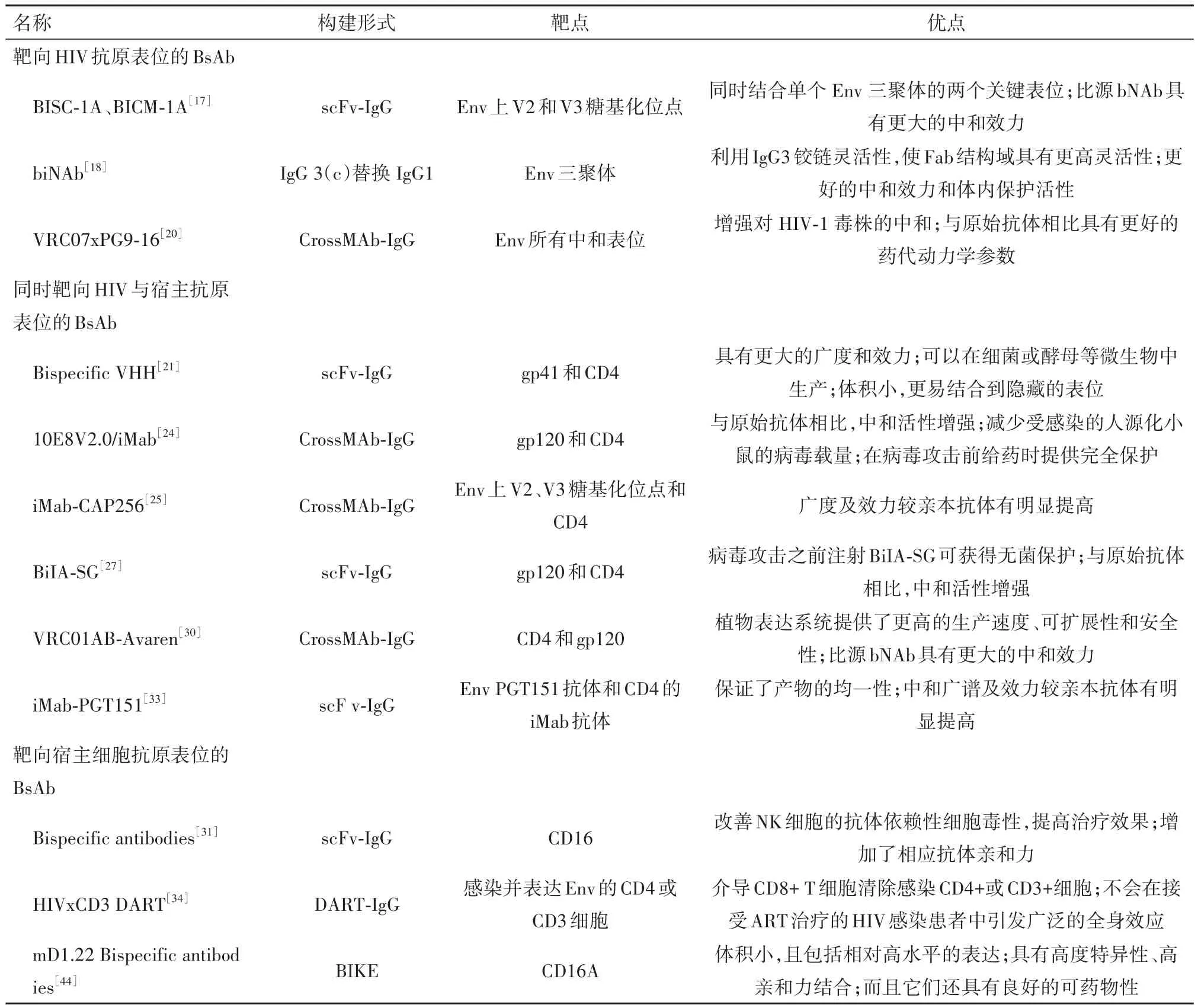
表1 处于研发阶段的抗HIV双特异性抗体
2.1 靶向HIV抗原表位的BsAb该种类型的抗体主要靶向HIV上的抗原表位,在源头上抑制病毒的功能[15-16]。基于此,Davis-Gardner等[17]报道了基于HIV包膜蛋白(Env)上V2和V3糖基化位点设计的双特异性抗体,具体来说,在一个抗体臂上带有单链(scFv)形式的CAP256.VRC26.25 V2糖基化位点抗体,在另一个抗体臂上带有完整的Fa形式的10-1074 V3糖基化位点抗体,另外在Fc区域引入了KIH结构,得到了BISC-1A和BICM-1A, BISC-1A是由CAP256.VRC26.25单链和10-1074组成的双特异性抗体,而BICM-1A是由CAP256.VRC26.25和10-1074完整单抗组成cross-Mab结构的双特异性抗体。这两种组合都能更有效地中和分离株,可能是因为它们同时与Env的顶点和V3-聚糖表位结合显著增加双特异性抗体的效力。数据显示,BISC-1A比BICM-1A具有更好的亲和力,推测与完整的Fab结构域相比,CAP256.VRC26.25的单链抗体Fc形式可能更好地将双特异性抗体的Fc结构域定位在V3糖基化位点附近。
Bournazos等[18]开发了一种新的抗HIV双特异性抗体,这种抗体的IgG区改造为IgG3亚型(IgG3C),同时保留IgG1 Fc的功能特性[19]。体外实验表明,IgG区结构与抗体的中和能力有着密切的联系,未经过IgG区改造的双特异性抗体中和能力相比单抗未有明显提升,表明IgG1亚型的双特异性抗体与传统的单抗相比没有优势。推测可能由于两个Fab臂缺乏足够的灵活性,无法实现Env三聚体的异二价相互作用。而将IgG区改造为IgG3C的双特异性抗体,由于两个Fab臂的长度增加,其韧性和灵活度也增加了,同时加强了Env三聚体的异二价相互作用,这种方法对整体IgG结构的改变最小,也显著增强中和广度和效力。在感染 HIV-1 的人源化小鼠中该抗体显示出比亲本更强的中和活性,异二价BsAb能够增强与Env的相互作用,从而通过FcgR介导的机制促进病毒颗粒和感染细胞的清除。
有研究者使用CrossMab 技术构建出四种双特异性IgG[20],每个臂都可以靶向不同表位,这些双特异性IgG可以中和94%至97%的病毒,表现出比亲本抗体更高的中和广度和效力,其中VRC07 x PG9-16的广度优于任何一种单独抗体,中和了病毒中的97%,平均IC50为0.055 mg/L。这种双特异性IgG在体内药代动力学参数方面也与其亲本抗体组合相似。
2.2 同时靶向HIV与宿主抗原表位的BsAb此类抗体能够同时靶向病毒的表位与免疫细胞的表位,有利于免疫细胞对病毒进行定位,从而达到抗HIV的目的[15-16]。Strokappe等[21]参考骆驼或其他骆驼科的纯重链抗体(VHH)开发出新一代双特异性抗体。单价VHH抗体由于体积小和超过平均长度的CDR3可以结合到隐藏的CD4结合位点,且通常在高温下稳定。基于这些特性,为了进一步增加广度和效力,构建了双特异性VHH,包含J3或3E3以及结合独立表位的VHH。实验表明N端带有CD4bs VHH的双特异性VHH中和效果优于C端带有CD4bs VHH的双特异性VHH。使用含有2E7或11F1F构建的双特异性VHH,对HIV C分支病毒96ZM651.02和ZM214表现出了更高的中和效力。其中J3-11F1F和3E3-11F1F对ZM214的效力增加了200多倍,而单体11F1F在浓度低于1 μmol/L时无法中和该病毒。对此的合理解释可能是J3或3E3的结合引起构象变化,使11F1F结合或增强11F1F结合,从而确认HR1中间构象上可能存在一个表位。
值得注意,基于结构修饰的BsAb虽然提高了其抗病毒的效能,但偏离正常抗体结构,不利于药代动力学和潜在免疫原性的研究,同时生产纯化这种抗体也是一种挑战[13,22-23]。Huang等[24]通过 Cross-Mab技术构建出具有正常结构的10E8V2.0/iMab和10E8V1.1/P140两种BsAb,其中10E8V2.0/iMab能中和118种HIV-1假型病毒,且能抑制HIV-1感染小鼠的病毒载量,提前给药能提供完全保护。Moshoette等[25]设计的iMab-CAP256双特异性抗体可能与10E08-iMab在中和广度和效力上互补,10E08-iMab和iMab-CAP256联合使用,可能会有更好的中和效果。无独有偶,在人源小鼠中,Wu等[26]设计的BiIASG双特异性抗体不仅表现出比亲本分子更强的中和效力,且在HIV攻击之前注射BiIA-SG即可获得无菌保护。Niu等[27]在中华猕猴的体内实验表明,提前注射BiIA-SG可以防止中华猕猴感染SHIVSF162P3CN病毒[28],而在病毒激发后的第1天或第3天,单次注射BiIA-SG可显著降低病毒血症峰值,接受BiIA-SG治疗的中华猕猴延迟疾病进展数年。相比之下,未经治疗的中华猕猴在2年内发展为SHIV。通过抗CD8b抗体耗竭实验确定,BiIA-SG诱导与CD8+T细胞长期保护作用相关[29],该发现提供了双特异性抗体治疗诱导非人灵长类中T细胞免疫的概念证明,这保证了BiIA-SG用于HIV-1预防和免疫治疗的临床开发。
Seber Kasinger等[30]描述了一个基于植物的瞬时表达系统生产的双特异性抗体VRC01Fab-Avaren,由靶向CD4结合位点的mAb VRC01的抗原结合片段(Fab)和靶向gp120的抗病毒凝集素(Avaren)组成的新型双特异性抗体。有趣的是,VRC01Fab-Avaren以烟草花叶病毒为载体在烟草中表达。初步试验表明,VRC01AB-Avaren显示出比二价母体分子VRC01-IgG和Avaren-Fc更强的中和作用,IC50值范围为48-310 pM。这些结果支持了基于植物的瞬时过表达系统构建的双特异性抗体,与传统的基于细胞培养的方法相比,植物表达系统提供了更高的生产速度、可扩展性和安全性[31-32],使其成为药物蛋白生产的一个有吸引力的选择,为开发更有效的双特异性和三特异性抑制剂提供了一个更好的平台。郑钦文等[33]也报道了一种新型单基因编码的串联双特异性抗体iMab-PGT151,由靶向CD4的iMab抗体和靶向gp120和gp41交界面的PGT151抗体组成。该抗体由单一基因编码,保证了产物的均一性,生产和纯化更加方便高效。
2.3 靶向宿主细胞抗原表位的BsAb此类抗体靶向宿主细胞的抗原表位,招募免疫细胞对其清除[15-16]。Sung等[34]设计了一种可以招募效应T细胞的双特异性抗体(HIV×CD3 DART),该双特异性抗体一臂可以和受感染的宿主细胞抗原表位相连,另一臂是单价CD3抗体可以和效应T细胞结合。HIV×CD3 DART可以锚定受感染并表达Env的细胞,重定向效应T细胞特异性杀灭这些细胞。但当HIV患者使用抗逆转录病毒药物治疗时,在没有病毒感染的靶细胞的情况下,未观察到T细胞活化,可能由于HIV×CD3 DART只能作用于感染并表达Env的靶细胞。Pollara等[35]使用人类脐带血作为新生儿免疫系统的模型,以此来评估HIV×CD3 DART分子招募和重定向效应T细胞的能力,从脐带血中分离的T细胞相较于成人外周血分离的细胞,其杀伤力有所降低,这是由于缺乏记忆和效应CD8 T细胞。当它们被双特异性DART分子重定向时,它们的溶细胞作用可以达到最强[35]。Dashti等[36]对感染SHIV.C.CH505.375H.dCT的恒河猴分别进行抗逆转录病毒治疗和HIVxCD3 DART分子的混合物治疗,发现实验组和对照组在使用AZD5582+DART分子治疗前后CD4+T细胞中总vDNA的水平稳定,研究发现在没有潜伏期逆转的情况下,HIVxCD3 DART分子不能在体内清除感染细胞,而潜伏期逆转是诱导Env表达和允许DART分子识别的必要条件。
Ramadoss等[31]以增强针对HIV感染细胞的自然杀伤(NK)细胞ADCC为目的设计的双特异性抗体,该抗体由针对HIV-Env保守gp41残基的单抗,和针对NK细胞上激活受体CD16的高亲和力scFv组成,通过CD16将NK细胞连接到HIV感染的靶点,CD16是NK细胞激活的有效触发器[37],从而迫使NK细胞与这些细胞接触并被激活。实验表明,与相应单克隆抗体相比,bsAbs对 gp41和CD16的亲和力增加,由于bsAb能够同时与NK细胞表面的两个CD16受体结合,因此其亲和力比单抗更高。此外,最近的研究表明[38],HIV通过隐藏Env数量以及ADCC表位,以此阻碍ADCC抗体的识别,有研究者猜测,由于HIV Vpu和Nef对CD4的下调,降低了Env进入CD4结合构象的可能性[39-40]。为了克服感染细胞表面的CD4下调,研究者设计了CD4mc,其可以结合Env并诱导CD4结合构象,能够改善ADCC介导抗体与Env的结合,并使HIV感染细胞对ADCC敏感[41-443]。Li等[44]设计的双特异性杀伤细胞接合器BiKEs,通过激活受体CD16A与自然杀伤(NK)细胞结合,将其引导至表达Env的细胞并消除。他们通过柔性连接体将靶向CD4的mD1.22融合到CD16A的抗体结构域,由于其尺寸小且完全来源于人类,可以有效穿透组织找到隐藏的CD4表位,并通过CD16A引导NK细胞杀死HIV-1感染的细胞。实验显示,该BiKEs能够结合所有HIV-1分离物的可能性,这些分离物体积小,完全来自人类,结合它们的高亲和力和特异性,激活与CD16A的相互作用,导致HIV-1感染细胞的裂解,表明它们是有希望的候选疗法,值得在动物模型和人类中进一步评估,以治疗HIV-1感染。
3 总结与展望
随着基因工程抗体的快速发展,双特异性抗体技术也日趋成熟,数十个BsAb已经进入临床研究阶段,三个双特异性抗体已批准上市并应用于肿瘤以及炎症方面的治疗,在病毒免疫治疗方面也已起步。HIV双特异性抗体通过改变结构作用于病毒和宿主细胞的不同靶点,具有更好的效力、广度,值得进一步研究。但Env的多样性、mAb的病毒逃逸突变和进入淋巴结或中枢神经系统中的滤泡区等解剖部位(病毒可以在这些部位建立宿主)仍是基于BsAb治疗的主要挑战。在未来,抗HIV双特异性抗体药物开发非常重要,基于结构设计的抗体将会越来越多,不论是其单独使用或与其他抗HIV疗法联合,都必将成为有效的治疗方案。

